6-BA、GA3和IBA对香水百合叶绿素含量及抗氧化物酶活性的影响
2012-06-08赵莉潘远智朱峤岳静米仕洪
赵莉,潘远智,朱峤,岳静,米仕洪
(四川农业大学风景园林学院,四川 成都611130)
百合(Liliumspp.)是单子叶植物亚纲百合科(Liliaceae)百合属(Lilium)所有种类的总称,是多年生鳞茎类球根草本植物[1],其种类繁多,花大色艳,有白、黄、红、橙、粉色及复色等多种色彩,花姿奇特而优美,具有较高的观赏价值和经济价值,因而深受人们喜爱,并成为世界名花之一。香水百合(Liliumcasablanca)素有“百合女王”之美称,又因其独特的香气以及美好的寓意,越来越受到人们的关注与青睐,作为鲜切花已经开始在市场上占领了一席之地。
随着花卉业的蓬勃发展,植物生长调节剂在花卉生产上的应用研究也越来越广泛,已成为提高花卉产量和品质的重要手段之一,为现代化花卉生产提供了一种新的技术方法,从而获得能够满足人们要求的花卉产品。植物生长调节剂是一种人工合成的具有植物激素活性的物质,从外部施入经植物吸收进入体内而达到调节植物生长发育的目的[2]。由于不同的花卉种类对不同的植物生长调节剂有着不同的反应,各类激素又因浓度、种类、时间等因素对植物都存在一定影响,因此在某一种作物或品种上施用同一种植物生长调节剂,往往会出现迥然不同的处理结果,而多种类的植物生长调节剂配合使用是否能得到更理想的控制效果,还需要进一步研究。前人研究表明在入库前用GA3预处理百合可以延缓出库后叶片含水量、叶绿素、可溶性蛋白质、糖含量和CAT活性的降低,降低POD活性同时叶片的黄化被有效地抑制[3]。蔡军火等[4]通过用单一的外源激素对百合形态及切花品质进行了研究,表明外源激素处理能提高切花品质。朱东兴等[5]研究发现6-BA和GA3与蔗糖等混合施用,能显著延长百合的瓶插寿命。蔡宣梅等[6]、B1ankenship等[7]的研究表明复合生长调节剂可以使百合植株提前开花,具有较好的商业价值。
目前关于植物生长调节剂对百合的研究主要集中在单一或混合激素处理对百合形态、花期调控及保鲜上的研究,而对其光合作用相关指标和抗氧化性的研究却较少。国内关于多种类的植物生长调节剂配合使用对百合各个时期光合作用和生理效应的报道较少。为此,本试验通过采用6-BA、GA3、IBA三种植物生长调节剂混合,对香水百合进行不同时间的浸球处理,探讨植物生长调节剂对香水百合光合色素及相关酶活性的影响,以期为植物生长调节剂在香水百合中的应用提供理论依据,指导生产实践中合理有效的使用植物生长调节剂,以实现鲜切花促成栽培,提高观赏效果及切花品质,满足人们的需求。
1 材料与方法
田间试验于2010年4—8月在四川省雅安市四川农业大学教学农场4号温室大棚内进行。
1.1 供试材料
供试材料为荷兰进口香水百合‘天霸’,选择周径为14~16cm,鳞片抱合紧密、无病虫害、鳞茎盘无损伤的独头鳞茎。先将50%可湿性多菌灵配成200倍液浸泡百合种球40min进行种球消毒,捞出后用清水洗去种球表面的药液备用。
1.2 试验设计
试验采用L16(44)正交组合设计(表1)。GA3、IBA、6-BA和浸球时间分别设置4个水平。将备用种球分别用不同浓度的GA3、IBA、6-BA混合液处理,1号处理采用蒸馏水浸球10min,作为对照。将处理后的种球晾干后定植于种植槽中。每个处理10个球,3次重复。
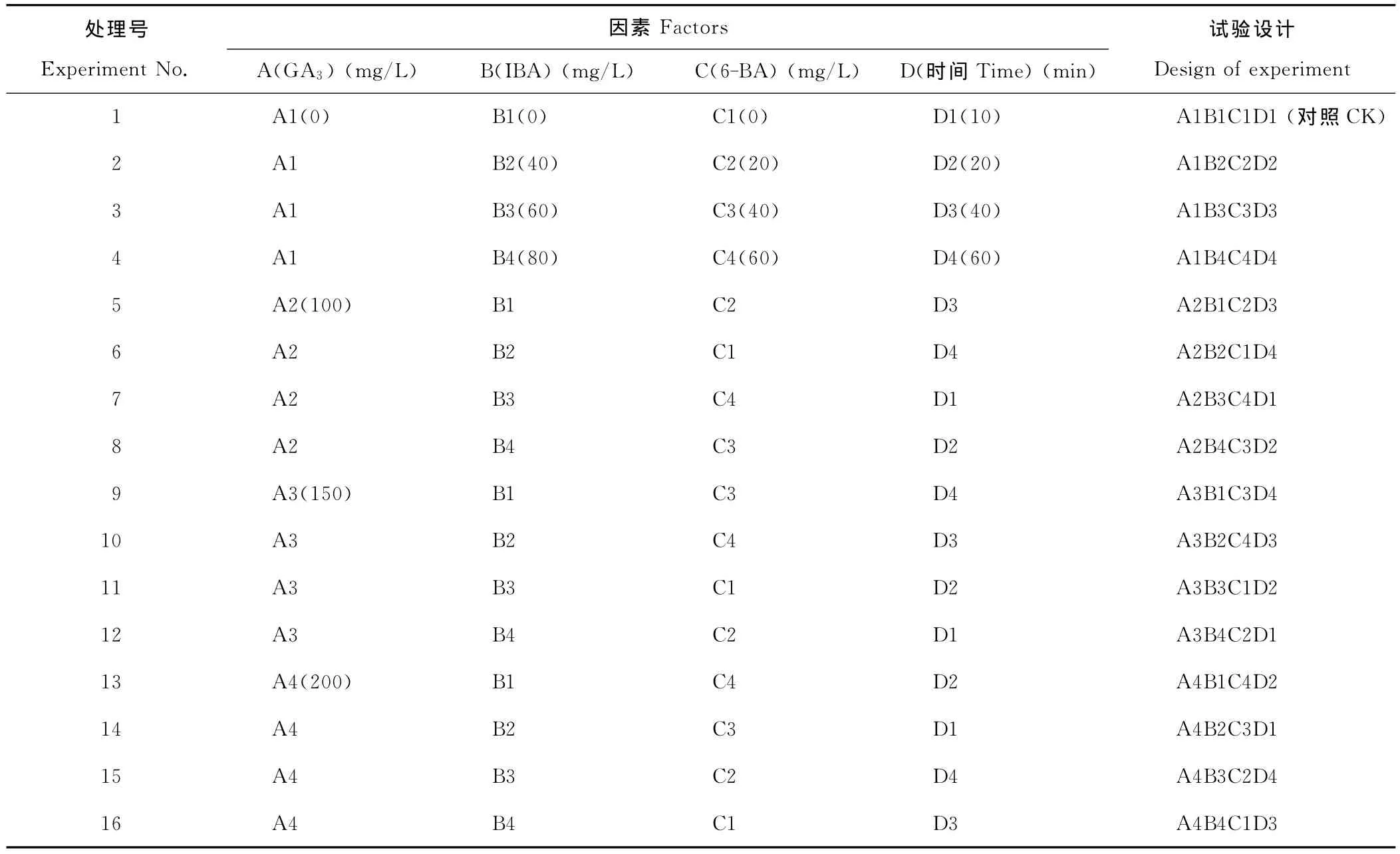
表1 正交设计表L16(44)Table 1 The orthogonal design L16(44)
1.3 测定项目与方法
处理后分别于生长初期(5~6片叶)、现蕾期、初花期、盛花期、花衰败后5个时期进行混合采样。从上往下数,生长初期摘取供试植株上第2,3片叶,其余4个时期第5,6片叶,去中脉剪碎后进行充分混合,对各项指标进行3次重复测定,取其平均值。参考彭桂群和王力华[8]对花期的划分为:5%的花蕾已经形成完整花,80%的花蕾已经露瓣,即初花期;80%的花蕾已经形成完整花,即盛花期;80%的花已经开始凋谢、枯萎,即终花期。
采用乙醇-丙酮混合液(1∶1)浸提法测定叶绿素a、b含量[9]。采用氮蓝四唑光还原法测定超氧化物歧化酶(SOD)活性[10]。采用紫外分光光度法测定过氧化氢酶(CAT)活性[11]。采用硫代巴比妥酸法测定丙二醛(MDA)含量[12]。
1.4 数据处理
数据采用SPSS 17.0For Windows和Excel进行数据分析。
2 结果与分析
2.1 植物生长调节剂对香水百合叶绿素a含量的影响
经过不同植物生长调节剂组合对香水百合浸球处理,与对照相比,不同时期叶绿素a的含量均高于对照组,且呈先上升后下降的趋势(表2),在现蕾期达到最大值。生长初期,10号处理的叶绿素a含量最高,比对照高15.45%,其次为7号处理(A2B3C4D1)、8号处理。现蕾期10号处理的叶绿素a含量最高,比对照高12.95%,其次为7号处理、14号处理。初花期,叶绿素a下降,但10号处理的叶绿素a含量最高,比对照高25.20%,其次为7号处理、9号处理。盛花期,10号处理的叶绿素a含量最高,比对照高34.95%,其次为9号处理、7号处理。花衰败后,10号处理(A3B2C4D3)的叶绿素a含量最高,比对照高53.77%,其次为7号处理、9号处理。说明通过植物生长调节剂处理后,均能不同程度的减缓叶片内叶绿素a含量的下降,延长叶片光合功能期。

表2 叶绿素a含量的变化Table 2 Changes of chlorophyll a content mg/g
2.2 植物生长调节剂对香水百合叶绿素b含量的影响
叶片的叶绿素b含量在整个生长发育期均呈先上升后下降的趋势(表3),在初花期达到最大值。植物生长调节剂处理后,各处理的叶绿素b含量均比对照高,减缓了叶片叶绿素b含量下降的趋势。生长初期,10号处理的叶绿素b含量最高,比对照高23.11%,且与各处理间差异显著。现蕾期10号处理的叶绿素b含量最高,比对照高26.73%,其次为12号处理、7号处理。初花期,10号处理的叶绿素b含量最高,比对照高23.37%,其次为15号处理、7号处理。盛花期,10号处理的叶绿素b含量最高,比对照高38.50%,其次为12号处理、7号处理。花衰败后,10号处理的叶绿素b含量最高,比对照高54.16%,其次为7号处理、12号处理。说明植物生长调节剂处理后,能有效的减缓叶片叶绿素b的降解,有利于植物的光合作用。
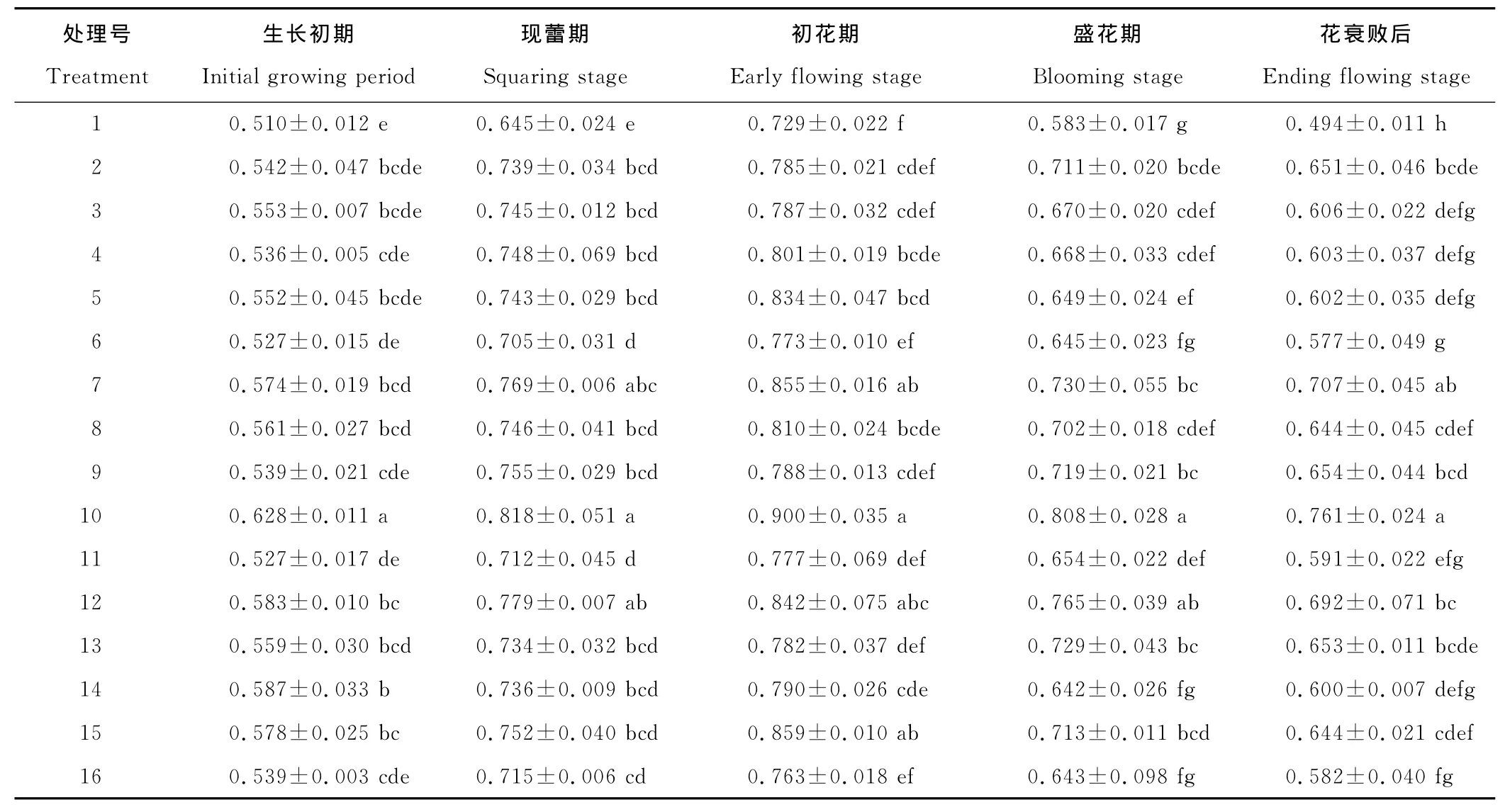
表3 叶绿素b含量的变化Table 3 Changes of chlorophyll b content mg/g
2.3 植物生长调节剂对香水百合叶绿素总量的影响
总叶绿素含量同叶绿素a和叶绿素b的变化趋势一致,呈先上升后下降的趋势(表4)。除对照、3号处理、11号处理、16号处理的叶绿素总量在现蕾期达到最大值外,其余处理均在初花期达到最大值。植物生长调节剂处理后的叶片总叶绿素含量均比对照高。生长初期,10号处理的总叶绿素含量最高,比对照高17.77%,其次为7号处理、14号处理。现蕾期10号处理的总叶绿素含量最高,比对照高17.63%,其次为7号处理、12号处理。初花期,10号处理A3B2C4D3的总叶绿素含量最高,比对照高24.47%,其次为7号处理、15号处理。盛花期,10号处理的总叶绿素含量最高,比对照处理高36.26%,其次为12号处理、7号处理。花衰败后,10号处理的总叶绿素含量最高,比对照高53.92%,其次为7号处理、12号处理。说明植物生长调节剂处理后,能提高叶绿素总量,减缓叶绿素的降解,从而有利于香水百合的光合作用,为开花提供物质条件,延缓了植株的衰老。
2.4 植物生长调节剂对香水百合叶片SOD活性的影响
植物生长调节剂处理对香水百合叶片中SOD活性有显著影响,整体呈先上升后下降的趋势,处理后酶的活性下降减缓(表5)。对照处理、6号处理、11号处理、15号处理在现蕾期达到最大外,其余处理均在初花期达到最大值。16号处理一直呈下降趋势,可能是植物自身细胞内的活性物质受到损伤,致使SOD活性下降。在整个生长发育阶段,10号处理的SOD 活性最高,不同阶段分别比对照高47.69%,55.28%,88.91%,149.79%,517.91%。7号处理、12号处理处理后的叶片SOD活性也维持在较高水平,与对照的差异显著。说明不同浓度的植物生长调节剂能显著提高香水百合SOD活性,提高了自身清除O2-的能力,对细胞膜的保护作用增强,抗逆性提高。
2.5 植物生长调节剂对香水百合叶片CAT活性的影响
植物生长调节剂处理后,CAT活性呈先上升后下降的趋势(表6)。对照处理、6号处理、11号处理、14号处理、15号处理在现蕾期达到最大外,其余处理均在初花期达到最大值。10号处理在整个生长发育阶段的CAT活性保持最高,不同阶段分别比对照处理高380.73%,199.38%,225.00%,338.76%,766.07%。整个生长发育阶段,7号处理、12号处理处理后的叶片CAT活性也维持在较高水平,仅次于10号处理。说明植物生长调节剂处理有利于香水百合叶片内活性氧的清除,增强了抗衰老能力。
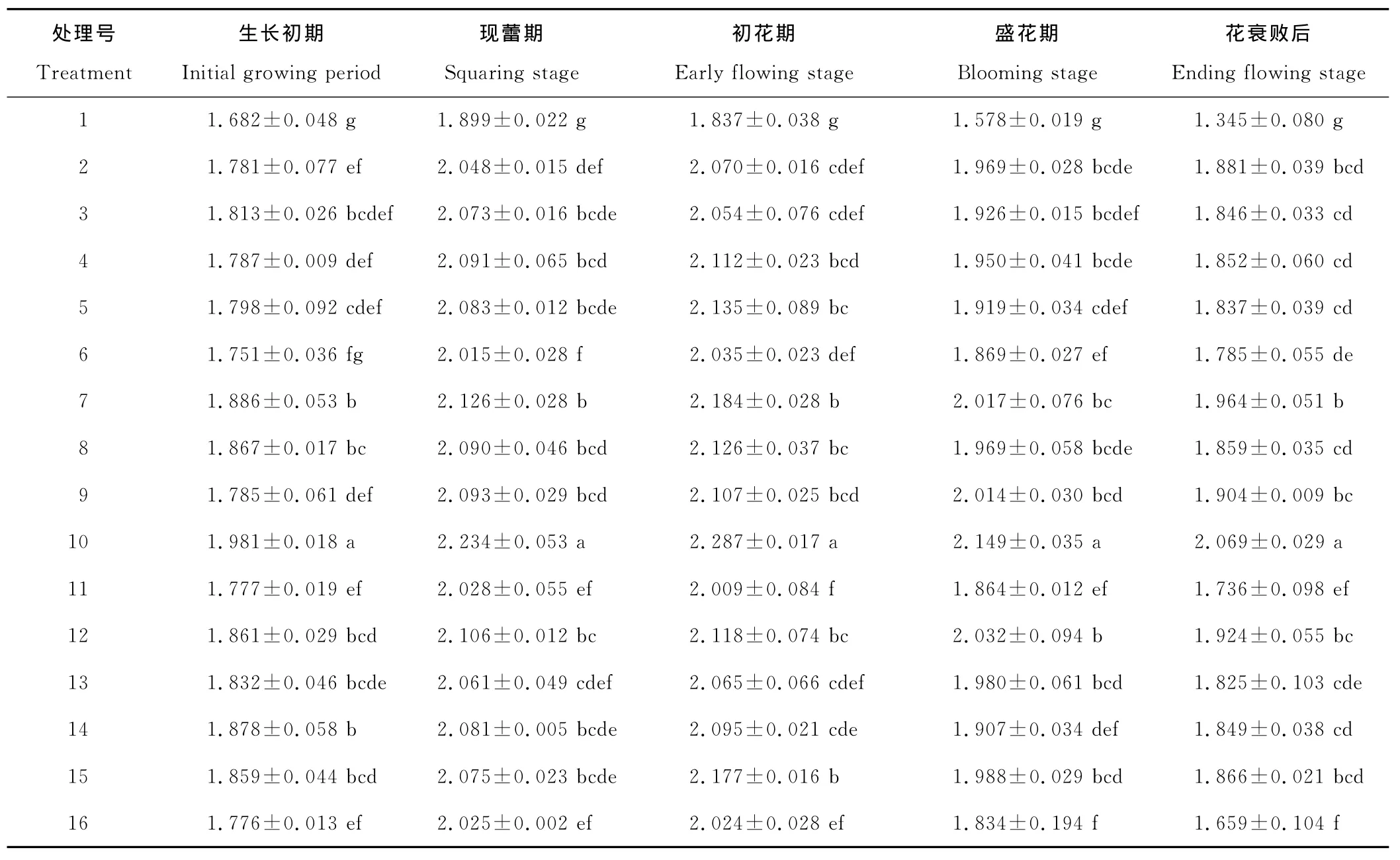
表4 叶绿素a+b含量的变化Table 4 Changes of chlorophyll a+b content mg/g
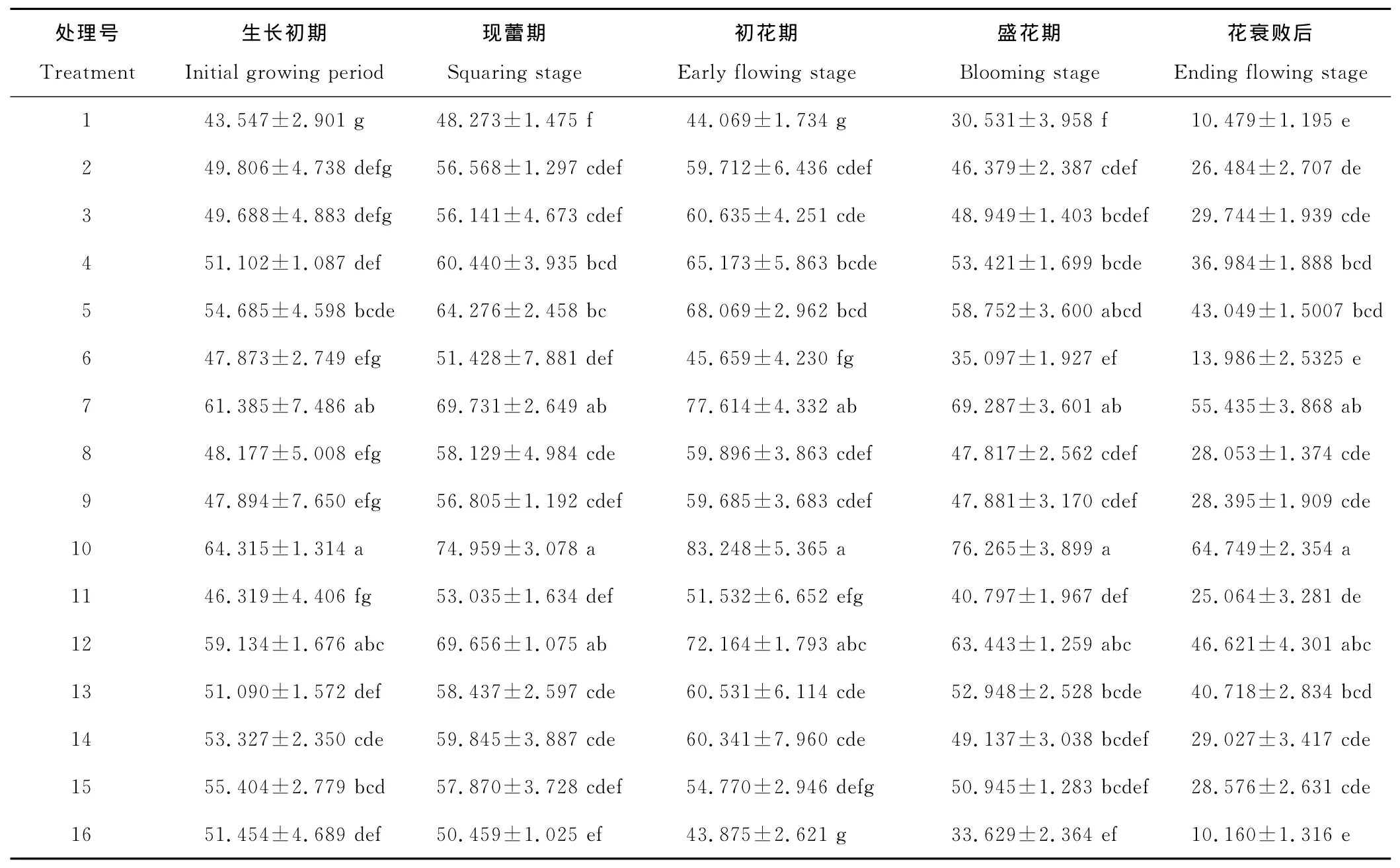
表5 SOD含量的变化Table 5 Changes of SOD contentU/g
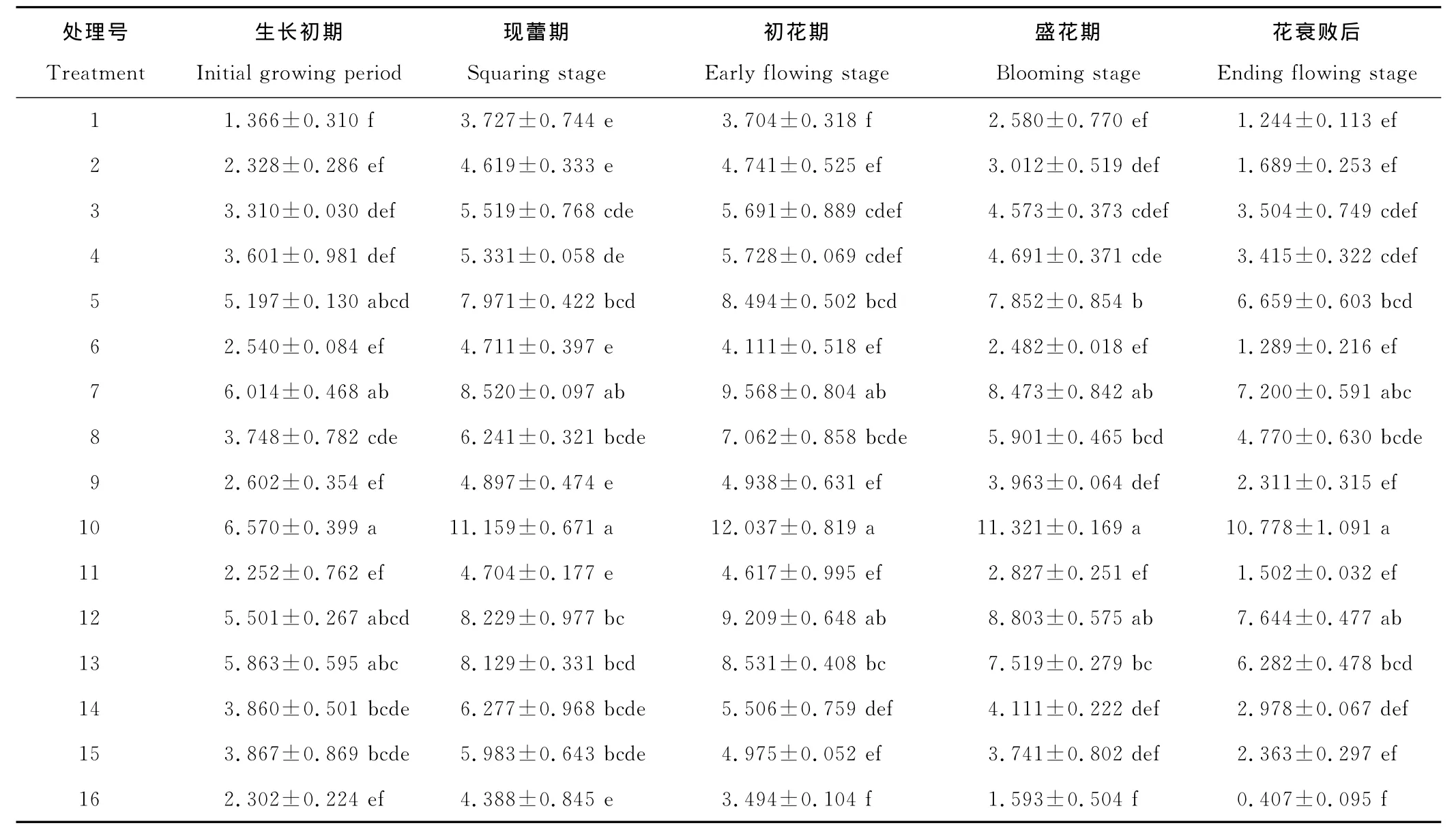
表6 CAT含量的变化Table 6 Changes of CAT content U/(g·min)
2.6 植物生长调节剂对香水百合叶片MDA含量的影响
丙二醛(MDA)是植物膜脂过氧化作用的主要最终产物,其含量多少可以间接反映出植物膜系统过氧化程度的大小。MDA含量呈不断上升的趋势,植物生长调节剂处理后,明显减缓了MDA上升的趋势(表7)。对照处理一直维持在较高水平,显著高于各个处理,各个时期比最低的依次高57.10%,302.96%,161.60%,180.10%,86.81%。生长初期,7号处理的MDA含量最低,8号处理和10号处理其次。现蕾期,8号处理的MDA含量最低,7号处理和10号处理其次。初花期7号处理MDA含量最低,12号处理和10号处理其次。盛花期10号处理MDA含量最低,7号处理和12号处理其次。花衰败后,12号处理MDA含量最低,其次为10号处理和7号处理。
3 讨论
叶绿素是植物进行光合作用的物质基础,在光合作用中起着吸能和转能的作用。叶绿素的破坏与降解会直接导致光合作用效率的降低,其含量的高低在很大程度上反映了叶片光合作用的强弱,并在一定程度上可以作为香水百合叶片衰老的指标。植物生长调节剂对调控植物的光合作用具有重要作用[13]。前人研究表明,多效唑能显著提高水仙(Narcissustazcttavar.Chinensis Roem)的叶绿素含量,增强其光合能力,提高光和效率[14]。外施赤霉素还能提高大豆(Glycinemax)叶片的光合作用,促进了大豆叶片的光合作用[15]。6-BA和GA3配合后可明显提高前期叶绿素的含量[16]。本试验研究表明,植物生长调节剂处理后显著提高了香水百合叶片叶绿素的含量,并且减缓了叶绿素的降解,有效地提高了香水百合光合作用的能力,延缓了植株衰老。叶绿素含量的提高,能使叶片积累更多的光合产物,为香水百合的花蕾提供更多的营养物质,同时也为提前开花提供了物质条件[17]。
过氧化物酶(SOD)是生物体内普遍存在的一种活性氧清除剂,它能清除对生物体有毒害作用的氧自由基,防止膜脂过氧化,保护细胞膜的稳定性,减少对细胞膜的伤害[18,19]。本研究表明,植物生长调节剂处理后能显著提高植物体内SOD活性,清除体内由于衰老而产生的氧自由基,维持植物体内活性氧的平衡[20],使自由基维持在一个较低的水平,对细胞的保护作用增强。在生长发育初期,SOD活性呈上升趋势,此时花蕾处于旺盛发育阶段,植物生长调节剂处理后,有利于SOD活性的升高,而植株本身SOD活性也较高,所以清除O2-的能力增强;随着花朵的开放,SOD活性开始缓慢下降,此时清除自由基的能力降低,自由基不断积累,膜脂过氧化作用加剧,细胞膜开始受到损害,膜透性增大。但是植物生长调节剂处理减缓了SOD活性下降的趋势,保护了细胞膜的稳定性,延缓了植株的衰老。这与郑殿峰等[21]的研究结果一致。
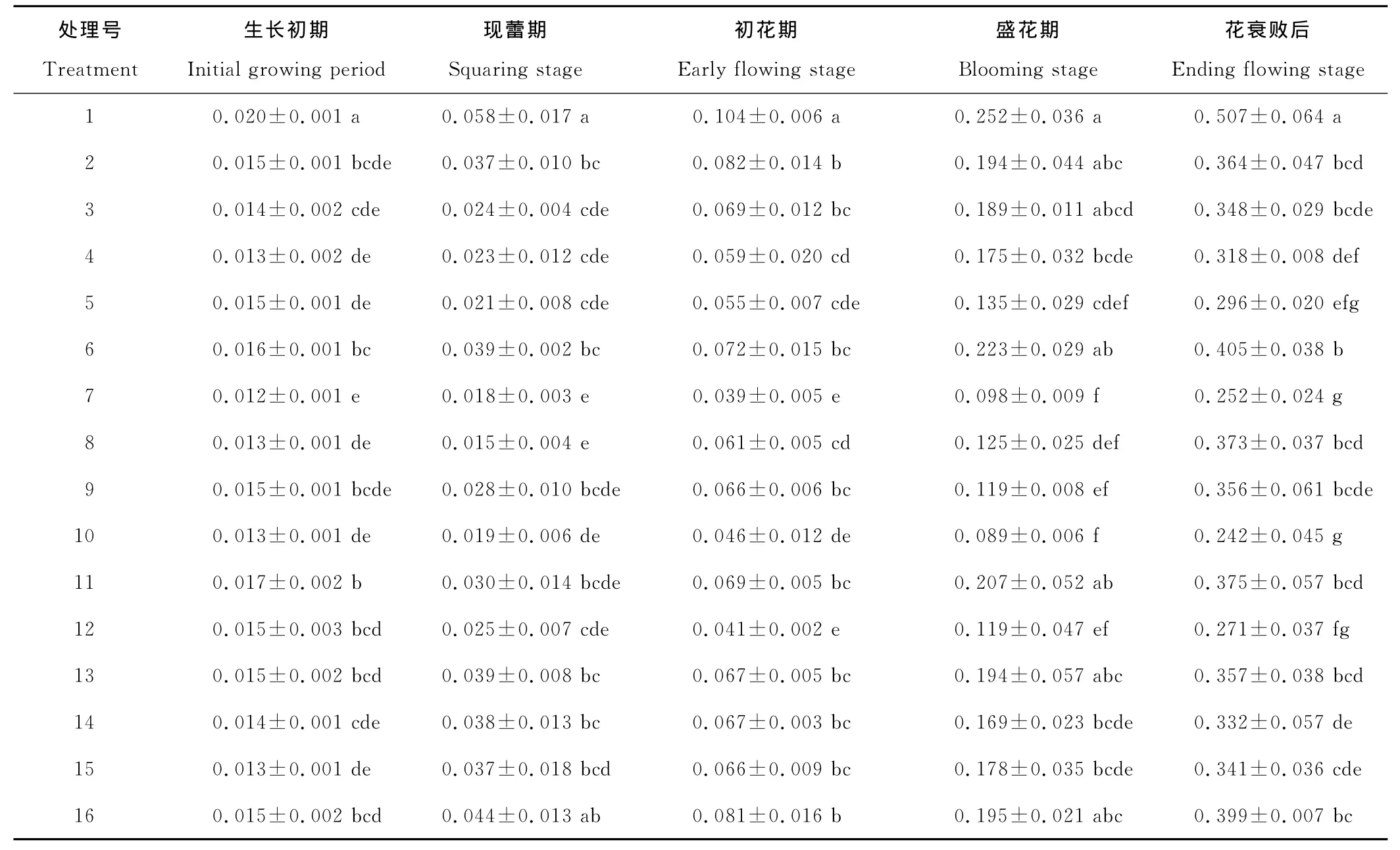
表7 MDA含量的变化Table 7 Changes of MDA content μmol/g
过氧化氢酶(CAT)普遍存在于植物的所有组织中,是促降解系统中重要的组成部分,它可以分解植物体内高浓度的过氧化氢,与SOD、POD等协同作用,有效地清除体内的活性氧[22]。CAT具有保护生物机体的作用,其活性与植物的代谢强度及抗旱、抗病能力有一定的关系[23]。研究结果表明,植物生长调节剂能显著的提高叶片内CAT的活性,有利于香水百合体内活性氧的清除和抗衰老能力的提高,保证了叶片后期生理代谢的正常进行。
MDA是膜脂过氧化作用的主要产物之一,具有很强的细胞毒性,参与破坏生物膜的结构与功能,其含量可表示膜质过氧化的程度,是衡量植物衰老程度的主要生理指标[24]。本研究表明,MDA含量在整个生长发育阶段呈上升趋势,经植物生长调节剂处理能有效的减缓MDA含量的升高,整体上降低了MDA含量升高的趋势,细胞膜脂过氧化作用减弱和质膜破坏程度降低,延缓了植株的衰老[25]。
4 结论
植物生长调节剂混合处理香水百合种球后,能有效地提高叶片的光合作用能力,并使植株叶片维持较高的超氧化物歧化酶、过氧化氢酶活性,减少丙二醛积累,从而显著降低膜脂过氧化过程,减轻了自由基活性氧的伤害,由此在一定程度上延缓了叶片的衰老和光合功能的衰退,有助于增强抗逆性,从而有利于香水百合生长及花朵品质的提高。所有处理中以150mg/L GA3+40mg/L IBA+60mg/L 6-BA的合理搭配和40min浸球处理为最佳。另外,100mg/L GA3+60mg/L IBA+60mg/L 6-BA的合理搭配和10min浸球处理以及150mg/L GA3+80mg/L IBA+20mg/L 6-BA的合理搭配和10min浸球处理的作用效果也比较明显。
[1]中国科学院《中国植物志》编委会.《中国植物志》(第十四卷百合科)[M].北京:科学出版社,1980:116-166.
[2]顾大路,朱云林,杨文飞,等.浅谈植物生长调节剂市场现状与对策[J].江西农业学报,2010,22(2):169-171.
[3]宋丽莉,彭永宏.GA3预处理对冷藏百合切花叶片衰老的影响[J].中国农业科学通报,2004,20(3):182-192.
[4]蔡军火,魏绪英,连芳青,等.外源激素浸球对百合发芽及生长发育的动态效应研究[J].北方园艺,2008,(12):106-109.
[5]朱东兴,沈宗根,赵璐.不同保鲜配方对瓶插百合切花保鲜效应的影响[J].北方园艺,2008,(4):248-252.
[6]蔡宣梅,林真,郑大江,等.东方百合“Sorbonne”花期化学调控技术研究[J].中国农学通报,2006,22(6):280-282.
[7]Blankenship S M,Bailey D A,Miller J E.Effects of continous low levels of ethylene on growth and flowering of Easter lily[J].Scientia Horticulturae,1993,53(4):311-317.
[8]彭桂群,王力华.平阴玫瑰花芽分化期叶片内源激素的变化[J].植物研究,2006,26(2):206-210.
[9]白宝璋,汤学军.植物生理学(Ⅱ)-测试技术[M].北京:中国科学技术出版社,1993.
[10]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[11]郑炳松.现代植物生理生化研究技术[M].北京:气象出版社,2006.
[12]张志良.植物生理学实验指导(第三版)[M].北京:高等教育出版社,2003.
[13]周玲,魏小春,郑群,等.脱落酸与赤霉素对瓜尔豆叶片光合作用及内源激素的影响[J].作物杂志,2010,1:15-20.
[14]关爱农,刘晔,王志忠,等.不同浓度多效唑处理对水仙生长开花的影响[J].中国农学通报,2009,25(13):146-149.
[15]Yuan L,Xu D Q.Stimulatory effect of exogenous GA3on photosynthesis and the level of endogenous GA3in soybean leaf[J].Journal of Plant Physiology and Molecular Biology,2002,28(4):317-320.
[16]刘丽,曾长立,康六生,等.6-BA和GA3配伍对百合切花保鲜效果的影响[J].江汉大学学报(自然科学版),2009,37(2):102-105.
[17]丁义峰,刘萍,常云霞,等.精胺对菊花蕾期叶片生理及花期形态的影响[J].湖北农业科学,2006,45(6):789-791.
[18]邹丽娜,周志宇,颜淑云,等.盐分胁迫对紫穗槐幼苗生理生化特性的影响[J].草业学报,2011,20(3):84-90.
[19]李霞,张玉刚,郑国生,等.芍药切花瓶插期衰老进程及膜脂过氧化研究[J].园艺学报,2007,34(6):1491-1496.
[20]Noctor G,Arisi M A C,Jouanin L,etal.Glutathione biosynthesis,metabolism and relationship to stress tolerance explored in transformed plants[J].Journal of Experimental Botany,1998,49:623-647.
[21]郑殿峰,赵黎明,冯乃杰.植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响[J].作物学报,2008,34(7):1233-1239.
[22]魏瑞成,裴燕,政晓丽,等.金霉素和代谢物胁迫对小白菜幼苗生长和抗氧化酶活性及累积效应的影响[J].草业学报,2011,20(5):102-110.
[23]杨莉,崔秀明.三七开花期间几种生理指标变化[J].云南农业大学学报,2009,24(5):684-689.
[24]王金龙,赵念席,徐华,等.不同地理种群大针茅生理生化特征的研究[J].草业学报,2011,20(5):42-48.
[25]Riesa S K,Giannopelitis C N.Superoxide dismutase occurrenee in higher plants[J].Plant Physiology,1997,59:309-314.
