辣椒抗逆性基因工程研究进展
2012-06-06刘克禄田斌
刘克禄,田斌
辣椒(Capsicum annum L.)属于茄科辣椒属一年生或多年生草本植物,原产于拉丁美洲,由哥伦布发现后传遍世界各地。辣椒因其特殊的口感和丰富的营养而深受人们的喜爱。目前随着辣椒栽培品种的不断退化及各种病虫耐药性的增强,需要不断改进耕作条件及推出新品种才能适应生产需要。辣椒易受病毒、细菌和真菌的侵染,从而发生病毒病、疫病、白粉病、细菌性斑点病、根腐病、青枯病等。除此之外,辣椒还易受根结线虫、蚜虫、烟青虫及各种非生物胁迫的为害。随着生物技术的不断发展,大批抗逆基因被相继分离和克隆后转化得到抗逆转基因植株,并取得了一定成果。
1 植物抗逆分子机理
植物在整个生长周期内经常会遇到生物或非生物胁迫(如干旱、盐碱、高温、低温、重金属、氧化等)的影响,导致其生长发育缓慢或死亡。然而,植物经过长期的逆境胁迫体内,也会形成一系列抵御外界不良环境的的机制,从而保护其免受伤害。
Flor最早提出了基因对基因假说,病原与寄主植物的关系分为亲和与不亲和,亲和与不亲和病原分别含毒性基因(Vir)和无毒基因(avr),亲和与不亲和寄主分别含感病基因(r)和抗病基因(R)。当携带无毒基因的病原与携带抗病基因的寄主互作时,二者表现不亲和,即寄主表现抗病;其他情况下,二者表现亲和,即寄主感病。病毒病的转基因抗病机制主要表现为转录后的基因沉默,若入侵病毒的RNA基因组中包含与植物转基因同源的基因片段,寄主植物就产生与病毒RNA基因互补的反义RNA,从而将病毒RNA破坏,产生抗病性。
植物在干旱胁迫条件下,晚期胚胎发生的丰富蛋白(LEA)具有脱水保护、参与渗透调节、清除自由基的作用;水孔蛋白大量累积;Rubisco活化酶表达量增加,这些都与植物的抗旱性紧密联系。高温可诱导植物产生大量的热激蛋白,从而提高植物的耐热性。植物耐盐性中研究较多的是脯氨酸合成相关基因、甜菜碱合成相关基因和细胞内离子平衡调节信号转导基因,耐盐性越强的植物其体内脯氨酸、甜菜碱的含量也越高。
2 辣椒抗逆相关基因
2.1 与抗病毒相关的基因
植物病毒病已经成为植物界的“顽疾”,给农业生产带来了极大损害。辣椒病毒病发生速度快、防治效果差,严重制约着辣椒的生产。据统计,世界各地报道的辣椒病毒有30余种,而我国辣椒病毒病主要由黄瓜花叶病毒和烟草花叶病毒侵染所致[1]。
研究表明,植物病毒外壳蛋白基因的表达与其细胞内抗病基因的表达水平一致,植物抗病能力越强,其抗病基因外壳蛋白(Coat protein,CP)基因的表达水平也越高。因此,许多研究都围绕病毒CP基因展开。郭亚华等[2]利用Ri质粒构建了植物双元表达载体,将黄瓜花叶病毒(Cucumber mosaic virus,CMV)和烟草花叶病毒(Tobacco mosaic virus,TMV)的CP基因转化至甜椒植株并获得了转基因植株。李华平等[3]通过在辣椒中超表达CMV的CP基因来获得转基因植株,从而研究其与辣椒抗病性的关系。结果表明,部分转基因株系对CMV-BS和CMV-P表现抗性。商鸿生等[4]构建了一个包含CMV-CP和TMV-CP的双功能基因的pBTC超表达载体转化辣椒,研究这2个基因在植物抗病性中所起的作用,结果表明,在T0代植株中,约有半数植株的基因组中同时整合了这2个CP基因,而T1代纯系中这2个基因同时存在的比例则不足10%;同时还发现,自交或杂交各代对CMV的抗性都能稳定遗传和表达。Shin等[5]将辣椒的CMV和ToMV的CP基因在辣椒中超表达也提高了辣椒对CMVKor和辣椒温和斑点病毒(Pepper mild mottle virus,PMMV)的抗性。以上结果证明,植物病毒CP基因与抗病性有关。
商鸿生等[4]对辣椒转CMV的CP基因F1和F2植株的分离情况进行了统计,发现抗卡那霉素和抗CMV都是单基因显性遗传。据报道,CMV是由部分显性和隐性基因所控制[6]。但Kang等[7]指出,Cmr1基因可以控制CMV的发生,是显性遗传并可以控制CMV的不同生理小种。目前,CMVP0已被育种家严格控制,但CMVP1已呈逐年加重趋势,从CMVP0中克隆得到的病毒外壳蛋白基因不仅可以覆盖整个病毒基因的DNA序列,还可以抗黄瓜花叶病毒的不同生理小种[8]。黄粤等[9]从辣椒PMMVQD株系中分离克隆得到病毒CP基因,对基因序列分析表明,PMMV病毒在进化过程中相当稳定。
除了病毒CP基因在植物的抗病性中起着不可忽视的作用外,在辣椒中超表达的Tsi1基因也可以保护辣椒免受PMMV和CMV的侵染[10]。Kim等[11]利用黄瓜花叶病毒的卫星RNA转化辣椒,卫星RNA基因可稳定遗传,只是转基因后代对CMVKor和CMV-Y的抗性有所不同。Ruffel等[12]指出,辣椒中pvr2基因存在2个等位基因pvr21和pyr22,它们控制PVY的产生,从辣椒抗病毒敏感型植株中分离的eIF4E基因是pvr2的互补基因,转eIF4E基因的辣椒抗病性丧失。
2.2 与抗细菌相关的基因
早期,人们就从天蚕血淋巴中诱导出了各种抗菌蛋白。目前,抗细菌基因主要有抗菌肽类、溶菌酶类和抗菌蛋白类,其中昆虫抗菌肽类基因的研究最多。李乃坚等[13]将昆虫抗菌肽B、D基因导入辣椒栽培品种后发现,转基因植株都具有较强抗青枯病的能力。Jan等[14]将天蚕细胞中分离得到的抗菌肽B基因在番茄中超表达,不仅提高了植株抗青枯病的能力,还提高了植株抗细菌性斑点病的能力。双价抗菌肽基因(Shiva A and Cecropin B)在脐橙中超表达可提高植株对溃疡病的抵抗力[15]。李颖等[16]利用农杆菌介导技术获得了转抗菌肽基因辣椒植株,通过对自交系抗青枯病鉴定的筛选,获得了具有抗青枯病能力的转基因稳定株系,转基因后代中,果实性状基本不变,外源基因的遗传也相对稳定。廖富蘋等[17]将抗菌肽D基因导入辣椒,发现目的基因在转基因后代(F4)中能稳定表达。刘建军等[18]检测了转抗菌肽B、D基因辣椒的外源目的蛋白,表明转基因辣椒中抗菌肽目的基因的表达也是忠实的。抗菌肽基因不仅能提高植物的抗病性,在转基因后代中也能稳定表达,因此对转基因植物安全性评价具有重要意义。
2.3 与抗真菌相关的基因
植物抗真菌基因主要是水解酶类、渗透蛋白类、抗菌蛋白和抗菌肽类、植物保卫素、降解酶及毒素、激活防御基因等。研究最多的是水解酶类,其中几丁质酶基因和β-1,3葡聚糖酶基因应用最为广泛,并已成功转化植物体和获得抗病植株。在辣椒方面,敬国兴等[19]将葡聚糖酶基因和几丁质酶基因转化辣椒,分子检测证实外源基因整合到了辣椒基因组DNA中;抗病性检测证明转基因辣椒子叶对疫病有很强的抗性。
2.4 与抗虫相关的基因
辣椒虫害主要有烟青虫、根结线虫和蚜虫,烟青虫幼虫蛀食花、果,造成辣椒落花落果,根结线虫主要为害辣椒根系,蚜虫主要传播病毒病。许多抗虫基因的研究由此展开,CpTI 基 因[20]、cryIAc基因[21]都是抗虫基因,已被用于辣椒转化。李淑敏等[22]分离得到了与抗辣椒根结线虫相关的WRKY基因,包括WRKY2a、WRKY2b、WRKY2c、CaWRKY1、WRKY1和CaWRKY2,其中WRKY2a、CaWRKY2基因受根结线虫诱导表达;而CaWRKY1基因只在根和叶中表达,在茎中不表达。将来自辣椒的抗根结线虫基因CaMi在番茄中超表达,基因表达谱分析显示,该基因在番茄根、叶片和花中表达量高,在茎中表达量偏低,而在果实中不表达,进一步的结果表明,超表达的植株对根结线虫的抗性显著提高[23]。辣椒CaSn基因属于snakin基因家族成员,实时定量表达分析结果表明,该基因由根结线虫侵染诱导表达,此外,病毒诱导的基因沉默实验表明,该基因参与了植物抗根结线虫防御反应,CaSn基因也是辣椒中第一个分离出来的抗根结线虫基因[24]。
2.5 其他胁迫相关基因
病菌感染、干旱、水涝、除草剂等都能使辣椒受到氧化胁迫而使为害加剧,从而造成植株早衰和减产。Zambounis等[25]从番茄中克隆了sod基因,将其转化入辣椒中发现,在一定浓度的氧化胁迫条件下,转基因株系抗氧化能力有所增强。Chatzidimitriadou等[26]同样将来自番茄的sod基因转入辣椒中,发现在甲基紫精处理和干旱胁迫诱导下,转基因植株sod基因均上调表达,并且抗胁迫和茎尖再生能力大大加强。
辣椒CaPF1基因在生物胁迫和非生物胁迫中起重要作用,可以提高转化拟南芥[27]、松树[28,29]、马铃薯[30]等可以提高它们的抗旱性、耐冷性以及耐盐性。甜椒热激蛋白基因CaHSP18受热激和低温诱导表达[31],并能提高转基因植物的耐冷性[32]。
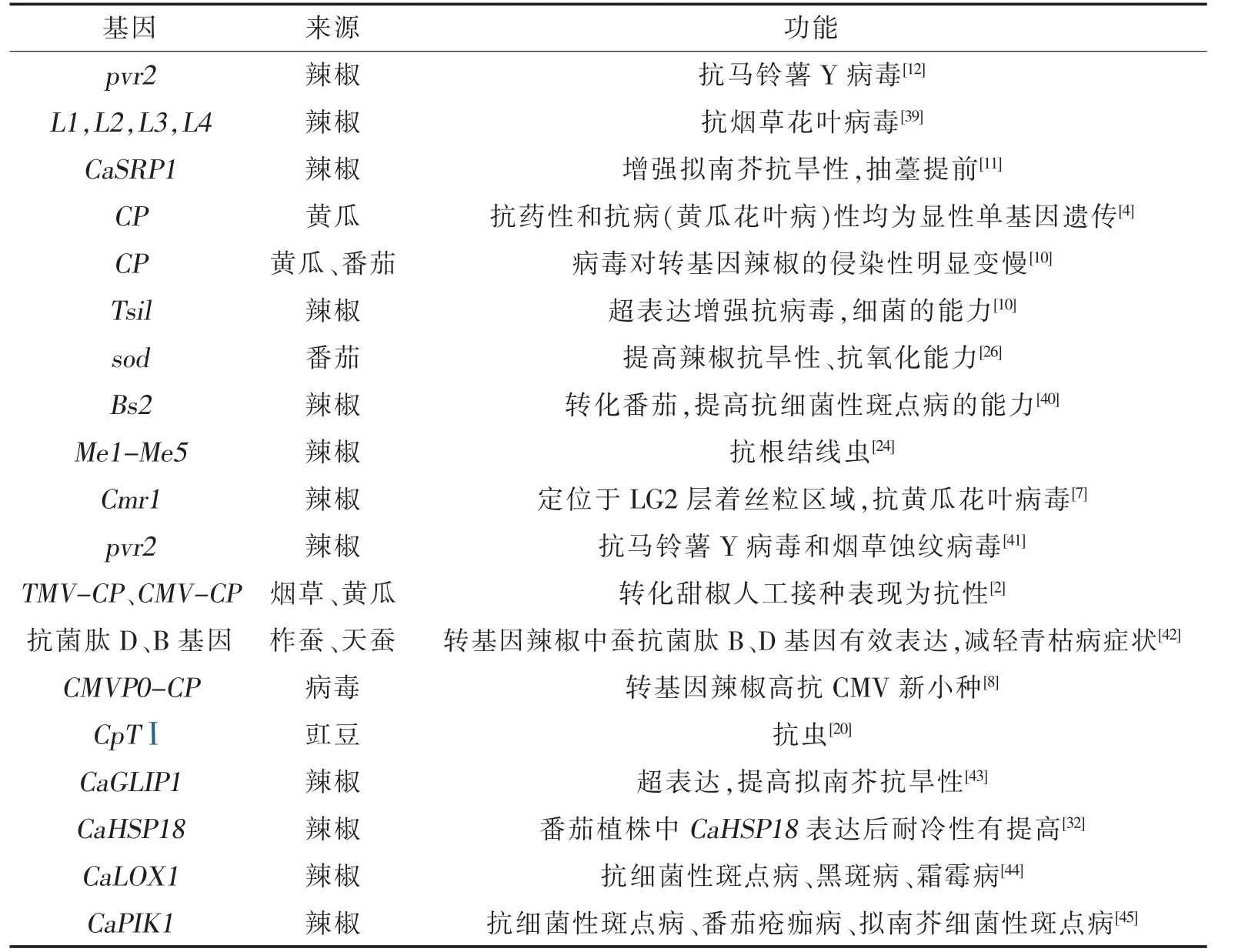
表1 辣椒抗逆性相关基因
目前已经克隆的辣椒基因中,部分基因受干旱胁迫诱导表达,比如 Ca-LEAL1[33]、Ca-DREBLP1[34]、CaPUB1[35]、CaXTH3[36]、CaRma1H1[37]、CaSRP1[38]等 ,都受干旱胁迫诱导上调或下调表达,并可能参与干旱胁迫反应。
Lee等[39]从辣椒中克隆了氧化还原酶CaOXR1基因和与ABI3-VP1基因家族相关的转录因子CaRAV1基因,分别将这2个基因、双功能基因转化拟南芥,结果表明,超表达植株对卵菌纲病害有一定抗性,且耐受高盐和渗透胁迫的能力显著提高。
3 展望
综上所述,已经转化了许多植物中分离并克隆的大量抗逆性相关基因,得到了部分辣椒或其他植物体,获得抗逆性(表1)。
目前,对植物逆境胁迫的生理生化反应及抗逆性反应研究比较透彻,而具体的抗逆性分子机制研究还处于起步阶段。同时,逆境胁迫相关基因数据库还不完善,这些抗逆性基因的功能还需进一步分析。大多辣椒遗传转化的研究还处在实验室阶段,转基因后代的遗传稳定性及其他方面的性状还有待进一步研究。
因此,进一步揭示植物抗逆性分子机制,培育抗真菌、细菌、病毒等病害,抗虫及其他抗逆性转基因辣椒新品种是未来辣椒抗逆性基因工程的重要方向之一。
[1]吴丽君,吴智明.辣椒抗病毒病育种研究进展[J].中国种业,2008(11):17-18.
[2]郭亚华,徐香玲,邓立平,等.Ri质粒介导TMV和CMV外壳蛋白基因转化甜椒研究 [J].北方园艺,2000,133(4):17-18.
[3]李华平,胡晋生,王敏,等.黄瓜花叶病毒衣壳蛋白基因转化辣椒研究[J].病毒学报,2000,16(3):276-278.
[4]商鸿生,王旭,徐秉良.CP基因转化的线辣椒抗卡那霉素和抗CMV特性的遗传[J].西北农林科技大学学报:自然科学版,2001,29(5):103-106.
[5]Shin R,Han JH,Lee G J,et al.The potential use of a viral coat protein gene as a transgene screening marker and multiple virus resistance of pepper plants coexpressing coat proteins of cucumber mosaic virus and tomato mosaic virus[J].Transgenic Research,2002,11:215-219.
[6]Caranta C,Pflieger S,Lefebvre V,et al.QTLs involved in the restriction of cucumber mosaic virus(CMV)long-distance movement in pepper[J].Theoretical and Applied Genetics,2002,104:586-591.
[7]Kang WH,Hoang N H,Yang H B,et al.Molecular mapping and characterization of a single dominant gene controlling CMV resistance in peppers (Capsicum annuum L.)[J].Theoretical and Applied Genetics,2010,120:1 587-1 596.
[8]Lee Y H,Jung M,Shin SH,et al.Transgenic peppers that are highly tolerant to a new CMV pathotype[J].Plant Cell Reports,2009,28:223-232.
[9]黄粤,马荣群,翟晓灵,等.辣椒温和斑点病毒(PMMV)外壳蛋白基因的克隆和序列测定 [J].植物生理学通讯,2005,41(2):205-207.
[10]Shin R,Park J M,An J M,et al.Ectopic expression of Tsi1 in transgenic hot pepper plants enhances host resistance to viral,bacterial,and oomycete pathogens[J].Molecular Plant Microbe Interact,2002,15:983-989.
[11]Kim E Y,Seo Y S,Lee H,et al.Constitutive expression of CaSRP1,a hot pepper small rubber particle protein homolog,resulted in fast growth and improved drought tolerance in transgenic Arabidopsis plants[J].Planta,2010,232:71-83.
[12]Ruffel S,Dussault M H,Palloix A,et al.A natural recessive resistance gene against potato virus Y in pepper corresponds to the eukaryotic initiation factor 4E(eIF4E)[J].The Plant Journal,2002,32:1 067-1 075.
[13]李乃坚,余小林,李颖,等.双价抗菌肽基因转化辣椒[J].热带作物学报,2000,21(4):45-51.
[14]Jan P S,Huang H Y,Chen H M.Expression of a synthesized gene encoding cationic peptide cecropin B in transgenic tomato plants protects against bacterial diseases[J].Applied and Environmental Microbiology,2010,76:769-775.
[15]He Y R,Chen SC,Peng A H,et al.Production and evaluation of transgenic sweet orange(Citrus sinensis Osbeck)containing bivalent antibacterial peptide genes (Shiva A and Cecropin B)via a novel Agrobacterium-mediated transformation of mature axillary buds[J].Scientia Horticulturae,2011,128:99-107.
[16]李颖,余小林,李乃坚,等.转抗菌肽基因辣椒株系的青枯病抗性鉴定及系统选育[J].分子植物育种,2005,3(2):217-221.
[17]廖富蘋,钟杨生,邓平建,等.转柞蚕抗菌肽D基因辣椒的目的基因及表达产物检测[J].蚕业科学,2005,31(2):155-160.
[18]刘建军,邓平建,房师松,等.转抗菌肽基因辣椒蛋白质检测技术研究[J].卫生研究,2003,32(2):134-137.
[19]敬国兴,曾富华,李伏钦,等.抗真菌三价载体转化辣椒的研究[J].江苏农业学报,2009,25(1):165-168.
[20]王朋,王关林,方宏筠.抗虫基因(CpTI)辣椒转化的初步研究[J].沈阳农业大学学报,2002,33(1):30-32.
[21]袁静,舒庆尧,刘中来.苏云金杆菌抗虫基因crylAc转化辣椒的研究[J].武汉植物学研究,2004,22(3):201-204.
[22]李淑敏,茆振川,李蕾,等.辣椒抗根结线虫相关WRKY基因的分离[J].园艺学报,2008, 35(10):1 467-1 472.
[23]Chen R G,Li H X,Zhang L Y,et al.CaMi,a root-knot nematode resistance gene from hot pepper(Capsium annuum L.)confers nematode resistance in tomato[J].Plant Cell Reports,2007,26:895-905.
[24]Mao Z C,Zheng JY,Wang Y S,et al.The new CaSn gene belonging to the snakin family induces resistance against root-knot nematode infection in pepper[J].Phytoparasitica,2011,39:151-164.
[25]Zambounis A,Nianiou-Obeidant I,Tsaftaris A.Cloning of superoxide dismutase (Cu/Zn SOD)gene in peppers for stress tolerance.II Balkan Symposium on Vegetables and Potatoes[J].Acta Horticulturae,2002,579:101-106.
[26]Chatzidimitriadou K,Nianiou-Obeidat I,Madesis P,et al.Expression of SOD transgene in pepper confer stress tolerance and improve shoot regeneration[J].Electronic Journal of Biotechnology,2009,12:1-9.
[27]Yi SY,Kim J H,Joung Y H,et al.The pepper transcription factor CaPF1 confers pathogen and freezing tolerance in Arabidopsis[J].Plant Physiology,2004,136:2 862-2 874.
[28]Tang W,Charles T M,Newton R J.Overexpression of the pepper transcription factor CaPF1 in transgenic Virginia pine(Pinus Virginiana Mill.)confers multiple stress tolerance and enhances organ growth[J].Plant Molecular Biology,2005,59:603-617.
[29]Tang W,Newton R J,Li C,et al.Enhanced stress tolerance in transgenic pine expressing the pepper CaPF1 gene is associated with the polyamine biosynthesis[J].Plant Cell Reports,2007,26:115-124.
[30]Youm J W,Jeon J H,Choi D,et al.Ectopic expression of pepper CaPF1 in potato enhances multiple stresses tolerance and delays initiation of in vitro tuberization[J].Planta,2008,228:701-708.
[31]郭尚敬,陈娜,郭鹏,等.甜椒细胞质小分子热激蛋白基因(CaHSP18)的cDNA克隆与表达[J].植物生理与分子生物学学报,2005,31(4):409-416.
[32]郭鹏,隋娜,于超,等.转入甜椒热激蛋白基因CaHSP18提高番茄的耐冷性 [J].植物生理学通讯,2008,44(3):409-412.
[33]Park JA,Cho SK,Kim JE,et al.Isolation of cDNAs differentially expressed in response to drought stress and characterization of the Ca-LEAL1 gene encoding a new family of atypical LEA-like protein homologue in hot pepper(Capsicum annuum L.cv.Pukang)[J].Plant Science,2003,165:471-481.
[34]Hong JP,Kim W T.Isolation and functional characterization of the Ca-DREBLP1 gene encoding a dehydrationresponsive element binding-factor-like protein 1 in hot pepper(Capsicum annuum L.cv.Pukang)[J].Planta,2005,220:875-888.
[35]Cho S K,Chung H S,Ryu M Y,et al.Heterologous expression and molecular and cellular characterization of CaPUB1 encoding a hot pepper U-Box E3 ubiquitin ligase homolog[J].Plant Physiology,2006,142:1 664-1 682.
[36]Cho SK,Kim JE,Park JA,et al.Constitutive expression of abiotic stress-inducible hot pepper CaXTH3,which encodes a xyloglucan endotransglucosylase/hydrolase homolog,improves drought and salt tolerance in transgenic Arabidopsi splants[J].FEBSLetters,2006,580:3 136-3 144.
[37]Lee H K,Cho S K,Son O,et al.Drought stress-induced Rma1H1,a RING membrane-anchor E3 ubiquitin ligase homolog,regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants[J].The Plant Cell,2009,21:622-641.
[38]Lee SC,Choi D S,Hwang I S,et al.The pepper oxidoreductase CaOXR1 interacts with the transcription factor CaRAV1 and is required for salt and osmotic stress tolerance[J].Plant Molecular Biology,2010,73:409-424.
[39]Oliveira L M,Inoue-Nagata A K,Nagata T.Complete genome nucleotide sequence of pepper mild mottle virus isolated in the Federal District,Brazil[J].Tropical Plant Pathology,2010,35:373-376.
[40]Tai T H,Dahlbeck D,Clark E T,et al.Expression of the Bs2 pepper gene confers resistance to bacterial spot disease in tomato[J].Proceedings of the National Academy of Sciences,1999,96:14 153-14 158.
[41]Moury B,Morel C,Johansen E,et al.Mutationsin potato virus Y genome-linked protein determine virulence toward recessive resistances in Capsicum annuum and Lycopersicon hirsutum[J].Molecular Plant Microbe Interact,2004,17:322-329.
[42]刘清神,李乃坚,黄自然,等.T3代抗菌肽转基因辣椒的PCR 检测及青枯病抗性测定[J].广东蚕业,2005,39(2):20-24.
[43]Hong J K,Choi H W,Hwang I S,et al.Function of a novel GDSL-type pepper lipase gene,CaGLIP1,in disease susceptibility and abiotic stress tolerance[J].Planta,2008,227:539-558.
[44]Hwang I S,Hwang B K.The pepper 9-lipoxygenase gene CaLOX1 functionsin defense and cell death responses to microbial pathogens[J].Plant Physiology,2010,152:948-967.
[45]Kim D S,Hwang B K.The pepper receptor-like cytoplasmic protein kinase CaPIK1 is involved in plant signaling of defense and cell-death responses[J].The Plant Journal,2011,66:642-655.
