痘苗病毒转移载体pSC65-HPV18E6、E7的构建及鉴定*
2012-06-06王雪莲张晓娇安春丽
王雪莲,张晓娇,赵 峰,安春丽
2.盘锦市疾病预防控制中心 ,盘锦 124010;
3.中国医科大学实验动物部,沈阳 110001
研究证实,高危型人乳头瘤病毒(human papil -lomavirus,HPV)感染是宫颈癌发生的首要因素[1-2]。几乎所有的宫颈癌组织均含有 HPV DNA,其中,HPV16、HPV18是最常见的型别。HPV18高表达的宫颈癌具有浸润性强、从宫颈非典型增生到浸润癌进展快、淋巴转移率高、复发率高等特点[3],而目前采用的治疗方法,如手术、放疗和化疗等创伤大,可能剥夺年轻患者的生育功能。
高危型HPV编码的E6、E7蛋白是宫颈癌发生的关键因子,在HPV诱导肿瘤形成过程中发挥至关重要的作用[4-6]。二者持续表达在所有宫颈癌细胞中,是宫颈癌的特异性蛋白,而正常组织及细胞中不存在这两种蛋白。研究证实,E6、E7蛋白具有免疫原性,诱导机体产生的特异性细胞免疫在清除病毒感染细胞和病毒诱导形成的肿瘤细胞过程中发挥重要的作用。为了研究HPV18感染者产生的免疫反应及开展HPV18高表达宫颈癌患者的免疫治疗,我们构建了包含HPV18E6、E7基因的痘苗病毒转移载体,为下一步构建重组痘苗病毒及表达相应的蛋白奠定基础。
1 材料与方法
1.1 材料 HPV18型全基因质粒和pSC65质粒由UAMS微生物与免疫学教研室保存。PCR试剂盒、凝胶回收试剂盒、质粒提取试剂盒、KpnI/SalⅠ限制性内切酶、T4DNA连接酶、感受态细菌E.coli DH5α、DNA marker均购自美国Invitrogen公司,HPV18E6、E7引物(储存浓度25pmol/μL)由美国IDT公司合成,序列如下:

1.2 方法
1.2.1 PCR扩增HPV18E6、E7片段 以HPV18全基因质粒为模板,PCR扩增HPV18E6、E7基因。PCR体系总体积100μL。体系如下:pHPV18质粒(10ng/μL)1μL,10mmol/L dNTP 1μL,10×Buffer 10μL,E6F/E7F(25pmol/μL)1μL,E6R/E7R(25pmol/μL)1μL,50mmol/L MgCl2(终浓度1.5mmol/L)3μL,Taq 0.5μL(5u/μL)。PCR程序(E6和E7)为94℃变性3min,94℃30s,57℃30s,72℃30s,共40个循环,72℃延伸10min。琼脂糖凝胶电泳检测PCR产物。
1.2.2 pSC65-HPV18E6、E7质粒的构建 PCR产物经琼脂糖凝胶电泳后,参照凝胶回收试剂盒回收目的片段。将PCR产物与pSC65质粒首先用KpnI酶切,产物纯化后用Sal I酶切,再纯化后连接。
KpnI酶切体系(总体积20μL)及条件如下:pSC65质粒(0.2μg/μL)5μL,React 4 2μL,KpnI 1μL;HPV18E6/E7 10μL,React 4 2μL,Kpn I 1μL。37℃酶切1h。
Sal I酶切体系(总体积20μL)及条件如下:pSC65质粒(0.2μg/μL)10μL,React 10 2μL,Sal I 1μL;HPV18E6/E7 10μL,React 10 2μL,Sal I 1μL。37℃酶切1h。
连接体系(总体积20μL)及条件如下:HPV18 E6/E7酶切纯化产物10μL,pSC65质粒酶切纯化产物1μL,5×Ligation Buffer 4μL,连接酶2μL。14℃20h。
1.2.3 重组质粒的转化、PCR筛选可能的阳性克隆、酶切分析与测序鉴定 连接产物用酚-氯仿-异丙醇纯化,转化感受态细菌E.coli DH5α。接种于含氨苄青霉素的平板培养基上,过夜培养后挑取孤立菌落,PCR筛选可能含pSC65-HPV18E6/E7重组质粒的克隆。PCR反应体系构成及反应程序同上,总体积为20μL。PCR阳性克隆提质粒,KpnI/SalⅠ双酶切鉴定,酶切体系同上。含有340bp、500bp目的片段的克隆送UAMS微生物与免疫学实验室测序,对测序结果进行BLAST同源性分析。
2 结 果
2.1 PCR扩增HPV18E6、E7片段 PCR扩增产物琼脂糖凝胶电泳结果显示在500bp(HPV18 E6)、340bp(HPV18E7)处出现特异条带(图1)。

图1 PCR扩增HPV18E6、E7片段MDNA marker 1HPV18E6片段 2HPV18E7片段Fig.1 PCR amplification of HPV 18E6/E7fragmentM:DNA marker;1:HPV18E6fragment;2:HPV18E7fragment
2.2 PCR筛选可能的阳性克隆 自HPV18E6、E7两块平板中各随机挑选的9个氨苄青霉素抗性克隆,分别有8,6个克隆在500bp、340bp处出现明显特异条带(图2,3),这些阳性克隆可能是含有pSC65-HPV18E6、E7重组质粒。

图2 PCR筛选可能含pSC65-HPV18E6的阳性克隆1-8:可能含pSC65-HPV18E6的克隆;9 可能阴性克隆;10PCR扩增产物;MDNA markerFig.2 Selection of clones which might contain recombinant plasmid pSC65-HPV18E6by PCR1-8:Clones which might contain pSC65-HPV18E6;9:Possible negative clone;10:Amplification product of PCR;M:DNA marker

图3 PCR筛选可能含pSC65-HPV18E7的阳性克隆2,4-8:可能含pSC65-HPV18E7的克隆;1,3,9:阴性克隆;10:PCR扩增产物;MDNA markerFig.3 Selection of clones which might contain recombinant plasmid pSC65-HPV18E7by PCR1-8:Clones which might contain pSC65-HPV18E7;9:Negative clone;10:Amplification product of PCR;M:DNA marker
2.3 pSC65-HPV18E6、E7的酶切鉴定与测序分析 以KpnI/SalⅠ双酶切对可能的阳性克隆进行鉴定,结果见图4,5。图4为pSC65-HPV18E6经双酶切,泳道2,3为可切出约500bp的目的片段和7 000bp的载体片段,与预期一致;图5泳道1-6为pSC65-HPV18E7经双酶切,可切出分别约为340bp的目的片段和7 000bp的载体片段,与预期一致;故可初步鉴定该质粒为阳性克隆质粒。
上述酶切鉴定正确的阳性质粒测序结果显示该质粒中的目的片段与预期完全一致(图6,7),证明该质粒为所需阳性克隆质粒。
3 讨 论
痘苗病毒具有宿主范围广,对分裂和非分裂细胞均有感染性,可容纳大片段外源基因插入,能正确合成、加工和翻译外源蛋白等优点,因而被广泛应用于疫苗研究。痘苗病毒由于其酶切位点多且复杂,外源基因不能直接插入,需要利用带有野生型痘苗病毒DNA序列的质粒作为转移载体,将携带外源基因的重组质粒转染野生型痘苗病毒感染的细胞,二者在细胞内发生同源重组[7-8],进而获得重组的痘苗病毒。
pSC65质粒具有野生型痘苗病毒DNA序列,可用作转移外源基因至痘苗病毒的载体。本研究将HPV18E6、E7基因插入,获得重组转移载体pSC65-HPV18E6、E7,为进一步构建含 HPV18 E6、E7基因的重组痘苗病毒,获得相应的蛋白,研究HPV18感染者的免疫反应奠定基础。

图4 重组质粒pSC65-HPV18E6酶切鉴定2,3阳性克隆 1,4-11阴性克隆 MDNA MarkerFig.4 Identification of recombinant plasmid pSC65-HPV18 E6/E7by restriction enzyme digestion2,3:Positive clones;1,4-11:Negative clones;M:DNA marker
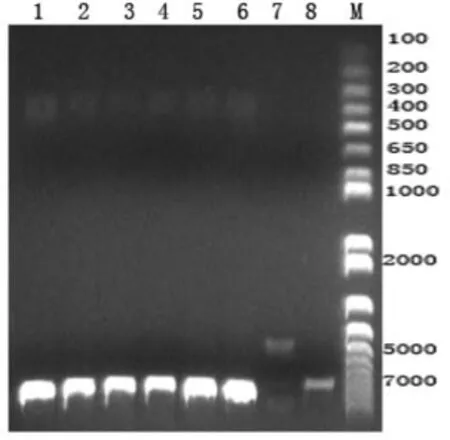
图5 重组质粒pSC65-HPV18E7酶切鉴定1-6阳性克隆 7-8阴性克隆 MDNA MarkerFig.5 Identification of recombinant plasmid pSC65-HPV18 E7by restriction enzyme digestion1-6:Positive clones;7-8:Negative clones; M:DNA marker
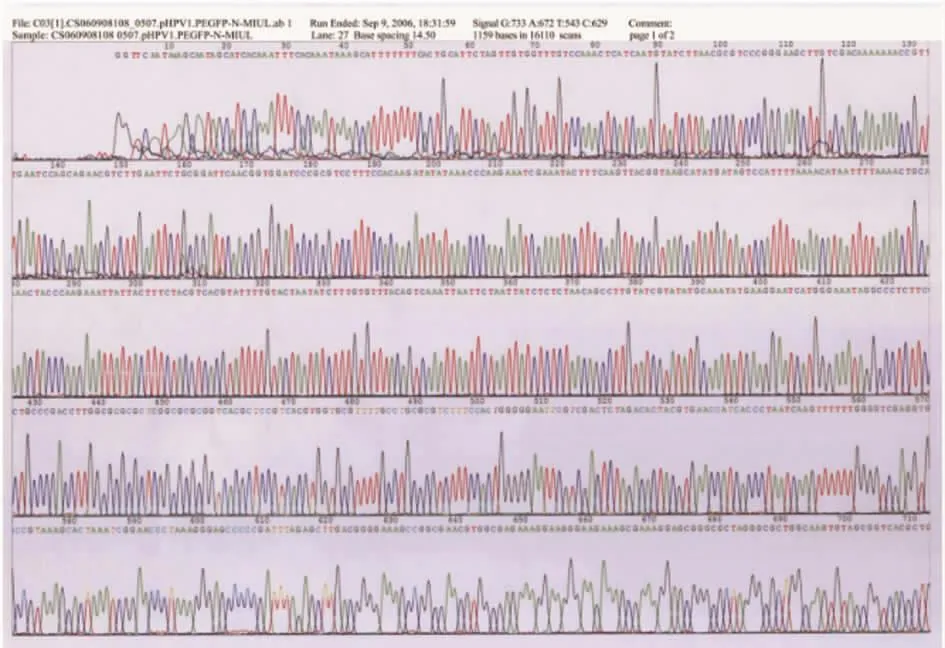
图6 pSC65-HPV18E6测序结果Fig.6 Sequencing of plasmid pSC65-HPV18E6

图7 pSC65-HPV18E7测序结果Fig.7 Sequencing of plasmid pSC65-HPV18E7
[1]Walboomers JM,Jacobs MV,Manos MM,et al.Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J].J Pathol,1999,189(1):12-19.DOI:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F
[2]zur Hausen H.Papillomavirus infections--a major cause of human cancers[J].Biochim Biophys Acta,1996,1288(2):F55-78.DOI:10.1002/9783527609314.ch5
[3]Im SS,Wilczynski SP,Burger RA,et al.Early stage cervical cancers containing human papillomavirus type 18DNA have more nodal metastasis and deeper stromal invasion[J].Clin Cancer Res,2003,9(11):4145 4150.
[4]zur Hausen H.Immortalization of human cells and their malignant conversion by high risk human papillomavirus genotypes[J].Semin Cancer Biol,1999,9(6):405-411.DOI:10.1006/scbi.1999.0144
[5]Sasagawa T,Kondoh G,Inoue M,et al.Cervical/vaginal dysplasias of transgenic mice harbouring human papillomavirus type 16E6-E7genes[J].J Gen Virol,1994,75(Pt11):3057-3065.DOI:10.1099/0022-1317-75-11-3057
[6]Song S,Pitot HC,Lambert PF.The human papillomavirus type 16E6gene alone is sufficient to induce carcinomas in transgenic animals[J].J Virol,1999,73(7):5887-5893.
[7]Plotkin SA,Orenstein WA,editors.Vaccines[M].3rdedition.Philadelphia:W.B.Saunders Company.1999:Chapter 6.
[8]Mackett M,Smith GL,Moss B.General method for production and selection of infectious vaccinia virus recombinants expressing foreign genes[J].J Virol,1984,49(3):857-864.
