TaqMan探针实时荧光定量PCR快速检测土拉弗朗西斯菌*
2012-06-07赵素慧王春晖韩桂圆钮红岺张其威万成松
赵素慧,王春晖,周 莹,韦 耀,韩桂圆,钮红岺,赵 卫,张其威,万成松
土拉弗朗西斯菌(Francisella tularensis)能引起土拉热(野兔热),革兰阴性,无孢子[1]。根据生化性质、毒力和地理分布,分为4个亚种,土拉热亚种(F.tularensissubsp.tularensis)主要集中在北美地区,全北区亚种(F.tularensissubsp.holarctica)主要分布在北美、欧洲和亚洲[1-2],中亚细亚(F.tularensissubsp.mediaasiatica)与新凶手亚种(F.tularensissubsp.novicida)主要分布在北美洲,在澳大利亚也有所发现[3-4],我国以全北区亚种为主[5]。1957年,我国在黄鼠体内分离到土拉弗朗西斯菌。1959年黑龙江省报道了第一起人间 “野兔热”[6]。1986年山东某肉类加工厂暴发了人间“野兔热”[7]。土拉弗朗西斯菌以节肢动物叮咬、空气和接触传播为主[8],通过黏膜或昆虫叮咬侵入临近组织,引起炎症病变反应,在巨噬细胞内寄生,并扩散到全身淋巴和组织器官,引起淋巴结坏死和肝脾脓肿,在临床上表现为发热、黄瘟等,严重者死亡。
本研究选择具有良好抗原性的土拉弗朗西斯菌FopA外膜蛋白[9]人工合成fopA基因保守序列,旨在建立一种灵敏度高、特异性强、快速准确地检测土拉弗朗西斯菌的TaqMan探针荧光定量PCR方法。
1 材料与方法
1.1 材料
1.1.1 菌株与样品 伤寒沙门菌“H”株(H901 50097)和炭疽芽孢杆菌减毒株(63002)由北京军事医学科学院惠赠;金黄色葡萄球菌(ATCC6538)、肠出血型大肠埃希菌O157∶H7(883)和DH5ɑ由本实验室保存,所有细菌操作均在二级生物安全实验室(BSL-2)内进行。土拉弗朗西斯菌阳性模拟模板(fopA基因保守序列)由生工生物工程(上海)有限公司合成。
1.1.2 试剂与耗材 pUC57(Amp+)载体为 Promega公司产品;质粒小提试剂盒为Omega Bio-Tek公司产品;Premix Ex TaqTM(Perfect Real Time)为TaKaRa公司产品,DNA marker、2×Taq Master Mix为OMEGA公司产品;TE溶液、LB肉汤和琼脂平板培养基等自行配制。
1.1.3 仪器 美国GE Ultrospec 1100pro蛋白核酸检测仪、德国Bio-Rad T-gradient梯度PCR仪、英国UVItec凝胶成像分析系统、美国Stratagene实时荧光定量PCR仪Mx3005P、上海一恒THZ-100恒温摇床和生化培养箱等。
1.2 方法
1.2.1 设计fopA基因引物与探针 根据Larsson等土拉弗朗西斯菌外膜蛋白fopA基因序列(Gen-Bank登录号:CP000437.1;CP000915.1;CP000439.1),利用DNAMAN软件进行同源性分析,确定该基因在土拉弗朗西斯菌内的保守片段。采用Primer Premier 5.0软件和Beacon Designer软件设计2条PCR引物(PF、PR)和1条 TaqMan探针,在 Taq-Man探针的5′端标记荧光基团FAM,3′端标记淬灭基团BHQ(如表1所示)。引物和TaqMan探针由生工生物工程(上海)有限公司合成。
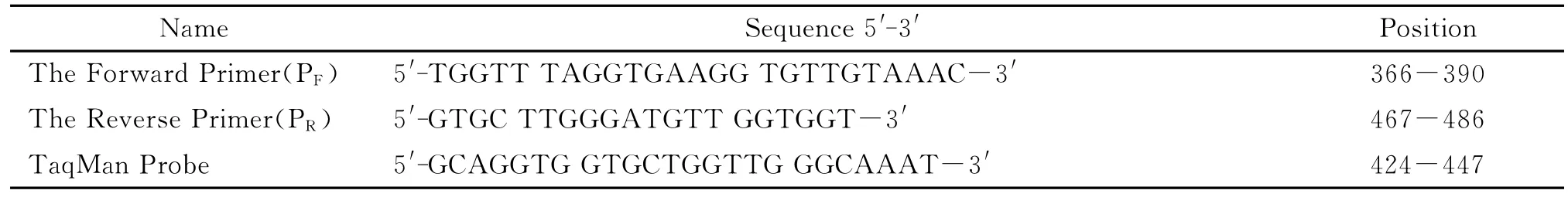
表1 土拉弗朗西斯菌外膜蛋白fopA基因上的引物和TaqMan探针序列Tab.1 Sequences of primers and TaqMan probe for gene fopA
1.2.2 构建fopA标准质粒 土拉弗朗西斯菌为严格管控菌种,菌体样本较难获得。本研究根据GenBank上的fopA基因序列,参考扩增序列位置,人工合成一条121bp基因序列。以合成基因为模板,以PF、PR(见表1)为引物,PCR扩增,产物回收、纯化,连接到pUC57(Amp+)载体,制备重组质粒,后转化到DH5ɑ感受态细胞,增殖培养,经质粒小提试剂盒抽提回收,利用蛋白核酸检测仪测定重组质粒浓度和纯度,PCR扩增,琼脂糖凝胶电泳鉴定。
1.2.3 制作标准曲线 对重组质粒进行10倍梯度浓度稀释,以不同稀释浓度的质粒为模板,以PF、PR为引物进行QF-PCR检测。优化的反应体系为Premix Ex TaqTM10.0μL、上下游引物和荧光探针(10μmol/L)各0.5μL、ROX Reference DyeⅡ0.5μL、DNA 模板2.0μL、去离子水6.0μL,共20.0μL。95℃预变性30s,以95℃10s,60℃60s(收集FAM荧光信号),扩增40个循环,反应时间约79min。检测各梯度标准品的Ct值,以质粒拷贝数为横坐标,Ct值为纵坐标建立质粒标准曲线。
1.2.4 检测QF-PCR灵敏度 将已知拷贝数的重组质粒用TE溶液进行10倍梯度极限稀释,以3.06×103~3.06×1010拷贝数的重组质粒模板分别进行QF-PCR和普通PCR检测,并用2.0%的凝胶电泳检测。比较两种方法对基因片段的最低检出限。
1.2.5 检验QF-PCR特异性 以含重组质粒的DH5ɑ工程菌为阳性样品,以伤寒沙门菌、炭疽芽孢杆菌减毒株、金黄色葡萄球菌、肠出血型大肠埃希菌等细菌作为阴性对照菌株,再用以上细菌与DH5ɑ工程菌的混合培养液作为模拟样品,以去离子水作为无模板空白对照(No template control,NTC)。琼脂平板常规培养细菌,挑单菌落转到LB液体培养基,200r/min震荡培养12~16h,最后将菌液稀释100倍,制作样本。普通PCR(95℃预变性10 min,95℃10s,60℃30s,扩增45个循环,终延伸72℃5min,反应时间约71min)和 QF-PCR(95℃预变性10min,95℃10s,60℃收集FAM荧光信号30s,扩增45个循环,反应时间约75min),比较最小检测限度。
1.2.6 QF-PCR重复性实验 以拷贝数为3.06×106的重组质粒作为检测模板,相同条件分别进行5组重复检测试验(每组3个平行),取Ct值平均数,得出Ct值变异系数,来初步评估该方法的重复性和重现性。
2 结 果
2.1 阳性样品的制备与鉴定 人工合成fopA基因片段后,克隆到pUC57(Amp+)载体,制成重组质粒,经抽提检测,重组质粒浓度为93.45ng/μL,作为阳性样品标准品。根据Avogadro's Number计算,重组质粒的拷贝数为3.06×1010copies/μL。取稀释的重组质粒作为模板,用上下游引物进行PCR扩增,2% 琼脂糖凝胶电泳鉴定,结果如图1所示,在100bp附近可见一条带,大小为121bp,与预期一致。
2.2 QF-PCR标准曲线 利用优化的反应体系,对5个10倍梯度稀释的定量标准品进行QF-PCR检测,结果如图2所示。质粒拷贝数为横坐标,Ct值为纵坐标,制作标准曲线,在3.06×103~3.06×109拷贝数间有良好的线性关系,相关系数为0.994,扩增效率为104.8%,得出标准品拷贝数与Ct值的线性方程为:Ct=-3.213×LOG(copies)+41.32。对样品进行检测,根据其Ct值和线性方程可获得该样品DNA拷贝数。
2.3 QF-PCR灵敏度 将已知拷贝数的重组质粒进行10倍梯度极限稀释,对3.06×106~3.06×101拷贝数标准品质粒分别进行QF-PCR和普通PCR检测,结果如图3所示。QF-PCR检测方法最低能检测到3.06×101个DNA拷贝数,而普通PCR只能检测到3.06×106个DNA拷贝数。
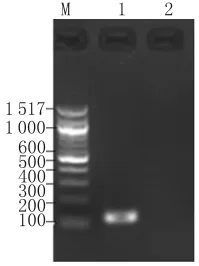
图1 土拉弗朗西斯菌fopA基因扩增片段鉴定M.100bp DNA Ladder marker;1.扩增的目的片段(121bp);2.无模板空白对照Fig.1 Identification of fopAgene amplification clipsM:100bp DNA Ladder marker;1:PCR amplification product(121bp);2:NTC

图2 标准品质粒QF-PCR扩增曲线A:标准品质粒动力学曲线B:标准品质粒标准曲线Fig.2 Amplification curve of standard plasmids by QF-PCRA:QF-PCR dynamic curve of recombinant plasmids;B:Standard curve of plasmids
2.4 QF-PCR特异性 利用本实验建立的土拉弗朗西斯菌QF-PCR检测方法,对4株血液、水源、接触途径传播的细菌与土拉弗朗西斯菌标准品进行检测,结果显示,只有含fopA基因扩增片段的2个样品出现典型的扩增曲线,其余与空白对照均为一平直线,无Ct值,如图4所示,判断为阴性。该结果与普通PCR检测结果完全一致,如图5所示,两者比较结果如表2所示。
2.5 QF-PCR的重复性 为评估该方法的重复性和重现性,本研究对拷贝数为3.06×106的重组质粒在相同实验条件下分别进行5组重复检测试验(每组3个平行),取Ct值平均数,最后得出Ct值变异系数,并统计获得的Ct值。结果显示,标准差为0.201,变异系数为0.88%,表明本实验建立的土拉弗朗西斯菌QF-PCR检测方法重现性较好,可对土拉弗朗西斯菌样品进行稳定、可靠的检测。
图3 土拉弗朗西斯菌QF-PCR和普通PCR检测的极限浓度A:QF-PCR检测结果;B:普通PCR检测结果。M:100bp DNA Ladder marker;1~7:拷贝数为3.06×109~3.06×103的标准品质粒;8:无模板空白对照Fig.3 Detection limit of F.tularensis by QF-PCR and conventional PCRA:QF-PCR result;B:Conventional PCR result;M:100bp DNA Ladder marker;1-7:Plasmids copies of 3.06×109-3.06×103;8:NTC
图4 土拉弗朗西斯菌QF-PCR特异性实验结果1.DH5ɑ工程菌(121bp);2.DH5ɑ混合菌a a.DH5ɑ混合菌是指含土拉弗朗西斯菌模板的DH5ɑ菌与金黄色葡萄球菌、伤寒沙门菌、炭疽芽孢杆菌及大肠埃希菌混合后形成的模拟样品。Fig.4 Specificity of F.tularensis by QF-PCR1:DH5ɑ(121bp);2:DH5ɑmixa;a:Mixed bacteria of DH5ɑrefers to the cultured DH5ɑ,Staphylococcus aureus,Typhoid bacillus,Bacillus anthracis,and E.coli.
图5 土拉弗朗西斯菌普通PCR特异性实验结果M.50bp DNA Ladder marker;1.DH5ɑ 工 程 菌(121bp);2.DH5ɑ混合菌a;3.金黄色葡萄球菌;4.伤寒沙门菌(H901);5.炭疽芽孢杆菌减毒株;6.EHEC O157∶H7 883;7.无模板空白对照a.DH5ɑ混合菌是指含土拉弗朗西斯菌模板的DH5ɑ菌与金黄色葡萄球菌、伤寒沙门菌、炭疽芽孢杆菌及大肠埃希菌混合后形成的模拟样品Fig.5 Specificity of F.tularensis by PCRM:50bp DNA Ladder marker;1:DH5ɑ (121bp);2:DH5ɑmixa;3:Staphylococcus aureus;4:Typhoid bacillus (H901);5:Bacillus anthracis;6:EHEC O157∶H7 883;7:NTCa:The mixed bacteria of DH5ɑrefer to the cultured DH5ɑ,Staphylococcus aureus,Typhoid bacillus,Bacillus anthracis,and E.coli.

表2 土拉弗朗西斯菌QF-PCR特异性实验结果Tab.2 Specificity of F.tularensis by QF-PCR
3 讨 论
土拉弗朗西斯菌具有高传染性,严重威胁公共卫生安全,美国CDC将其归为A类重要细菌,美军把其列入为重要的生物战剂目录[10]。土拉弗朗西斯菌生长缓慢,培养条件苛刻,现今常用细菌培养及ELISA等检方法,但耗时耗材,易造成实验室感染,极不安全。
本研究利用QF-PCR技术,选择土拉弗朗西斯菌外膜蛋白的特异性基因fopA作为靶基因,选取其中一段保守片段设计引物和探针,构建重组质粒,作为标准品和模拟阳性标本,在TaqMan探针的5′端标记荧光基团FAM,3′端标记淬灭基团BHQ,利用荧光信号积累实时监测整个PCR进程,对人工模拟的土拉弗朗西斯菌进行定量检测分析,以实现对未知样品中土拉弗朗西斯菌的定性定量检测。
本实验所建立的QF-PCR技术的灵敏度达到30.6个DNA拷贝数水平,比普通PCR 3.06×106检测灵敏。重复性试验结果显示,同一浓度的15个样品检测Ct值变异系数为0.88%,说明该方法重复性好,能保证对样品进行稳定、可靠的检测。同时QF-PCR过程中无需电泳检测、不使用溴化乙锭,保障了实验人员的安全,结合菌落PCR技术更是简化了细菌基因组提取的繁琐步骤。从样品送检到QFPCR反应完成只需2h,比常规的细菌培养、免疫检测等方法缩短了检测时间,降低损耗,提高检测效率。
本研究在无法获得该细菌样本的条件下,通过人工合成土拉弗朗西斯菌fopA基因的特异保守序列,构建重组质粒,作为检测的模拟阳性样品,设计引物和探针,与普通PCR进行比较,研究QF-PCR方法的灵敏度和特异性,从而为一些高度危险、难以获得样品的生物战剂级微生物的定性定量检测建立了一套快速、灵敏和特异的QF-PCR检测方法。
实验结果证明,fopA基因的QF-PCR检测特异性好,检测速度快,灵敏度高,比ELISA等其他快速检测方法具有明显优势。本研究建立的方法为土拉弗朗西斯菌的快速定量检测和流行病学调查提供了新的实验室检测手段,适用于进出口物品检验检疫、生物安全应急检测(尤其是血液样品)、致病菌的临床诊断以及生物安全防护等领域,应用前景广阔。
[1]Ellis J,Oyston PC,Green M,et al.Tularemia[J].Clin Microbiol Rev,2002,15(4):631-646.DOI:10.1128/CMR.15.4.631-646.2002
[2]Brenner DJ,Krieg NR,Staley JT,et al.Bergey's Manual of Systematic Bacteriology,vol.2 (The Proteobacteria),part B(The Gammaproteobacteria)[M].2ndEdition.New York:Springer,2005,200-210.
[3]Forsman M,Sandström G,Sjöstedt A.Analysis of 16Sribosomal DNA-sequences ofFrancisellastrains and utilization for determination of the phylogeny of the genus and for identification of strains by PCR[J].Int J Syst Bacteriol,1994,44(1):38-46.DOI:10.1099/00207713-44-1-38
[4]Whipp MJ,Davis JM,Lum G,et al.Characterization of a novicida-like subspecies ofFrancisella tularensisisolated in Australia[J].J Med Microbiol,2003,52(Pt 9):839-842.DOI:10.1099/jmm.0.05245-0
[5]Wang YH,Hai R,Zhang ZK,et al.Preliminary study and phylogenetic analysis of the subspecies ofFrancisella tularensisin China[J].Chin J Vector Biol Control,2011,22(1):8-10.(in Chinese)王艳华,海荣,张志凯,等.初步研究我国土拉菌的亚种及遗传进化关系[J].中国媒介生物学及控制杂志,2011,22(1):8-10.
[6]Kang CG.Epidemiological survey report of first appearance of human infected with tularemia in China[J].J Epidemiol,1980,1(4):248-250.(in Chinese)康成贵.我国首次出现人间土拉弗氏菌病的流行病学调查报告[J].流行病学杂志,1980,1(4):248-250.
[7]Jiang JT,Chen FR,Yang YH,et al.Investigation on human infected withF.tularensisin Shandong Province[J].Chin J Zoonoses,1990,6(6):48-49.(in Chinese)姜居堂,陈福荣,杨裕华,等.山东省人间土拉弗氏菌病感染情况调查[J].中国人兽共患病杂志,1990,6(6):48-49.
[8]Kugeler KJ,Gurfield N,Creek JG,et al.Discrimination betweenFrancisella tularensisandFrancisella-like endosymbionts when screening ticks by PCR[J].Appl Environ Microbiol,2005,71(11):7594-7597.DOI:10.1128/AEM.71.11.7594-7597.2005
[9]Fulop M,Manchee R,Titball R.Role of lipopolysaccharide and a major outer membrane protein formFrancisella tularensisin the induction of immunity against tularemia[J].Vaccine,1995,13(13):1220-1225.DOI:10.1016/0264-410X(95)00062-6
[10]Mitchell JL,Chatwell N,Christensen D,et al.Development of real-time PCR assays for the specific detection ofFrancisella tularensisssp.tularensis,holarcticaandmediaasiatica[J].Mol Cell Probes,2010,24(2):72-76.DOI:10.1016/j.mcp.2009.10.004
