扁桃体和外周血CD8+T细胞表达CXCR5和IL-21水平对比分析
2012-06-05方会珍曹莉萍
方会珍,曹莉萍
(1、江西省中医药研究院检验科,江西 南昌 330046;2、南昌大学第二附属医院检验科,江西 南昌 330006)
扁桃体是人体的次级淋巴组织。近年来,在次级淋巴组织的生发中心(Germinal center,GC)发现了一个特殊的CXCR5+CD4+T细胞亚群,被命名为滤泡辅助性T细胞(follicular T helper cells,Tfh),目前认为是B细胞产生抗体和发生类别转换,执行有效的体液免疫应答的主要辅助性T细胞亚群[1-2]。然而,在GC反应中,T细胞与B细胞的相互作用机制及过程迄今为止并未完全清晰,尤其是CD8+T细胞在其中是否发挥作用,目前文献也鲜见报道。本文利用流式细胞检测技术,分析比较了扁桃体和正常人外周血中CD8+T细胞表达CXCR5和IL-21的水平,为进一步探讨外周淋巴组织中CD8+T细胞的异质性提供实验依据。
1 材料与方法
1.1 实验对象 15例扁桃体组织来自因反复炎症发作而行扁桃体切除(不分侧别)的患者,其中男性10例,女性5例,年龄5~28岁,平均17.3岁。每位患者术前两周内均无急性发炎史,且未行任何抗菌素治疗,术前血尿常规检查均正常。12例外周血标本来自健康体检者,男性8例,女性7例,年龄10~42岁,平均22.8岁。
1.2 主要试剂和仪器 RPMI-1640 不完全培养液、牛血清白蛋白(BSA)、佛波酯(PMA)、离子霉素(Ionomycin)购自美国Sigma 公司,胎牛血清购自杭州四季青公司,淋巴细胞分离液购自中国医学科学院血液学研究所,FITC 标记的鼠抗人CD8 单克隆抗体(FITC-CD8 mAb)、APC-CXCR5 mAb、PE-CD69 mAb 及其同型对照购自美国BD Pharmingen 公司,PE-IL-21mAb 及其同型对照购自美国eBioscience公司,流式细胞仪Calibur 购自美国BD 公司。
1.3 人扁桃体单个核细胞的制备 将手术摘除的新鲜扁桃体组织,用生理盐水或Hank′s 液反复洗涤,剪去外周的结缔组织,将扁桃体剪成小块,用组织匀浆器将其碾磨制成细胞悬液,并用筛网过滤悬液,以淋巴细胞分离液分离出扁桃体中的单个核细胞,台盼蓝拒染法测定细胞数量和活力,备用。
1.4 人外周血单个核细胞(PBMCs)的制备 抽取健康体检者外周血,淋巴细胞分离液密度梯度离心法分离人PBMCs,台盼蓝拒染法测定细胞数量和活力,备用。
1.5 流式抗体染色细胞表面分子的染色:将细胞悬液调成1×106/ml的浓度,用PBS 洗涤细胞1~2次,100μl细胞悬液中加入一定量的抗体,4℃避光孵育30min,PBS 再洗涤细胞1~2次,倒去上清,上流式细胞仪进行检测。IL-21的染色:1×106/ml的细胞悬液中加入激活剂PMA和Ionomycin,同时加入阻止细胞因子分泌至胞外的阻断剂布雷菲德菌素A(BFA),37℃孵育4min 后,收集细胞,PBS 洗涤细胞,4%的多聚甲醛固定细胞10min,然后加入含1%皂甙的破膜剂于室温避光处放置10min,PBS洗涤细胞,弃上清,最后加入荧光标记的IL-21 抗体,4℃避光孵育30min 后,洗涤细胞,上机检测分析。
2 结果
2.1 扁桃体和PBMCs 中CD8+T细胞比例的差异流式细胞仪检测结果发现,扁桃体组织中CD8+T细胞占淋巴细胞的比例仅为6.61%±1.91%,明显低于正常人外周血中CD8+T细胞的比例(21.83%±4.56%),两者相比具有统计学意义(P<0.05)。结果见图1。

图1 扁桃体中CD8+T细胞比例低于PBMCs
2.2 扁桃体和PBMCs 中CD8+T细胞表达CD69的差异 检测CD8+T细胞表面活化分子CD69 发现,与PBMCs 相比,扁桃体中CD8+T细胞表达CD69的水平明显升高,CD8+CD69+T细胞占总CD8+T细胞的比例为42.83%±5.59%,而PBMCs 中CD8+T细胞表达CD69的水平极低,CD8+CD69+T细胞比例为2.93%±1.61%(见图2)。两组之间比较有统计学差异(P<0.05)。
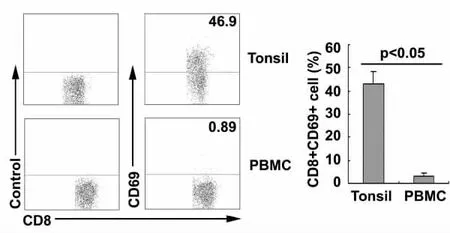
图2 扁桃体中CD8+T细胞高表达CD69
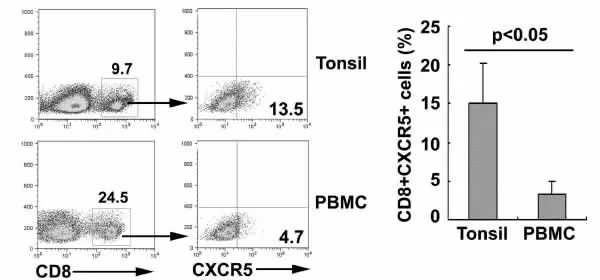
图3 扁桃体和PBMC 中CD8+T细胞表达CXCR5的差异
2.3 扁桃体和PBMCs 中CD8+T细胞表达CXCR5的差异 FCM 检测结果进一步显示,扁桃体中CD8+CXCR5+T细胞占总CD8+T细胞的比例为15.05%±5.13%,正常人外周血中CD8+CXCR5+T细胞占总CD8+T细胞的比例为3.34%±1.63%(见图3),两者相差非常显著(P<0.05)。
2.4 扁桃体和PBMCs 中CD8+T细胞表达IL-21的差异为了解CD8+T细胞是否能够产生IL-21,我们用多克隆刺激剂PMA和Ionomycin 刺激扁桃体单个核细胞和PBMCs,4h 后用FCM 检测CD8+T细胞表面IL-21的表达情况。如图4显示,扁桃体中CD8+T细胞能检测到IL-21的表达(占总CD8+T细胞的4.64%±1.71%),但是PBMCs 中CD8+T细胞基本不表达IL-21 (占总CD8+T细胞的0.34%±0.27%),两者差异具有统计学意义(P<0.05)。

图4 扁桃体中CD8+T细胞能产生IL-21
3 讨论
扁桃体作为人体免疫器官中的一个特化的二级淋巴器官,由于其解剖部位显要,且生理功能尤其是免疫功能还不甚明了,因此多年来一直是人们研究的热点[3-4]。已经证实,扁桃体是一个富含B细胞的淋巴组织,目前普遍认为扁桃体的功能以体液免疫为主,对其细胞免疫了解甚少。但是,最近在次级淋巴组织的淋巴滤泡确定了一个新的CD4+T细胞亚群,称之为Tfh。研究发现,Tfh细胞的一个重要表面标志是表达趋化因子受体CXCR5,该受体通过与其相应的配体CXCL13 作用,使Tfh细胞定位于次级淋巴组织的淋巴滤泡。此外,Tfh细胞的另一个重要特征是具有分泌IL-21的功能,在刺激B细胞的增殖、分化以及免疫球蛋白的类别转换中起着十分重要的作用[5]。那么,在扁桃体等次级免疫器官中,CD8+T细胞是否也表达CXCR5和IL-21 呢?
众所周知,除CD4+T细胞外,CD8+T细胞也是免疫系统中参与适应性免疫应答的一个重要功能性T细胞亚群,与CD4+T细胞不同的是,CD8+T细胞识别的是MHCⅠ类分子结合的病毒或细菌抗原肽,主要在抗胞内微生物感染中发挥细胞毒性作用[6]。在次级淋巴组织,CD8+T细胞定位于T细胞区,被抗原递呈细胞(如DC)提呈的抗原适当刺激后,会迅速增殖并成为效应细胞。当被感染细胞逐渐被清除后,一部分抗原特异的CD8+T细胞被保留下来,成为长寿命记忆细胞,在二次免疫应答中发挥主要作用。CD8+T细胞介导的细胞毒效应主要通过靶向释放溶细胞分子颗粒酶和穿孔素,以及表达死亡受体(Fas)等机制导致靶细胞损伤[7]。
本研究通过比较扁桃体和正常人外周血中的CD8+T细胞,证实扁桃体中CD8+T细胞的比例相对较少,且50%左右的CD8+T细胞组成性表达CD69,表明这些细胞可能处于早期分化和活化状态[8],这也可能与扁桃体中的免疫细胞经常接触外来抗原、不同程度地发生了活化有关。更有趣的是,扁桃体中也存在一部分CD8+CXCR5+T细胞。有观点认为,CD8+T细胞细胞表面不表达CXCR5[5]。尽管我们检测到的这群CD8+CXCR5+细胞与CD8+CXCR5-细胞相比,表型和功能是否存在差异目前还不得而知,但扁桃体中CD8+CXCR5+T细胞的存在提示CXCR5 对于CD8+T细胞迁移到外周淋巴器官的作用同样不可忽视。与扁桃体相比,我们在外周血中也检测了较低比例的CD8+CXCR5+细胞。我们推测这群细胞可能是从外周淋巴器官循环至外周血中,我们的结果与Quigley MF[9]等的结果基本一致。最后,我们也检测了CD8+T细胞产生IL-21的能力,发现只有扁桃体中的CD8+T细胞能产生IL-21,而外周血中CD8+T细胞不产生IL-21。虽然扁桃体中CD8+T细胞产生IL-21的水平远远低于CD4+T细胞,由于在外周淋巴组织,B细胞是IL-21 作用的主要靶细胞[10],因此,CD8+T细胞产生的IL-21 是否能够为B细胞提供辅助,还有待进一步深入研究。
总之,我们采用FCM 检测方法,初步探讨了扁桃体中存在一群CD8+CXCR5+和CD8+IL-21+T细胞,为进一步开展这两群细胞的功能研究提供了良好的实验基础。
[1]McHeyzer-Williams LJ.Follicular helper T cells as cognate regulators of B cell immunity [J].Curr Opin Immunol,2009,21(3):266–273.
[2]Nutt SL,Tarlinton DM.Germinal center B and follicular helper T cells:siblings,cousins or just good friends [J].Nat Immunol,2011,12 (6):472-477.
[3]闵密克,马超武,金伯泉,等.扁桃体B 淋巴细胞免疫功能的研究[J].临床耳鼻咽喉头颈外科杂志,2009,23 (7):311-315.
[4]张 涛,丁 勇,王继群,等.扁桃体组织中白细胞介素-4的表达和意义[J].中国病理生理杂志,2000,16 (2):150- 152.
[5]金伯泉.T-B细胞协作研究的重大突破—滤泡辅助性T细胞的发现,一个新的CD4+效应T细胞亚群[J].细胞与分子免疫学杂志,2009,5(1):1-5.
[6]Yewdell JW,Haeryfar SM.Understanding presentation of viral antigens to CD8+T cells in vivo:The key to rational vaccine design[J].Annu Rev Immunol,2005,23:651–682.
[7]Sallusto F,Geginat J,Lanzavecchia A.Central memory and effectormemory T cell subsets:Function,generation,and maintenance [J].Annu Rev Immunol,2004,22:745–763.
[8]Papagno L,Spina CA,Marchant A,et al.Immune activation and CD8+T-cell differentiation towards senescence in HIV-1 infection[J].PLoS Biol,2004,2:E20.
[9]Quigley MF,Gonzalez VD,Granath A,et al.CXCR5+CCR7-CD8 T cells are early effector memory cells that infiltrate tonsil B cell follicles [J].Eur J Immunol,2007,37 (12):3352-3362.
[10]Zaki K,Spolski R,Ettinger R,et al.Regulation of B cell differentiation and plasma cell generation by IL-21,a novel inducer of Blimp-1 and Bcl-6 [J].J Immunol,2004,173 (9):5361 -5371.
