产壳聚糖酶菌株的单因素及复合条件诱变育种*
2012-06-05王艳君廖春林
王艳君,廖春林
(福建师范大学福清分校生化系,福建福清350300)
壳聚糖酶(Chitosanase,EC3.2.1.99)是水解壳聚糖制备壳寡糖的专一性水解酶之一,是一种不同于几丁质酶的新酶,是能够水解完全脱乙酰化的壳聚糖。国内外大量研究表明,壳聚糖酶可以提高植物抗性、防治病虫害、提高农作物产量等。另外,其水解产物壳寡糖(Chitooligosaccharides,简称COSs)则具有独特的生理活性和功能,可提高机体免疫力、抑制肿瘤细胞生长、在人体肠道内可活化增殖双歧杆菌、降低血压等,同时壳寡糖还具有抗菌防腐、保水保湿等性能,其在医药、食品、化妆品等工业中具有广阔的应用前景[1-2]。
目前壳聚糖酶已商品化,但由于原始出发菌株产壳聚糖酶能力仍较低,使得壳聚糖酶的生产成本偏高,限制了壳聚糖酶的实际应用。因此,筛选高产壳聚糖酶的菌株以及通过诱变等方式提高壳聚糖酶产量的研究具有重要的理论和实际意义。已报道的产壳聚糖酶的微生物主要有:肠杆菌(Enterobacter sp.)[3]、链霉菌(Streptomyces spp.)[4]、芽孢杆菌(Bacillus sp.)[5]、假单胞菌(Psuedomanas sp.)[6]、拟无枝杆菌(Amycolatopsis sp.)[7]、粘细菌(Myxobacter sp.)[8]、金杆菌(Aureobacterium sp.)[9]、诺卡氏菌(Nocardia orientalis)[10]、木 霉 (Trichoderma.reesei)[11]、青 霉 (Penicillum islandicum)[12]、毛 霉 (Mucor rouxii)[13]、曲霉(Aspergillus fumigatus)[14]、镰孢菌(Fusarium solani)[15]、白僵菌(Beauveria bassiana)[16]、红酵母(Rhodotorula gracilis)[17]等。本研究以土壤中分离筛选得到的一株产壳聚糖酶的青霉菌M2为出发菌株,结合物理及化学复合诱变方法,探讨不同的诱变方法对提高该菌株产壳聚糖酶活力的影响。
1 材料与方法
1.1 材料与试剂
青霉菌M2由本实验室从福建沿海潮间带泥样中筛选得到,作为碳源的水溶性壳聚糖购自浙江金壳有限公司。其他试剂均为国产分析纯。
1.2 培养基
诱导产酶培养基:水溶性壳聚糖1.0%,硫酸铵1.87%,氯化钠 0.5%,MgSO4·7H2O 0.13%,K2HPO4·3H2O 0.14%,KH2PO40.03%,酵母提取物 0.3%,葡萄糖 0.1%,pH 6.5。
1.3 实验方法
1.3.1 孢子悬液的制备
用无菌接种环挑取一环M2菌株于已灭菌的液体培养基中,放入摇床150 r/min,30℃下培养72 h,取适量菌液于离心管中,在4000 r/min下离心10 min,取上清液,在相同条件下再离心1次,取上清液。用无菌水将孢子悬液稀释到107~108个/mL,即制成孢子悬液。
1.3.2 紫外线诱变
取适量孢子悬液于培养皿中,在距离为30 cm,功率为15 W的紫外灯下照射,照射时间分别为1 min、2 min、3 min、4 min、5 min、6 min、7 min 和8 min,分别编号为1、2、3、4、5、6、7 和8。将诱变后的孢子悬液在红光条件下梯度稀释至浓度为1.0×10-5个/mL后涂平板。以未处理的菌悬液涂平板作对照,编号为0(重复3次),于28℃避光培养3 d,计算致死率,挑取菌株并摇瓶培养,测定菌株的酶活力。
致死率(%)=(诱变后菌株数-对照组菌株数)/对照组菌株数×100%
酶活单位:每分钟产生1μmol还原糖所需的酶量为一个壳聚糖酶活力单位(U)。
1.3.3 亚硝酸钠诱变
用无菌水将孢子悬液系列梯度稀释至1.0×10-5个/mL,取2.0 mL悬液和0.1 mol/L的NaNO21.0 mL 混匀,28℃下分别保温1 min、2 min、3 min、4 min、5 min、6 min 和 7min,然后加入 0.2 mol/L,pH 为4.4的醋酸缓冲液1.0 mL,在28 ℃保温10 min,加入2.0 mL pH 为8.6的 Na2HPO4中和,各取0.1 mL涂布平板,3次重复,以未处理的菌悬液涂平板作对照,于28℃避光培养3 d,计算致死率后,挑致死率最高的菌株进行摇瓶培养,测定菌株的酶活力。
1.3.4 亚硝酸钠和紫外线复合诱变处理
根据紫外线和NaNO2对孢子液的处理结果,确定复合诱变中紫外线照射的时间和NaNO2诱变时间,将紫外线照射后的孢子悬液稀释后加入NaNO2诱变一定的时间(重复3组),再将诱变后的孢子悬浮液适当稀释后,吸取0.1 mL,涂平板,于28℃避光培养3 d,计算致死率,挑取少量的菌株进行摇瓶培养,测定菌株的酶活力[18]。
2 结果与分析
2.1 紫外线诱变剂量的确定
紫外线对产壳聚糖酶M2菌株的致死效应和酶活力效应分别见图1和图2。

图1 紫外线诱变条件下的M2菌株的致死率

图2 紫外线诱变条件下的突变菌株的酶活力测定
从图1中可以看出:随着紫外线对孢子处理时间的延长,致死率增大,在紫外线处理时间为4 min时的致死率为63.33%,其菌株酶活力高达6.5 U/mL(图2),因此将紫外线的处理时间确定为4 min。
2.2 亚硝酸钠诱变剂量的确定
亚硝酸钠对产壳聚糖酶M2菌株的致死效应和酶活力效应分别见图3和图4。

图3 亚硝酸钠诱变条件下的M2菌株的致死率

图4 亚硝酸钠诱变条件下的突变株的酶活力测定
由图3可知:随着亚硝酸钠对孢子处理时间的延长,致死率增大,在亚硝酸钠(NaNO2)处理时间为4 min时的致死率为66.67%,其菌株酶活力高达6.125 U/mL(图4),为所处理组中效果最好的。因此将亚硝酸钠的处理时间确定为4 min。
2.3 紫外线和亚硝酸钠复合诱变剂量的确定
根据紫外线诱变和亚硝酸钠诱变的结果,在复合诱变中将紫外线的照射时间确定为4 min,亚硝酸钠的诱变时间确定为4 min。将复合诱变组定为:(1):紫外照射3 min,亚硝酸钠处理3min;(2):紫外照射3.5 min,亚硝酸钠处理3.5 min;(3):紫外照射4 min,亚硝酸钠处理4 min;(4):紫外照射4.5 min,亚硝酸钠处理4.5 min;(5):紫外照射5 min,亚硝酸钠处理5 min;(6):紫外照射5.5 min,亚硝酸钠处理5.5 min。紫外线和亚硝酸钠复合诱变对产壳聚糖酶M2菌株的致死效应及酶活力效应分别见图5和图6。
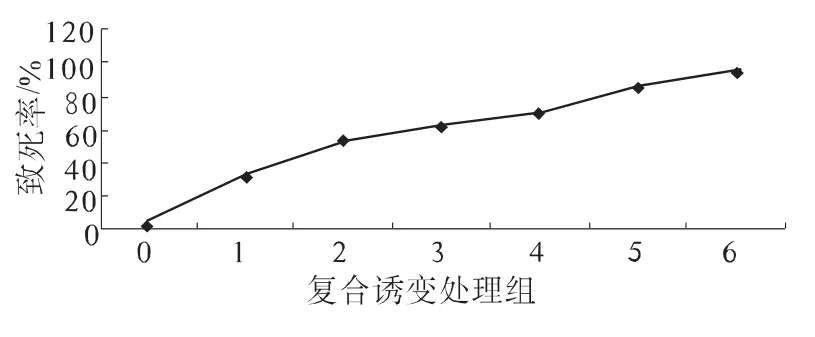
图5 复合诱变的致死效应

图6 复合诱变的酶活力效应
从图5中可以看出:随着复合诱变对孢子处理时间的延长,致死率增大,在复合诱变处理时间为4.5 min时的致死率为70%,其菌株酶活力高达8.135 U/mL,比原出发菌株提高了1.381倍,为所处理组中效果最好的。由此可见,复合诱变效果要优于单一的紫外线或亚硝酸钠诱变效果,酶活性较之紫外线诱变后提高了25.15%,比亚硝酸钠诱变后的菌株提高了32.82%。
3 结束语
在微生物发酵生产实践中,微生物优良菌种的选育是一项极其重要且必须长期坚持的工作。微生物诱变育种具有速度快、收效大、方法简单等优势,它是菌种选育的一个重要途径[19-20]。传统的诱变育种仍是大多数工业微生物育种最重要、最有效的技术[18、21],在菌种筛选中应用广泛。诱变育种方法众多,目前国内微生物育种主要采用的仍是常规的物理因子诱变方法、化学因子诱变方法和复合诱变育种。
紫外线是一种历史悠久、效果好、设备简单、值得推广的一种诱变方法。亚硝酸钠是常用的烷化剂,应用广泛,突变率也高,和紫外线一起对菌株进行复合诱变能增强紫外线的诱变效应。梁亮[22]等研究表明,以1株谷氨酸棒杆菌(Corynebacterium glutamicum)S6为出发菌株,利用紫外线(UV)、亚硝酸钠(NaNO2)、紫外线与亚硝酸钠复合诱变,最终筛得3株突变菌株,产量提高了1.9% ~7.14%。其研究结果显示,经紫外线与亚硝酸钠复合诱变后的菌株F6产L-组氨酸的产量最高,比亚硝酸钠诱变后的菌株产L-组氨酸量提高2.06%,比紫外线诱变后的菌株产L-组氨酸量提高5.24%。刘春芬[23]等研究表明:紫外线、亚硝酸钠诱变因子对绿色木霉13010菌体细胞的致死作用表现出相似的趋势,在一定范围内都与诱变剂量呈线性正相关。在协同诱变条件下,多轮反复诱变绿色木霉13010后,菌株的酶活力有大幅提高,最终得到产纤维素酶活力提高了70.63%的菌株。本研究利用紫外线和亚硝酸钠对产壳聚糖酶M2菌株进行复合诱变所得的高产壳聚糖酶菌株的酶活力高达8.135 U/mL,比原出发菌株提高了1.381倍,比紫外线诱变后的产壳聚糖酶菌株提高了25.15%,比亚硝酸钠诱变后的菌株提高了32.82%。
[1]刘萍,刘靖,祁兴普,等.绿色木霉产内切壳聚糖酶的鉴定及酶学性质的研究[J].食品工业科技,2011(12):254-257.
[2]程仕伟,孙爱友.酶法制备甲壳低聚糖研究的进展[J].生物加工过程,2011(5):65-70.
[3]Yamasaki Y,Hayashi I,Ohta Y,et al.Purification and mode of action of chitosanolytic enzyme from Enterobacter sp.G -1[J].Bioscience Biotechnology and Biochemistry,1993,57(3):444 -449.
[4]Ohtakara A,Ogata H,Taketomi Y,et al.Purification and characterization of chitosanase from Streptomyces griseus[J].Chitin,Chitosan and Related Enzymes,1984:147 -160.
[5]Yabuki M,Uchiyama A,Suzuki K,et al.Purification and properties of chitosanase from Bacillus circulans MH-K1[J].Journal of General and Applied Microbiology,1988,34(3):255-270.
[6]Yoshihara K,Hosokawa J,Kubo T,et al.Purification and properties of a chitosanase from Pseudomonas sp.H -14[J].Bioscience,Biotechnology,and Biochemistry,1992,56(6):972-973.
[7]Okajima S,Ando A,Shinoyama H,et al.Purification and characterization of an extracellular chitosanase produced by Amycolatopsis sp.CsO -2[J].Journal of Fermentation and Bioengineering,1994,77(6):617 -620.
[8]Hedges A,Wolfe R S.Extracellular Enzyme From Myxobacter AL-1 That Exhibits Both beta-1,4-Glucanase and Chitosanase Activities[J].Journal of Bacteriology,1974,120(2):844.
[9]Dongmi L,Lee E L,Kang M A N L.Isolation and characterization of chitosanase-producing microorganism,Aureobacterium sp.YL,from crab shells[J].Journal of Microbiology and Biotechnology,2000,10(2):208 -214.
[10]Sakai K,Katsumi R,Isobe A,et al.Purification and hydrolytic action of a chitosanase from Nocardia orientalis[J].Biochimica Et Biophysica Acta,1991,1079(1):65-72.
[11]Nogawa M,Takahashi H,Kashiwagi A,et al.Purification and Characterization of Exo-beta-D-Glucosaminidase from a Cellulolytic Fungus,Trichoderma reesei PC -3 -7[J].Applied and Environmental Microbiology,1998,64(3):890.
[12]Fenton D M,Eveleigh D E.Purification and mode of action of a chitosanase from Penicillium islandicum[J].Journal of General Microbiology,1981,126(1):151.
[13]Alfonso C,Martínez M J,Reyes F.Purification and properties of two endochitosanases from Mucor rouxii implicated in its cell wall degradation[J].Fems Microbiology Letters,1992,95(2 -3):187 -194.
[14]Kim S Y,Shon D H,Lee K H.Purification and characteristics of two types of chitosanases from Aspergillus fumigatus KH-94[J].Journal of Microbiology and Biotechnology,1998,8(6):568 -574.
[15]Shimosaka M,Nogawa M,Ohno Y,et al.Chitosanase from the plant pathogenic fungus,Fusarium solanif.sp.phaseoli:purification and some properties[J].Bioscience Biotechnology and Biochemistry,1993,57(2):231 -235.
[16]方祥年,杜昱光,黄秀梨,等.球孢白僵菌胞外壳聚糖酶的纯化和性质[J].菌物系统,2002(1):77-83.
[17]Somashekar D,Joseph R.Partial purification and properties of a novel chitosanase secreted by Rhodotorula gracilis[J].Letters in Applied Microbiology,1992,14(1):1-4.
[18]施巧琴,吴松刚.工业微生物育种学[M].2版.北京:科学出版社,2003.
[19]苟丽霞,安德荣,刘双发,等.瑞拉菌素产生菌RL-2的诱变育种[J].微生物学通报,2009,36(8):1212-1216.
[20]李成,李红梅,弓爱君,等.苏云金芽孢杆菌诱变育种的初步研究[J].中国农学通报,2009,25(2):206-209.
[21]雷肇祖,钱志良,章健.工业菌种选育述评[J].工业微生物,2004,34(1):39-51.
[22]梁亮,邱雁临,许进涛.紫外线与亚硝酸钠复合诱变选育L-组氨酸产生菌[J].微生物学杂志,2008,3(28):27-29.
[23]刘春芬,贺稚非.纤维素酶高产菌株的诱变选育[J].中国酿造,2008,5(182):29-33.
