注射用灯盏花素在7种注射液中的稳定性研究
2012-06-04杨亚青张智琪解放军总医院北京100853
杨亚青,张智琪,林 辉,白 林 ,任 韡 ,刘 萍(解放军总医院,北京 100853)
有些中药注射剂与溶剂易发生配伍禁忌,甚至按药品说明书规定的溶剂配伍,不溶性微粒也明显多于空白溶剂。过量不溶性微粒进入人体内可导致微循环障碍,或造成机体功能失调及心、肝、肺、肾损害。因此,中药注射剂与溶剂的合理配伍是医疗安全的重要保证。
注射用灯盏花素是从灯盏花全株植物中提取的黄酮类成分,具有改善脑微循环,增加脑血流量,增加外周、冠脉和心肌血流量,抑制血小板聚集,减少脂质过氧化物,增强纤溶活性,降低血液黏滞度的作用[1],适用于缺血性脑血管病,如脑供血不足、椎基底动脉供血不足、脑出血后遗症,也用于冠心病、心绞痛、高血压、高黏滞血症等心血管疾病。但其药品不良反应时有发生,为寻找原因,本实验模拟临床配药方法,考察注射用灯盏花素与临床常用溶剂5%葡萄糖注射液、10%葡萄糖注射液、5%葡萄糖氯化钠注射液、极化液(含Na+、K+、Ca2+)、0.9%氯化钠注射液、果糖注射液、转化糖电解质注射液配伍后,混合液放置时间与药物稳定性的关系,观察配伍后混合液的性状、pH值、不溶性微粒、吸收度的变化,为临床安全、有效、经济用药提供参考。
1 仪器与试药
1.1 仪器
PB-10酸度计(厂家:SARTOTIUS),紫外UV-2550(厂家:SHIMADZU),8000A粒子计数器(厂家:HIAC/ROYCO公司)。
1.2 试药
注射用灯盏花素(衡阳恒生制药有限公司,50 mg/支,批号:20090609);5%葡萄糖注射液(青岛华仁制药有限公司,500 mL/袋,批号:H1002006);10%葡萄糖注射液(青岛华仁制药有限公司,500 mL/袋,批号:H0911004);0.9%氯化钠注射液(青岛华仁制药有限公司,500 mL/袋,批号:A0910006);5%葡萄糖氯化钠注射液(青岛华仁制药有限公司,500 mL/袋,批号:01002003);极化液由以下3种制剂与灭菌注射用水(石家庄四药有限公司,500 mL/袋,批号:100223110)临时配制而成:15%氯化钾注射液,北京益民药业有限公司,10 mL/支;10%氯化钠注射液,北京双鹤药业有限公司,10 mL/支,批号:090903;氯化钙注射液,上海信谊金朱药业有限公司,10 mL/支,批号:090401);转化糖电解质注射液(四川美大康佳乐药业有限公司,250 mL/袋,批号:09010244);果糖注射液(江苏正大丰海制药有限公司,500 mL/瓶,批号:1003012)。
2 实验方法
2.1 配伍液配制
所有配制操作均在层流净化台中进行,分别用一次性注射器取灭菌注射用水(10 mL)推入50 mg灯盏花素中摇匀,待药物完全溶解后分别将其全部溶于上述7种溶剂中配置成500 mL溶液,将上述配置好的样品溶液置于18℃放置,先后在0、1、2、4、8 h采集上述7种样品溶液,分别观察溶液外观、测量不溶性微粒及pH值。分别取上述7种样品溶液20 mL置200 mL容量瓶稀释至刻度,将上述稀释后的样品溶液置于18℃放置,采集稀释后的样品溶液先后在0、1、2、4、8 h测量吸收度。
2.2 性状观察
取样品溶液,在澄明度检测仪白色、黑色的背景下各观察6 s,内容包括颜色、可见异物。
2.3 pH值测定
按《中华人民共和国药典》附录ⅥH对样品溶液进行测定。
2.4 不溶微粒测定
按《中华人民共和国药典》附录ⅨC对装量为100 mL或100 mL以上的静脉用注射液的不溶性微粒规定(光阻法)进行测定:除另有规定外,每1 mL中含直径10 μm以上的微粒不得超过25粒,含25 μm以上的微粒不得超过3粒[2]。
2.5 吸收度测定
分别取上述7种样品溶液20 mL置200 mL容量瓶稀释至刻度,得到各稀释后的样品溶液。将每种稀释后的样品溶液以各种单纯的溶剂作为空白对照,于200~400 nm范围内扫描,得最大吸收波长为324 nm,于是在324 nm波长处测定各稀释后的样品溶液在 0、1、2、4、8 h 的吸光度。
2.6 统计学方法
采用SPASS统计软件对各样品溶液的各个数据进行随机单位组的方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 外观检测
18 ℃放置上述7 种样品溶液,在0、1、2、4、8 h 时观察各样品溶液的外观变化。室温下注射用灯盏花素与此7种溶剂配伍后,0 h均无变化;1 h后果糖注射液显极淡的微黄色,澄明,无气泡沉淀生成,可见极细小的微粒;2 h后转化糖电解质液颜色也开始变为极淡的乳黄色,在灯光下有肉眼可见颗粒;4 h时果糖注射液由极淡的乳黄色接近乳白色,十分浑浊,颗粒状沉淀物越来越多,沉积瓶底,沉淀物为乳黄色;8 h时果糖注射液见大量颗粒状乳黄色沉淀物沉淀在瓶底,转化糖电解质液在8 h浑浊加重,细小的纤维状物明显增多,部分融合成颗粒,见很多细小的颗粒状乳黄色沉淀,出现明显浑浊现象,10%葡萄糖注射液8 h有肉眼可见混浊。而5%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、极化液配伍后药液均显极淡的微黄色,澄明,在实验过程中8 h内药物颜色、澄明度无明显变化,无气泡、沉淀生成,见表1。

表1 7种灯盏花素配伍样品溶液的外观变化Tab 1 Changes in appearances of the mixtures of Breviscapine for injection in 7 solvents
3.2 pH值检测
18℃放置上述7种样品溶液,在0、1、2、4、8 h时检测各样品溶液的pH值变化。实验中药液的pH值无显著变化,见表2。
3.3 微粒检测
18℃放置上述7种样品溶液,在0、1、2、4、8 h时检测各样品溶液的微粒数变化。注射用灯盏花素与5%葡萄糖注射液、0.9%氯化钠注射液配伍后,不溶性微粒在0~8 h内均符合标准,与5%葡萄糖氯化钠注射液、10%葡萄糖配伍后不溶性微粒在0~4 h内符合标准,但在8 h超过《中国人民共和国药典》标准,与极化液、果糖、转化糖电解质配伍后,不溶性微粒均大大超出标准,见表3。
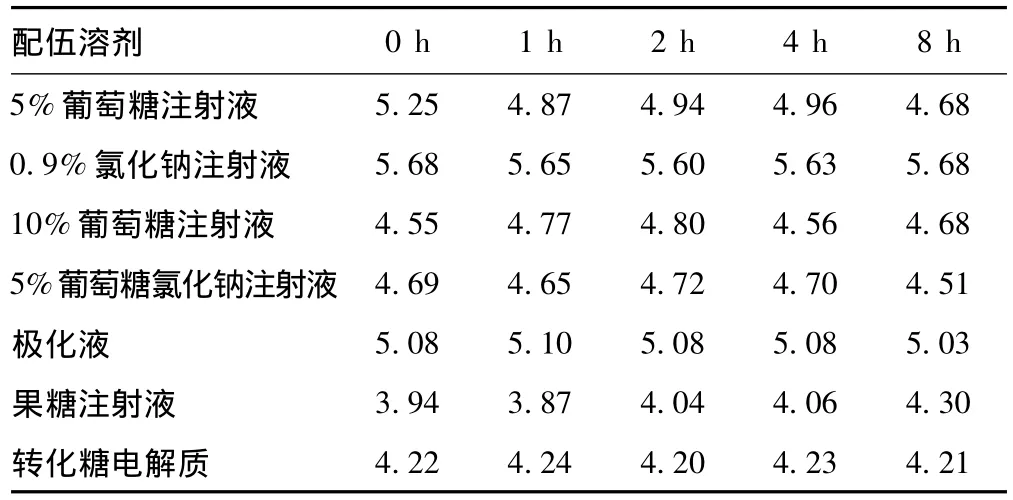
表2 7种灯盏花素配伍样品溶液的pH值变化Tab 2 Changes in pH of the mixtures of Breviscapine for injection in 7 solvents

表3 7种灯盏花素配伍样品溶液不溶性微粒直径的变化(μm)Tab 3 Changes in size of insoluble particle of the mixtures of Breviscapine for injection in 7 solvents(μm)
3.4 吸收度检测
18℃放置上述7种样品溶液,在0、1、2、4、8 h时检测各样品溶液的吸收度变化,结果见表4。把表4中配置的7种灯盏花素配伍稀释后的样品溶液(C=50 000 ug/500 mL/10=10 ug·mL-1,C为各样品溶液中灯盏花素的药物浓度)0 h时的含量定为100%,在324 nm波长处测定各配伍溶液1、2、4、8 h的A值,按公式A1/A2=C1/C2Ax为各时间点测出的配伍液的A值(Cx为各时间点计算出的配伍溶液的浓度)计算出1、2、4、8 h时各配伍溶液的浓度,得出含量的标示量。采用SPASS软件对以上数据进行随机组的统计学分析,得出随着时间的变化各样品溶液的吸光度的差异P=0.049,有统计学意义。

表4 7种灯盏花素配伍样品溶液的吸收度变化Tab 4 Changes in absorbability the mixtures of Breviscapine for injection in 7 solvents
3 讨论
《中国人民共和国药典》规定5%葡萄糖注射液的pH范围为3.2~5.5,果糖注射液pH值范围为3.5~5.8,0.9%氯化钠注射液pH范围为4.5~7.0。灯盏花素有效成分为黄酮类,在偏酸性溶剂中易析出沉淀,有文献报道[3],在灯盏细辛注射液中加入0.9%氯化钠注射液,微粒增加的数量最小,溶剂为葡萄糖注射液的不良反应(ADR)发生比例明显高于溶剂为氯化钠注射液的发生比例[4],在本实验中,样品溶液在0~8 h内pH值没有明显变化,在实验设计的时间内时间对pH的影响稳定,与10%葡萄糖注射液、果糖注射液、转化糖电解质配伍的样品溶液微粒数发生了较大的变化,最后产生沉淀,与0.9%氯化钠注射液配伍的样品溶液微粒数始终在正常范围内也验证了此观点。因此建议在临床输注灯盏花素时选择使用0.9%氯化钠注射液配伍。
结果显示,注射用灯盏花素与5%葡萄糖注射液、0.9%氯化钠注射液配伍后,不溶性微粒在0~8 h内均符合《中华人民共和国药典》规定的标准,与5%葡萄糖氯化钠注射液、10%葡萄糖配伍后不溶性微粒在0~4 h内符合标准,但在8 h超过《中国人民共和国药典》标准,有待进一步的平行实验论证;与果糖注射液、极化液、转化糖电解质配伍后,不溶性微粒均大大超出标准,应视为不可与其配伍使用。
吸收度实验显示,7种配伍液中有6种配伍液吸收度变化不明显,而转化糖电解质液的吸收度1 h后发生轻微下降,其原因可能是灯盏花素有效成分黄酮在转化糖电解质液与镁离子等络合或轻微氧化所致。
综上所述,为避免出现药液变质、降效,在使用注射用灯盏花素中应遵循以下几点:(1)在与其他药物混合使用时,必先用注射用水、0.9%氯化钠溶液等指定的溶剂溶解后再与其他药物混合,混合后发生浑浊、沉淀应立即停用;(2)不得与pH低于4.2的溶剂或药物合用[5];(3)另外,因发现与氨基糖苷类药物反应可产生沉淀,故稀释注射用灯盏花素所用的注射器,针头应避免与氨基糖苷类药接触。
[1]陈新谦,金有豫,汤 光,等.新编药物学[M].第15版.北京:人民卫生出版社,2003:363-364.
[2]国家药典委员会.中华人民共和国药典:一部[S].2005年版.北京:化学工业出版社,2005:附录54-55.
[3]刘世萍,曲 婷,侯疏影.灯盏细辛注射液与输液剂混合后的微粒观察[J].伤残医学杂志,2004,12(4):49.
[4]李 茵,于高路.3种灯盏花注射液不良反应分析[J].中国中医药信息杂志,2007,14(4):105.
[5]李昌勤,屠万倩.HPLC法测定灯盏花素片中野黄芩苷的含量[J].中药新药与临床药理,2006,17(3):212.
