分离自腊鱼的乳酸菌生长及产酸特性
2012-06-01熊善柏曾令彬赵思明
谢 静,熊善柏,曾令彬,赵思明*
(华中农业大学食品科学技术学院,湖北省水产品加工工程技术中心,湖北 武汉 430070)
分离自腊鱼的乳酸菌生长及产酸特性
谢 静,熊善柏,曾令彬,赵思明*
(华中农业大学食品科学技术学院,湖北省水产品加工工程技术中心,湖北 武汉 430070)
采用Gompertz模型拟合从腊鱼中分离的5株乳酸菌的生长和产酸曲线,分析其生长和产酸特性。结果表明:Gompertz模型对乳酸菌的生长和产酸曲线的拟合精度很高;在生长模型和产酸模型中,5株乳酸菌生长的早期适应性相似,其中乳酸片球菌和食品乳杆菌的生长速率(0.32h-1)和产酸速率(0.32h-1)高于其他菌株;在生长模型中两者平衡菌数最高(分别为2.48和2.49);在产酸模型中两者平衡pH值最低(都为3.76);乳酸菌培养液的pH值与总菌数OD600nm值显著线性负相关。
乳酸菌;Gompertz模型;生长曲线;产酸曲线
腊鱼一般是以淡水鱼为原料,用食盐和香辛料在低温条件下腌制,经自然或人工干燥而成。葡萄球菌、乳酸菌、酵母菌和霉菌等微生物是腊制品中常见的微生物[1],乳酸菌是腊鱼发酵过程中的优势菌[2],对发酵鱼风味和优良品质的形成发挥着重要作用[3]。
微生物的生长曲线能够反映其生长规律和特性,对比较不同微生物的特性和预测食品货架期具有指导作用。微生物的生长模型有多种,修正的Gompertz模型和Logistic模型被广泛应用于食品中微生物生长曲线的模拟[4-5],其中Gompertz模型更适合于乳酸菌的拟合[6]。由于乳酸菌的来源不同,其生长特性存在一定的差异[7]。作为腊鱼发酵剂的优良菌种,应该生长旺盛和具有一定的产酸能力,从而缩短生产时间、改善产品风味和抑制腐败菌生长[8]。本实验采用Gompertz模型,拟合本研究室从腊鱼制作过程中分离鉴定的5株乳酸菌的生长和产酸曲线,分析不同乳酸菌的生长和产酸特性,以期为筛选适合腊鱼加工的优良菌种提供实验数据。
1 材料与方法
1.1 菌种、培养基与仪器
乳酸菌:植物乳杆菌(Lactobacillus plantarum)、弯曲乳杆菌(Lactobacillus curvatus)、食品乳杆菌(Lactobacillus alimentarius)、乳酸片球菌(Pediococcus acidiactici)、戊糖片球菌(Pediococcus pentosaceus),本研究室分离自腊鱼加工过程的鱼肉中[8]。
MRS液体培养基[8],用于乳酸菌的培养。
DL-CJ-1N 型超净工作台 哈尔滨东联电子技术开发有限公司; 722S 型分光光度计、PHS-3D型 pH计 上海精密科学仪器有限公司;HN303型恒温摇床培养箱南通沪南科技有限公司。
1.2 方法
1.2.1 生长曲线和产酸曲线的测定
乳酸菌生长曲线的测定采用比浊法。将保藏在-18℃冰箱中的菌株转接到已灭菌的9mL液体MRS培养基中,培养18h,连续进行3次活化,得到活化的乳酸菌的培养液。取1mL培养18h的乳酸菌培养液,接种于200mL MRS液体培养基中,在恒温摇床培养箱中30℃培养36h。培养期间每隔2h取样一次,以不接种的MRS液体培养基作空白,用分光光度计测定培养液的光密度OD值[9],测定波长为600nm,用OD600nm值表示总菌数。用pH计测定上述不同培养时间取样的培养液的pH值,乳酸菌的产酸量用pH值表示[10]。
1.2.2 生长曲线和产酸曲线的拟合
根据乳酸菌的OD值和pH值随时间变化时的散点分布,采用Gompertz方程[11]拟合乳酸菌的生长曲线和产酸曲线。Gompertz方程如下:

式中:N为培养时间t时的总菌数,用OD值表示;N0、 b0与初始菌数和平衡菌数相关的参数,当t=0时,初始菌数Nt=0=N0+b0e-b1,当t→+∞时,平衡菌数Nt=+∞=N0+b0;b1为反应早期适应性的常数,b1越大早期适应性越差;b2为生长速率常数/h-1,b2越大生长越快。

式中:P为培养时间t时的产酸总量,用pH值表示;P0、b0与初始pH值和平衡pH值相关的参数,当t=0时,初始pH值Pt=0=P0+m0e-m1,当t→+∞时,平衡pH值Pt=+∞=P0+m0;m1反应早期适应性的常数;m2为产酸速率常数/h-1,m1越大产酸越快。
1.2.3 数据处理
采用Microsoft Excel 2003绘图,采用SAS 8.0对数据进行回归分析。所有数据平行测定3次,回归分析中参数的计算采用最小二乘法[12]。
2 结果与分析
2.1 乳酸菌的生长曲线
由图1可知,5株乳酸菌的生长都经历了延缓期、快速生长期和稳定期,接种后5~15h内OD值增加最快,20h后各菌株都进入稳定期,但不同菌株的生长速率和平衡菌数不同,其中食品乳杆菌和乳酸片球菌生长最旺盛,植物乳杆菌和弯曲乳杆菌次之,戊糖片球菌生长最慢,平衡菌数高低顺序与生长速度顺序一致。
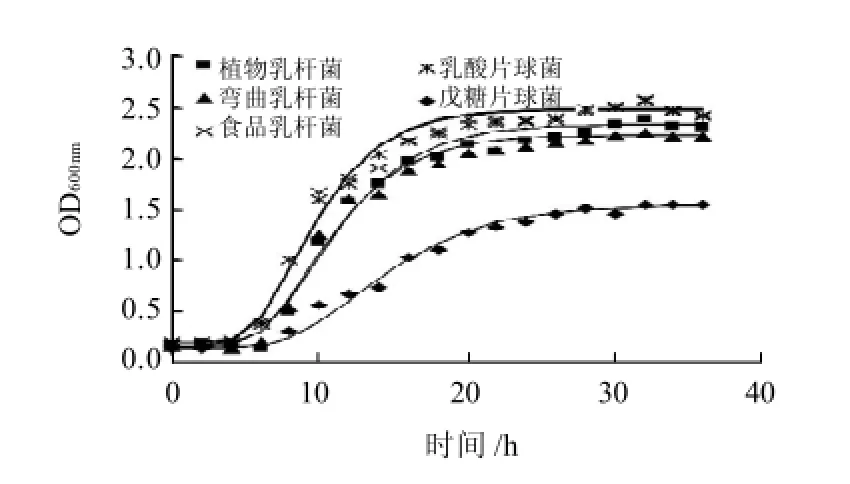
图1 乳酸菌在30℃的生长曲线Fig.1 Growth curve of lactic acid bacteria ( 30 ℃)
Gompertz生长模型中参数的值见表1。5株乳酸菌剩余平方和(SSE)都小于回归平方和(SSR),相关系数(R2)为0.99,表明用Gompertz模型拟合乳酸菌的生长曲线具有很高的精度。生长模型中b1反映了乳酸菌早期的生长适应性,b2是反映生长速率的参数,两者能够较好反应微生物的生长特性[9]。5株乳酸菌的b1相互接近,表明各乳酸菌的早期适应性相似。食品乳杆菌和乳酸片球菌的生长速率常数b2最大,且两者的数值相近,表明其生长最快,其次是植物乳杆菌和弯曲乳杆菌,戊糖片球菌最小。乳酸菌平衡菌数N0+b0从大到小依次是食品乳杆菌、乳酸片球菌、植物乳杆菌、弯曲乳杆菌和戊糖片球菌,与生长速率常数的规律一致。生长速率越大,平衡菌数越大,表明最终的菌数取决于生长速率。这一结论与Katarzyna[13]和Wachenheim[14]相似,他们在研究发酵肉制品中微生物和批量培养的微生物的生长模型时发现,在营养充足的条件下,平衡菌数主要与微生物的生长速率相关。
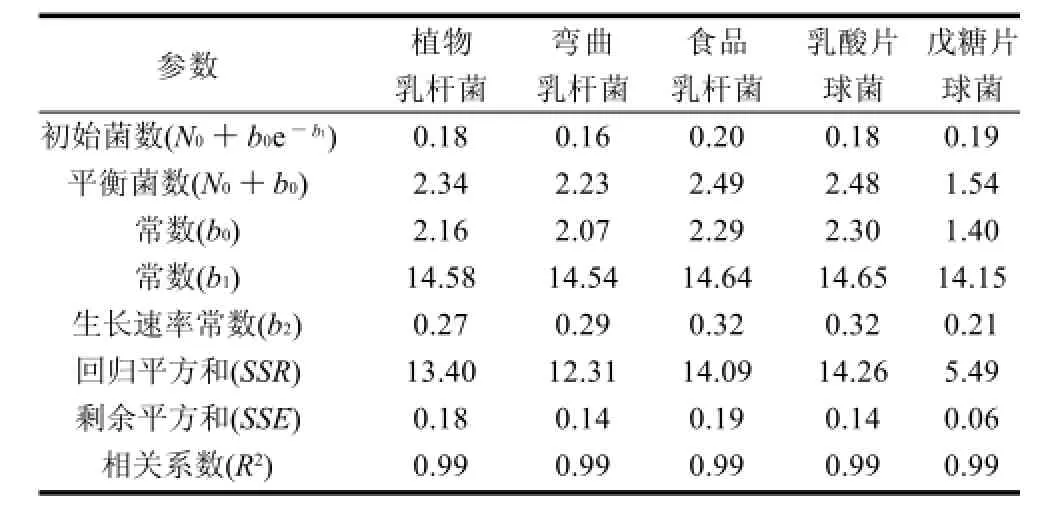
表1 乳酸菌生长模型中的参数Table 1 Parameters in the growth model for lactic acid bacteria
2.2 乳酸菌的产酸曲线
乳酸菌能够分解原料中的碳水化合物,产生的乳酸使原料的pH值下降,不仅可以抑制有害微生物的生长[15],还可以赋予腊鱼柔和的香气。由图2可知,在培养过程中,0~5h内乳酸菌培养液的pH值变化缓慢,5~15h内快速下降,20h以后稳定,但不同菌株pH值的下降速度和平衡时pH值不同。比较图1与图2,pH值与OD600nm值的变化都经历了延缓期、快速变化期和稳定期,且不同时期经历的时间也大致相同;随着培养时间的延长,菌液pH值的下降,乳酸菌的生长逐渐受到抑制,总菌数OD600nm值趋于平衡。
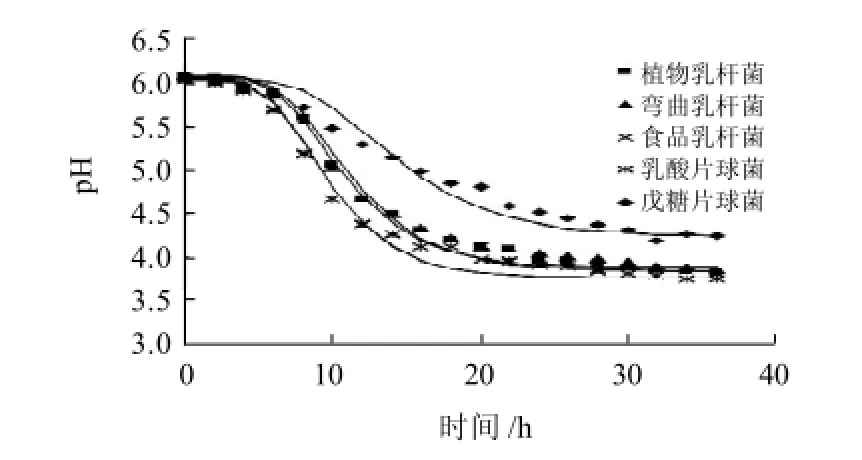
图2 乳酸菌在30℃的产酸曲线Fig.2 Acid-producing curve of lactic acid bacteria (30 ℃)
采用Gompertz模型拟合的产酸曲线,模型中各参数的值见表2。从回归分析的回归平方和(SSR)、 剩余平方和(SSE)和相关系数(R2)的值可以看出,用Gompertz模型拟合的5株乳酸菌的产酸曲线,均有较高精度。Gompertz产酸模型中产酸速率常数(m2)从大到小依次是乳酸片球菌(食品乳杆菌)、植物乳杆菌、弯曲乳杆菌和戊糖片球菌,其中戊糖片球菌的产酸速率常数显著低于其他乳酸菌;平衡时戊糖片球菌的培养液的pH值下降至4.23,其他乳酸菌的pH值可降至3.8,表明戊糖片球菌的耐酸能力最低。
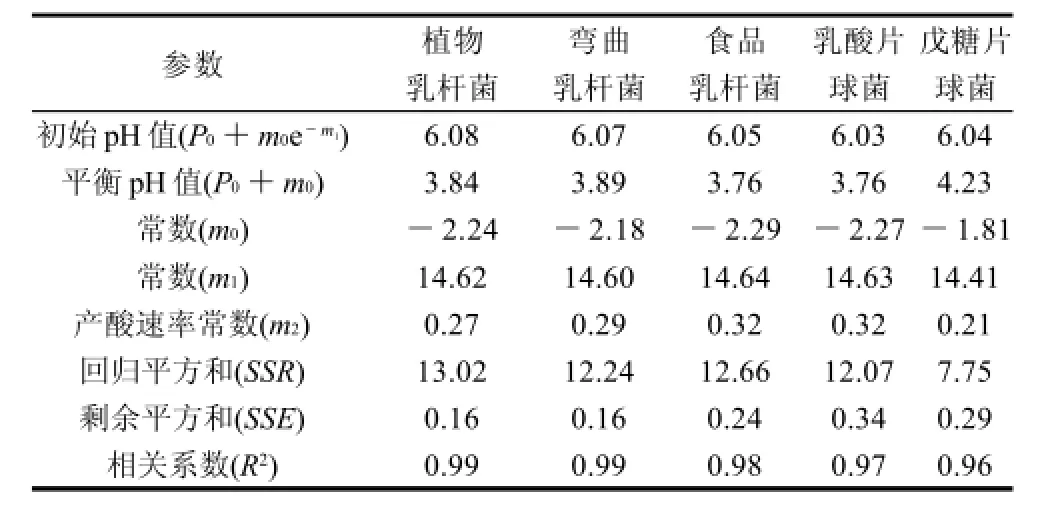
表2 乳酸菌产酸模型中的参数Table 2 Parameters in the pH model for lactic acid bacteria
2.3 乳酸菌培养液pH值与OD600nm值的相关性
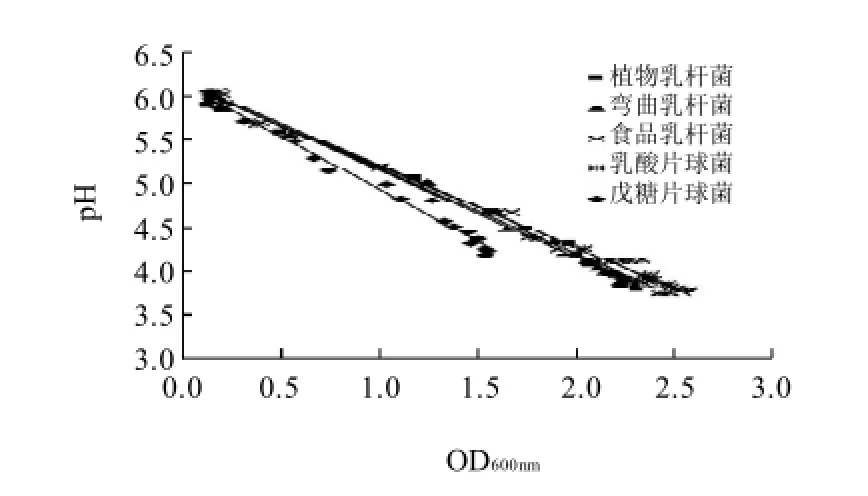
图3 乳酸菌培养液pH值与OD600nm值的相关性Fig.3 Correlation of pH and OD600nm
图3 为乳酸菌培养液的pH值与OD600nm值的关系图。根据数据的分布规律,采用方程式(3)描述p H值与OD600nm值的关系。

式中:斜率k的绝对值表示单位数量乳酸菌的产酸量;b为培养基的初始pH值,本实验为6.2。
式(3)中的参数见表3。相关系数均大于0.95,表明乳酸菌培养液pH值与总菌数显著线性负相关,式(3)的拟合精度很高。弯曲乳杆菌、植物乳杆菌、食品乳杆菌、乳酸片求菌的k值接近,戊糖片球菌k的绝对值最高,表明单位数量戊糖片球菌的产酸量最高。虽然戊糖片球菌单位数量菌体的产酸量高,但由于其生长速率较慢,平衡菌数较少,因此达到平衡时pH值较高。

表3 pH值乳酸菌培养液OD值直线方程的各参数Table 3 Parameters in the linear equation
3 结 论
Gompertz模型对植物乳杆菌、弯曲乳杆菌、食品乳杆菌、乳酸片球菌、戊糖片球菌的生长和产酸曲线具有很高的拟合精度,生长曲线和pH值曲线都经历了延缓期、快速变化期和稳定期。5株乳酸菌生长的早期适应性相似,其中乳酸片球菌和食品乳杆菌的生长速率常数和产酸速率常数最大,生长和产酸最快,平衡菌数最高,平衡pH值最低。方程pH=b+kOD600nm对pH值与总菌数的关系具有较高的拟合精度,pH值与总菌数OD600nm显著线性负相关。
[1]曾令彬, 熊善柏, 王莉. 腊鱼加工过程中微生物及理化特性的变化[J]. 食品科学, 2009, 30(3): 54-57.
[2]曾令彬, 谭汝成, 熊善柏, 等. 腊鱼加工中优势乳酸菌的分离与鉴定[J]. 食品工业科技, 2007, 28(1): 115-116; 119.
[3]SANNI A I, ASIEDU M, AYERNOR G S. Microflora and chemical composition of Momoni, a Ghanaian fermented fish condiment[J]. Journal of Food Composition and Analysis, 2002, 15(5): 577-583.
[4]CHOWDHURY B R, CHAKRABORTY R, CHAUDHURI U R. Validity of modified Gompertz and Logistic models in predicting cell growth of Pediococcus acidilactici H during the production of bacteriocin pediocin AcH[J]. Journal of Food Engineering, 2007, 80(4): 1171-1175.
[5]CAYRE M E, VIGNOLOB G, GARRO O. Modeling lactic acid bacteria growth in vacuum-packaged cooked meat emulsions stored at three temperatures[J]. Food Microbiology, 2003, 50(5): 561-566.
[6]SLONGO A P, ROSENTHAL A, CAMARGO L M Q, et al. Modeling the growth of lactic acid bacteria in sliced ham processed by high hydrostatic pressure[J]. LWT-Food Science and Technology, 2009, 42 (1): 303-306.
[7]吴祖兴, 张华. 发酵肉制品乳酸菌菌种筛选研究[J]. 食品科学, 2002, 23(9): 47-49.
[8]谢静, 熊善柏, 曾令彬, 等. 腊鱼加工中的乳酸菌及其特性[J]. 食品与发酵工业, 2009, 35(6): 32-36.
[9]牛天贵. 食品微生物学实验技术[M]. 北京: 中国农业大学出版社, 2002.
[10]曾令彬. 腊鱼加工中微生物菌群、理化特性及挥发性成分的研究[D]. 武汉: 华中农业大学, 2008.
[11]CHIU Y S, ZAJIC J E. Gompertz,s law on the growth of mycelial pellets [J]. Biotechnology and Bioengineering, 1976, 18(8): 1167-1170.
[12]赵思明. 食品科学与工程中的计算机应用[M]. 北京: 化学工业出版社, 2005.
[13]KATARZYNA K, DANUTA K K. Construction of predictive models of growth of microorganisms in salted and cured meat products[J]. Innovative Food Science and Emerging Technologies, 2006, 7(1/2): 152-159.
[14]WACHENHEIM D E, PATTERSON J A, LADISCH M R. Analysis of the logistic function model: derivation and applications specific to batch cultured microorganisms[J]. Bioresource Technology, 2003, 86(2): 157-164.
[15]FRANCESCA V, PALMRIA D B, STELLA L L, et al. Use of Lactobacillus plantarum fermentation products in bread-making to prevent Bacillus subtilis ropy spoilage[J]. International Journal of Food Microbiology, 2008, 122(3): 328-332.
Growth and Acid-Producing Properties of Lactic Acid Bacteria Isolated from Cured Fish
XIE Jing,XIONG Shan-bai,ZENG Ling-bin,ZHAO Si-ming*
(Aquatic Product Engineering and Technology Research Center of Hubei Province, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Gompertz model was applied to fit the curves of growth and pH of five lactic acid bacterial strains isolated from cured fish with the purpose of analyzing the growth and acid-producing properties of lactic acid bacteria. The results indicated that Gompertz model could fit the growth and pH curves with high accuracy. Five lactic acid bacterial strains presented similar adaptability in the lag phase. The growth rates and acid productivities of Pediococcus acidilactici and Lactobacillus alimentarius were much higher than those of other strains. Meanwhile, both strains revealed the highest balanced total bacterial count and lowest balanced pH. Moreover, a significant correlation between the pH of the culture medium and total lactic acid bacteria count was observed.
lactic acid bacteria;Gompertz model;growth curve;acid-producing curve
TS254.4
A
1002-6630(2012)11-0147-04
2011-06-13
国家现代农业产业技术体系建设专项(CARS-46-23)
谢静(1987—),女,硕士研究生,主要从事食品工艺研究。E-mail:student921129@163.com
*通信作者:赵思明(1963—),女,教授,博士,主要从事水产品加工与贮藏、食品大分子结构及功能特性研究。E-mail:zsmjx@mail.hzau.edu.cn
