2型糖尿病猕猴部分消化器官组织中瘦素的表达
2012-05-31万红平付通超刘文涛陈正礼
万红平,付通超,刘文涛,陈正礼
(四川农业大学动物医学院,四川雅安 625014)
糖尿病(diabetes mellitus,DM)分为1型糖尿病、2型糖尿病和妊娠糖尿病,其中2型糖尿病主要是由于胰岛素抵抗或胰岛素分泌缺陷引起的[1]。肥胖是引发2型糖尿病的重要因素,体脂堆积可引起胰岛素抵抗,高胰岛素血症,肌肉及其他组织对葡萄糖的利用率降低,并进一步发展为糖尿病[2]。对肥胖的研究发现了瘦素(Leptin)[3],瘦素是一种由肥胖基因编码的分子质量为16ku的多肽激素,主要产生于脂肪组织,在机体摄食、能量代谢平衡和免疫方面具有重要调节作用[4-5]。瘦素具有广泛的生物效应,研究表明,瘦素能与胰岛素共同作用调节中枢神经系统,引起食欲下降、能量消耗增加[6]。
因此,猜测瘦素可能与糖尿病存在一定的关系。本研究意在用免疫组织化学的方法,检测瘦素在2型糖尿病猕猴消化器官组织中的表达,探究瘦素与猕猴2型糖尿病发生发展的关系。另外,本研究以与人类近亲的猕猴作为研究对象使试验数据更具有参考价值,为探讨瘦素在2型糖尿病患者机体中的作用积累资料。
1 材料与方法
1.1 材料
1.1.1 试验用动物 3只患2型糖尿病的成年猕猴川西亚种,3只健康成年猕猴川西亚种,由四川农业大学实验动物工程技术中心、国家实验用猕猴种源基地提供。
1.1.2 主要试剂及仪器 一抗:兔抗山羊Leptin多克隆抗体,稀释比例为1∶200;二抗:生物素标记山羊抗兔SABC免疫组化试剂盒(均购自北京博奥森生物技术有限公司);10%福尔马林、各浓度梯度酒精、二甲苯、石蜡和 PBS(pH 7.4);LEICA RM2315切片机,Nikon50i2BF荧光生物数码显微镜。
1.2 方法
1.2.1 石蜡切片制作 对2组猕猴进行解剖,取出所需胰腺、肝脏、胃和肠道组织,将组织适当修整,投入固定液福尔马林液中进行固定。固定后,将所取组织流水冲洗数小时到24h,以去除多余固定液。组织块经酒精脱水、二甲苯透明后,石蜡包埋、切片。
1.2.2 免疫组织化学染色 切片脱蜡后,按照SABC免疫组织化学染色试剂盒及DAB显色试剂盒说明书进行免疫组织化学染色。一抗为兔抗山羊leptin多克隆抗体,稀释比例为1∶200;二抗为生物素标记山羊抗兔SABC免疫组化试剂盒。显色后蒸馏水洗涤,常规脱水,透明并封片,镜检并拍照。
1.2.3 对照试验 用PBS代替一抗作为阴性对照,以脂肪组织作为阳性对照。
1.2.4 结果判断 瘦素阳性结果:细胞结构清晰,棕黄色颗粒定位良好,染色明显高于背景,细胞核或细胞浆内呈现棕黄色颗粒为阳性;阴性对照组应为背景色浅或无色,无明显棕黄色颗粒。
1.2.5 光密度值测定及统计学分析 对切片进行观察,并于100倍、200倍和400倍镜下拍照若干张,每种组织于相同倍数下随机抽取3张,用捷达801形态学图像分析系统软件进行光密度值测量。用SPSS13.0生物统计学软件分析数据。计量资料以平均值±标准差表示,两组间比较用t检验。P<0.01或P<0.05均为差异有统计学意义。
2 结果
2.1 免疫组化染色
2型糖尿病猕猴的胃体部固有层的壁细胞黏膜层增厚,黏膜上皮表层呈棕黄色阳性反应;胰腺的胰岛可见大小不等的棕黄色颗粒;肝星型细胞中可见环状分布的棕黄色颗粒,呈Leptin免疫阳性反应;肠道以结肠和空肠于固有层的柱状细胞及黏膜上皮细胞表层阳性反应最为明显,其他肠段阳性细胞相对分布少且阳性较弱,2型糖尿病猕猴组织阳性表达相对于对照组明显(图1~图5)。

图1 2型糖尿病猕猴结肠中黏膜上皮表层可见棕黄色层,呈Leptin免疫阳性反应,SABC染色(400×)Fig.1 Tan layer in colon submucosa of Macaca mulatta with type 2 diabetes shows leptin positive immunoreactivity,SABC(400×)
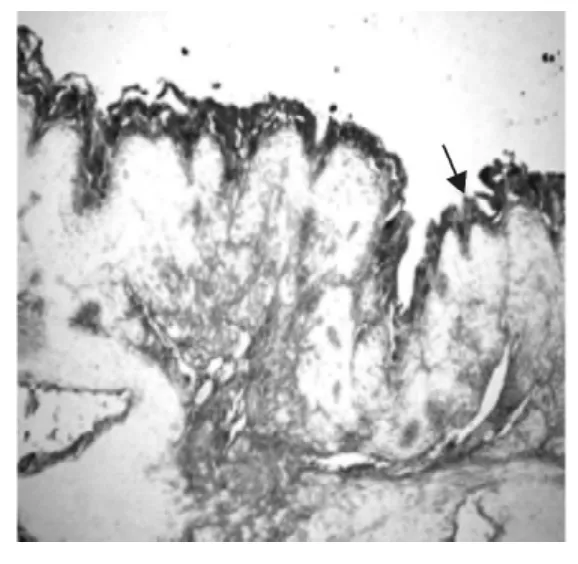
图3 2型糖尿病猕猴的胃壁细胞黏膜层增厚,呈Leptin免疫阳性反应,SABC染色(100×)Fig.3 The incrassation of mucosa in parietal cell of Macaca mulatta with type 2diabetes shows leptin positive immunoreactivity,SABC(100×)
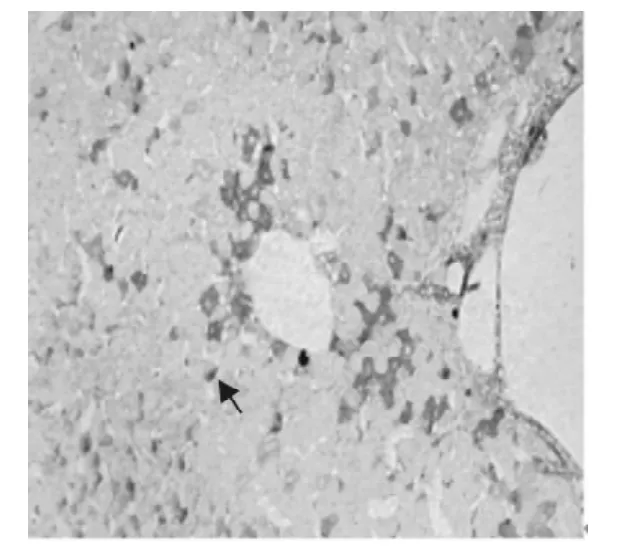
图5 2型糖尿病猕猴的肝脏可见环状分布的棕黄色颗粒,SABC染色 (200×)Fig.5 Circular distribution of tan particles in liver of Macaca mulatta with type 2shows leptin positive immunoreactivity,SABC(200×)
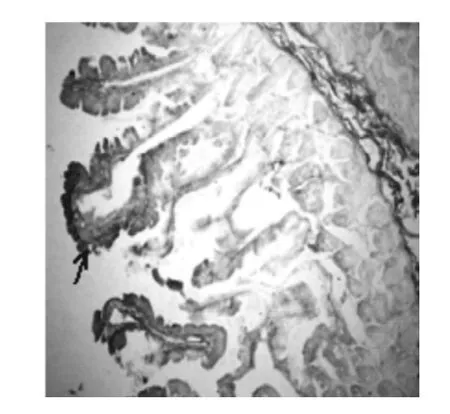
图2 2型糖尿病猕猴的空肠绒毛上皮呈Leptin免疫阳性反应,SABC染色 (100×)Fig.2 The chorioepithelium of jejunum of Macaca mulatta shows leptin positive immunoreactivity,SABC(100×)

图4 2型糖尿病猕猴的胰腺可见棕黄色颗粒,呈Leptin免疫阳性反应,SABC染色(100×)Fig.4 Tan particles in pancreas of Macaca mulatta with type 2 diabetes shows leptin positive immunoreactivity,SABC(100×)
2.2 糖尿病猕猴组织与健康猕猴组织平均吸光度值统计结果
糖尿病猕猴组织与健康猕猴组织平均吸光度值统计结果见表1。表1显示,与对照组相比,2型糖尿病猕猴组织瘦素水平在胰腺、肝脏、胃、空肠、结肠差异极显著 (P<0.01);十二指肠、回肠、盲肠差异显著(P<0.05)。
3 讨论
近年来,基于瘦素在机体摄食、血糖和脂类代谢、肥胖发生等方面的重要调节作用,使人们对糖尿病和肥胖症有了新的认识。而2型糖尿病的主要病理生理基础是胰岛素抵抗(Insulin resistance,IR),IR是指胰岛素作用的靶器官,如肝脏、肌肉组织等对一定量的胰岛素的生物学反应低于正常水平[7-8]。瘦素与胰岛素抵抗关系密切,在胰岛素抵抗中起一定作用[9]。目前有研究表明,位于下丘脑的瘦素受体与瘦素结合后,使下丘脑弓状核分泌神经肽Y减少,从而降低胰岛素水平,并减少摄食,增加能量消耗,改善胰岛素抵抗;而位于胰岛B细胞上的瘦素受体与瘦素结合后,则能抑制葡萄糖刺激的胰岛素分泌,对糖耐量异常和糖尿病病人的血胰岛素水平、血糖均有一定影响[10-11]。本研究中,2型糖尿病猕猴消化系统组织中瘦素表达水平明显高于对照组,且与对照组相比,胰腺、肝脏、胃、空肠和结肠表现为差异极显著;十二指肠、回肠和盲肠表现为差异显著。说明2型糖尿病猕猴体内存在较高的瘦素表达,且不同组织表达量存在差异性。瘦素的表达与猕猴2型糖尿病的发生和发展有明显的相关性,进一步说明了瘦素的分泌是2型糖尿病的重要表征之一,提示瘦素的研究可能为2型糖尿病的进一步研究及治疗提供新的思路。
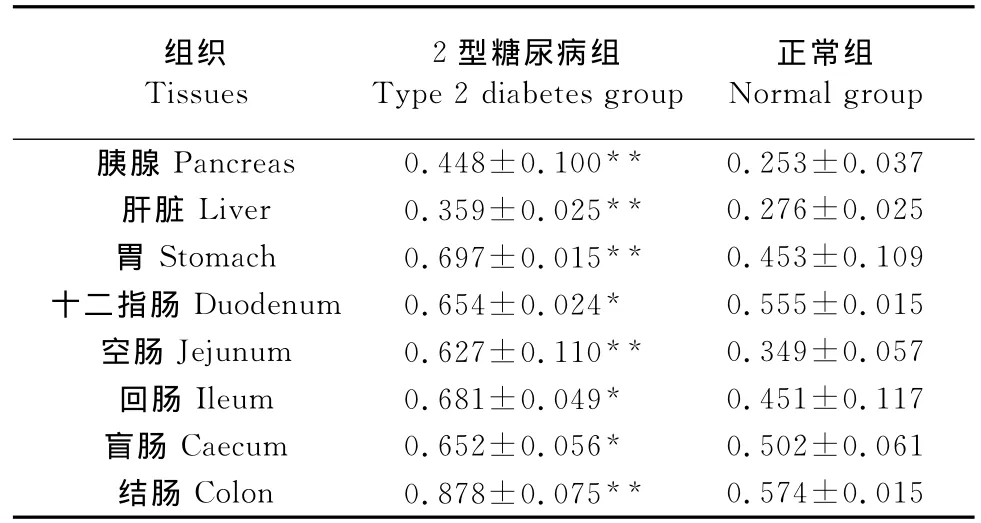
表1 病变组与对照组平均吸光度值统计结果Table 1 Testing results of average optical densities between type 2diabetes mellitus group and normal group
[1]何秀丽.糖尿病分类及综合治疗控制方法研究[J].健康必读,2011(8):417.
[2]王晓健.肥胖与糖尿病的关系及发病机制的研究进展[J].中国疗养医学,2011,20(8):723-725.
[3]Tina A D,Sharon H C,Hyun-Seuk M,et al.Leptin in human physiology and therapeutics[J].Front Neuroendocrinol,2010,31:377-393.
[4]Rayah S B,Khawla A K,Isam N A.Fasting glucose to leptin ratio as a new diagnostic marker in patients with diabetes mellitus[J].Oman Medical J,2010,25(4):269-274.
[5]Farooqi I S,O’Rahilly S.Leptin:apivotal regulator of human energy homeostasis[J].Am J Clin Nutr,2009,89(3):980S-984S.
[6]Katsiki N,Dimitri P M,Anna G P,et al.Effects of improving glycemic control with insulin on leptin,adiponectin,ghrelin and neuropeptidey levels in patients with type 2diabetes mellitus:apilot study[J].Open Cardiovas Med J,2011,5:136-147.
[7]Meshkani R,Adeli K.Hepatic insulin resistance,metabolic syndrome and cardiovascular disease[J].Clin Biochem,2009,42:1331-1346.
[8]张国成,王继萍,王叶宝,等.高血压伴胰岛素抵抗与动脉粥样硬化相关性研究[J].中国实验诊断学,2011,15(6):1025-1027.
[9]王 彦,杨 静,阴津华.初发2型糖尿病患者血脂联素和瘦素与胰岛素抵抗的关系[J].中西医结合心脑血管病杂志,2009,7(7):838-839.
[10]Ken E,Yoshihiro O,Hiroaki M,et al.Transgenic overexpression of leptin rescues insulin resistance and diabetes in a mouse model of lipoatrophic diabetes[J].Diabetes,2001,50:1440-1448.
[11]赵荷珺,李 兴.瘦素与胰岛素抵抗的研究进展[J].医学综述,2010,16(11):1684-1687.
