烟草疫霉生防细菌的筛选及鉴定
2012-05-25舒晓玲吴毅歆周惠萍毛自朝李顺德何月秋
舒晓玲,吴毅歆,周惠萍,毛自朝,李顺德,何月秋,*
(1.云南农业大学农业生物多样性应用技术国家工程中心,昆明 650201;2.云南农业大学农学与生物技术学院,昆明 650201;3.玉溪市农业局,云南 玉溪 663000)
烟草黑胫病是由烟草疫霉(Phytophthora parasitica var.nicotianae)引起的,是烟草生产中一类毁灭性真菌病害[1]。烟草黑胫病从苗床期到大田生长期均能发生,主要为害移栽后的大田烟株,造成植株茎基部呈水渍状黑斑,后向上下及髓部扩展,直至植株萎蔫死亡。在防治上,主要采用种植抗病品种与化学药剂等。然而,随着绿色环保农业概念的推广,应用对生态友好、防治效果稳定的生物制剂逐渐被人们所接受。植物根围促生长细菌是生存在植物根围中,对植物生长有促进或对病原菌有拮抗作用的有益细菌的统称。近年来,许多研究表明,植物根围促生长细菌在促进植物生长和防治植物病害方面有着其他微生物不具有的优势。云南是烟草生产大省,黑胫病已成为烟草生产的重要限制因子。本研究于 2009—2010年在云南农业大学农业生物多样性应用技术国家工程中心进行,旨在云南的烟田土壤条件下,筛选出适于环境,对烟草黑胫病具有防治潜力的芽孢杆菌,为防治该病提供生防菌株基础。
1 材料与方法
1.1 土壤中细菌的分离
采用平皿稀释法分离,从昆明市嵩明县羊桥乡和陆良县马街乡烟田土壤中分离芽孢杆菌。将土壤稀释成悬液,在70 ℃的水浴锅中保温10 min,以便杀死不耐高温的真菌、细菌、放线菌及其他土壤生物。将处理过的土壤悬液涂布于固体平板培养基上,32 ℃的温箱中培养24 h,挑取单个菌落,进一步划线培养观察菌落性状并保存[2]。分离和抑菌作用采用 PDA培养基;性状观察用 NA、PDA、V8固体培养基;生长速度测定用LB液体培养基。
1.2 生防细菌的初步筛选
将分离得到的菌株划线活化,挑取单菌落和烟草疫霉接种到同一个培养皿中进行对峙培养。两者间隔2 cm,每个菌株设3个重复,3 d后观察抑菌效果,以筛选具有明显抑菌带的生防菌株。
1.3 生防菌株B40-3抑菌作用的测定
将在 PSA平板生长好的烟草疫霉病菌用打孔器制成直径6 mm的菌饼,接种于PSA平板中央,用接种环粘取菌株B40-3的单菌落在菌饼两旁,距离菌饼2 cm左右划两道平行线。27 ℃培养3~4 d,测量抑菌带的宽度[3]。
将保存的菌种在NA培养基上划线活化。32 ℃培养24 h,待单菌落长出后,挑取单菌落放入LB液体培养基,在32 ℃,210 rpm条件下培养24 h,得到发酵液。制备烟草黑胫病病原菌的孢子悬浮液[4-5],按陈方新等[6]的方法,将孢子悬浮液调至合适浓度,混入融化好并冷却到40 ℃左右的PDA培养基中。将培养基倒入培养皿,制成带菌平板。待培养基凝固后,在培养皿中间放入牛津杯。在牛津杯中加入生防菌发酵液200 µL。27 ℃培养3~4 d,测量抑菌圈的大小。
1.4 生防菌株B40-3的抑菌谱测定
选择实验室保存和田间为害较严重的 13种病原真菌测定B40-3的抑菌谱。病原真菌包括:烟草疫霉(Phytophthora parasitica var.nicotianae)、玉米小斑病菌(Bipolaris maydis)、玉米弯孢霉病菌(Curvularia lunata)、康乃馨枯萎病菌(Fusarium oxysporum f.sp.dianthi)、蚕豆黑斑病菌(Alternaria sp.)、辣椒炭疽菌(Colletotrichum capsici)、棉花红腐病菌(F.moniliforme)、小麦雪腐病菌(Typhula incarnate)、尖孢镰刀菌(F.oxysporum)、禾谷镰刀菌(F.graminearum)、水杉赤枯病菌(Pestalotia foedans)、番茄灰霉病菌(Botrytis cinerea)和烟草赤星病菌(A.alternate)。
1.5 生防细菌B40-3最佳生长条件的测定
将OD600为1.2的细菌发酵液分别按照1%的接种量接种在LB液体培养基中。在25、28、30、32、34、37、40、42 ℃,200 rpm条件下振荡培养24 h;37 ℃,120、150、170、190、210 rpm 条件下振荡培养24 h;在37 ℃,210 rpm条件下振荡培养 1、2、3、4、8、16、24、32、40、48、56、64 h时;测定OD600,以明确B40-3的最适生长温度,摇床转速的影响及生长曲线。各处理均重复3次。
1.6 生防细菌B40-3的初步鉴定
将B40-3接种在PSA、PDA、NA、LB等不同培养基上,观察菌株在这几种培养基上的生长情况。参照文献[7],将培养24 h的B40-3进行革兰氏染色、芽孢染色,观察细胞大小、形态、有无芽孢产生、芽孢产生位置等鉴定。
2 结 果
2.1 细菌的分离和初步筛选
从来自烟田的 70余份土样中,得到表观菌落形态不同的分离物200多个,筛选出对烟草黑胫病具有抑制作用的细菌1个,编号为B40-3。对峙培养3 d,抑菌带宽度为0.9 cm(图1)。牛津杯法进一步测定,抑菌圈直径为2.3 cm(图2)。

图1 B40-3与烟草疫霉的对峙培养Fig.1 Dual culture of B40-3 and Phytophthora parasitica var.nicotianae

图2 B40-3对疫霉孢子萌发的抑制Fig.2 Inhibiting spore germination of Phytophthora parasitica var.nicotianae by B40-3
2.2 生防细菌B40-3的抑菌谱
将B40-3菌株与病原真菌对峙培养于PSA平板上,结果表明,该菌株对 13个病原真菌菌株均有很好的抑制作用(表1),且对于不同的病菌抑制效果存在差异。抑制玉米弯孢霉病菌的作用最强,培养3 d后,抑菌带达1.0 cm,抑制烟草赤星病的作用最弱,抑菌带仅有0.3 cm。方差分析结果显示,菌株B40-3对康乃馨枯萎病菌、玉米弯孢霉病菌、烟草疫霉病菌、玉米小斑病菌的抑制效果与对其他9种病菌相比,达到差异显著水平。
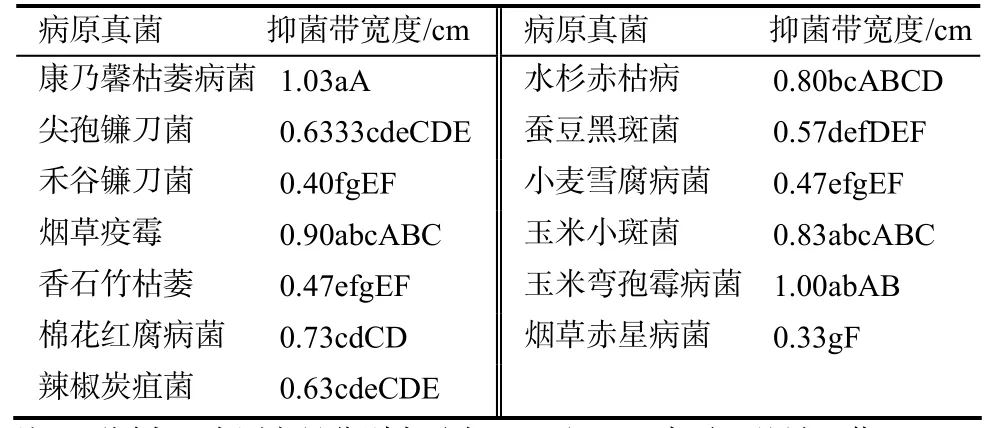
表1 B40-3对13种病原真菌的抑菌作用Table1 Inhibition of B40-3 to 13 plant pathogenic fungi
2.3 生防菌株B40-3最佳生长条件
将B40-3菌株培养液调节至OD600为1.2,按照1%接种量接种至LB液体培养基中,所测定的结果如图3~5。
2.3.1 最佳生长温度 B40-3培养液的OD600与培养温度成正比。在25~42 ℃,随温度的上升,生长速度加快。30 ℃以下,生长较为缓慢,30 ℃以上,生长速度较快。40 ℃和42 ℃时,测量的OD值高于37 ℃的OD值,表明该菌株能在37 ℃以上的温度生长(图3)。但在40 ℃和42 ℃时,培养液中已经有明显的沉淀出现,可能是菌体密度太大导致相互粘附,不易准确测定,故在以后的试验中将37 ℃作为培养温度。
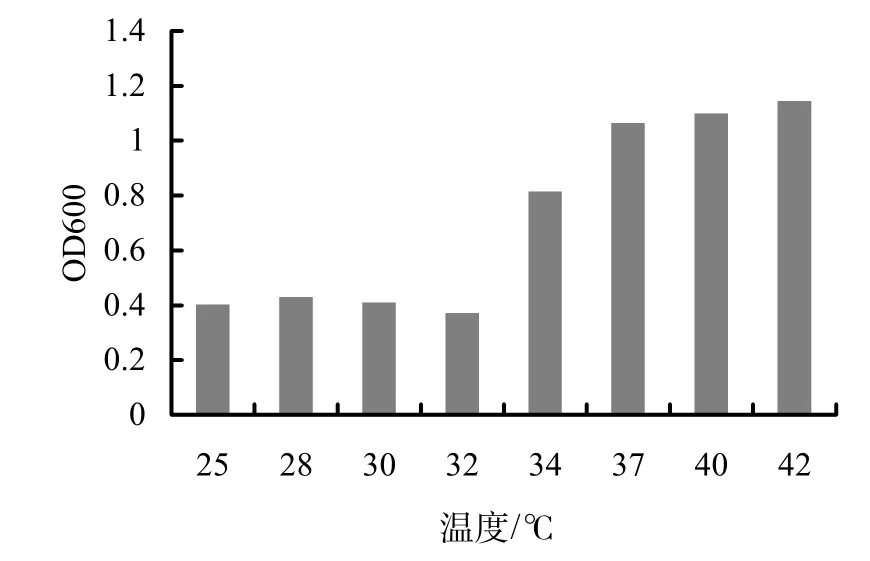
图3 不同温度对B40-3生长的影响Fig.3 Effect of temperatures on B40-3 growth
2.3.2 最佳摇床转速 B40-3在37 ℃条件下,培养24 h时,于摇床转速在120~210 rpm时,随着摇床转速的提高OD600值增大,达1.42(图4),说明B40-3在生长过程中需要较多的通气量。
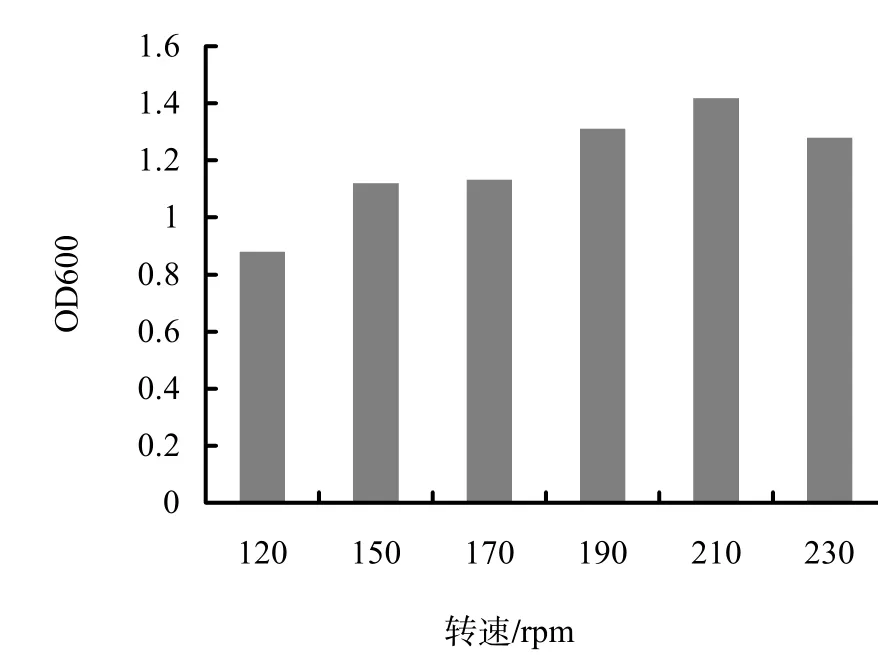
图4 不同转速对B40-3生长的影响Fig.4 Effect of rotations on B40-3 growth
2.3.3 最佳培养时间 B40-3在37 ℃,摇床转速为210 rpm条件下,培养2 h后进入指数生长阶段,培养40 h后,菌量增长变得缓慢(图5),且有大量芽孢形成,进入到停滞生长期。
2.4 初步鉴定结果
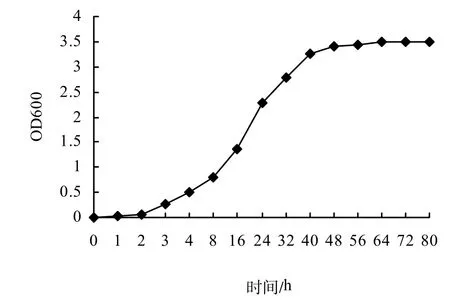
图5 不同培养时间B40-3的生长曲线Fig.5 Growth curve of B40-3 with time
菌株B40-3在PSA培养基上形成的单菌落为圆形,乳白色至淡黄色,表面光滑,垫状突起,菌落直径3~4 mm,边缘光滑。在PDA上形成的菌落和PSA无明显差异。在NA培养基上,单菌落为圆形,淡黄至黄色,表面光滑,不突起,无褶皱,菌落直径为1~2 mm,边缘丝状。在LB培养基上形成的单菌落为圆形,淡黄至黄色,表面光滑,不突起,无褶皱,菌落直径为2~3 mm,边缘丝状。革兰氏染色阳性,产芽孢,芽孢圆形、位于细胞中部或近端部。其生理生化反应与对照菌株枯草芽孢杆菌B.subtilis B168基本相似,依据形态特征及生理生化反应(表 2),初步将 B40-3鉴定为 Bacillus subtilis。
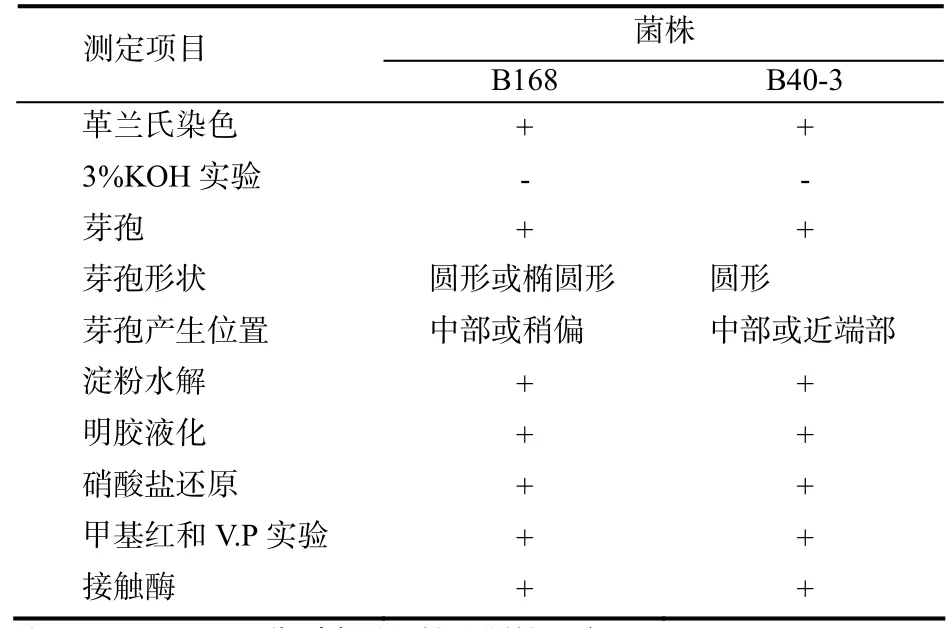
表2 B40-3的染色和部分生理生化实验结果Table2 The result of physiological and biochemical tests
3 讨 论
烟草黑胫病是烟草生产中的重要病害,目前在防治方法上主要有种植抗病品种、轮作、推广高垄栽培与药剂防治等,生物防治主要在实验室和温室中进行,尚缺乏与化学农药相当且很稳定的生物防治制剂。在生物防治上,研究较多的有木霉属真菌(Trichoderma)[8]、双核丝核菌(Rhizoctonia)[9]、内生芽孢杆菌[10]、假单胞菌属(Pseudomonas)[11-12],肠杆菌属(Enterobacter)、土壤杆菌属(Agrobacterium)和芽孢杆菌(Bacillus)[12-13]。
依据生态平衡原理分离有拮抗微生物菌株是一种常用策略,杨树军[14]从云南省9个地州29个县的烟田中采集了141个土样,以土壤稀释平板法进行微生物分离和平板对峙培养法进行筛选,分离筛选出280个对黑胫病菌有拮抗作用的菌株,其中抑菌半径大于17 mm的拮抗菌有19株。我们分离了200多个菌株,但仅分离到1株具有抑制黑胫病菌的枯草芽孢杆菌 B40-3,分离效率低于杨树军报道的研究结果。然而,本研究采用先在 70 ℃水中预处理土壤水溶液,杀死不能耐热的菌株,仅留下产生芽孢的细菌;在杨树军的报道中未鉴定各个菌株的归属,也未说明它们是芽孢菌。王丽珍等[15]从重庆市烟草根围土壤中采集 85份土样,分离了26株对黑胫病菌有明显抑制作用,其中24株为荧光假单胞杆菌(Pseudomonas fluorescens),2株芽孢菌(Bacillus)。芽孢杆菌已在植物病害生物防治中起重要作用,但对黑胫病菌有抑制作用并用于黑胫病防治的菌株报道很少。
本研究依据芽孢杆菌有很好的抗逆性和易于生产加工及商品化,分离出了枯草芽孢杆菌B40-3,并证明该菌株对 13种植物病原真菌也有很好的抑制作用。然而,该菌株对烟草黑胫病的防治效果还有待田间试验的进一步证实。
[1]郭普.植保大典[M].北京:中国三峡出版社,2006:216-217.
[2]方中达.植病研究方法[M].北京:中国农业出版社,1998:179-180.
[3]鲁素云.植物病害生物防治学[M].北京:北京农业大学出版社,1993:247-248.
[4]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:93.
[5]杨建卿,江彤,陈学平.烟草疫霉菌的培养及大量产生游动孢子囊和游动孢子方法的研究[J].植物保护,2001,27(4):12-14.
[6]陈方新,齐永霞,高智谋,等.诱导疫霉菌产生游动孢子囊液体培养基的研制[J].植物保护,2005,31(2):34-37.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-377.
[8]李梅云,谭丽华,方敦煌,等.哈茨木霉的培养及其对烟草疫霉生长的抑制研究[J].微生物学通报,2006,33(6):79-83.
[9]Cartwright D K.Biological control of Phytophthora parasitica var.nicotianae on tobacco seedlings with non-pathogenic binucleate Rhizoctonia fungi[J].Soil Biology and Biochemistry,1998,30(4):1879-1884.
[10]王万能,全学军,肖崇刚.烟草内生细菌防治烟草黑胫病及促生作用研究[J].植物学通报,2005,22(4):426-431.
[11]王远山,王平,胡正嘉.绿针假单胞茵PL9菌株对烟草疫霉的拮抗作用研究[J].华中农业大学学报,2002,21(3):248-251.
[12]方敦煌,顾金刚,李江涛,等.烟草黑胫病菌的拈抗根际细菌的筛选[J].云南农业大学学报,2001(2):93-95,98.
[13]方敦煌,李梅云,李天飞.烟草猝倒病生防根际细菌的分离与筛选[J].西南农业大学学报,2001(3):242-246.
[14]杨树军.烟草黑胫病生防菌筛选及防效初探[J].中国农学通报,2009,25(2):222-225.
[15]王丽珍,肖崇刚.重庆烟草主要病害土壤拮抗细菌的筛选[J].烟草科技,2008(4):60-64.
