油菜种子特异启动子Napin控制外源EGFP基因在芥菜中的表达
2012-05-22唐佳佳宋洪元
邹 敏 唐佳佳 宋洪元
(南方山地园艺学教育部重点实验室,重庆市蔬菜学重点实验室,西南大学园艺园林学院,重庆 400715)
Napin蛋白是芸薹属植物中广泛存在的一类由多基因编码的种子贮藏蛋白,为种子发芽和幼苗生长提供氮源,在ABA的影响下,以组织特异性的方式表达形成(熊兴华 等,2003)。利用油菜种子特异启动子 Napin将目的基因集中在种子中表达,可实现目的基因在转基因植株中的定时、定点调控,减少在其他组织中表达造成的能量浪费,并可避免在植株整体表达时可能带来的生理代谢活动紊乱。目前,已从多个油菜品种中克隆了Napin启动子(李丽 等,2001;刘建民 等,2008),并将其用于油料种子中脂肪酸的改良。Tan等(2011)利用Napin A启动子介导BnLEC1和BnL1L基因在油菜籽中特异表达,使种子含油量从2%提升到20%。也有报道称,由Napin启动子驱动抗毒素基因在油菜籽中表达可以提高植株自身抵御病虫害的能力(Husken et al.,2005)。除十字花科外,Napin启动子控制外源基因的表达在烟草中也表现出了种子特异性(肖娜 等,2008;Swarnalatha et al.,2010)。
芥菜〔Brassica juncea(L.)Czern.et Coss.〕为芸薹属一年生或两年生草本植物,是我国著名的特产蔬菜,通过种子繁殖。因此,获得高质量的种子对芥菜种子发芽、幼苗生长及增强植株抗病抗逆性等均有重要意义。本试验对油菜种子特异启动子 Napin控制外源基因在芥菜中的表达特性进行研究,以增强型绿色荧光蛋白(EGFP)基因作为报告基因,将其置于来自油菜的Napin启动子的调控之下,通过根癌农杆菌介导法转入芥菜,分析其在转基因植株种子及 T1代幼苗中的表达情况,以期为今后芥菜种子质量的改良提供参考。
1 材料与方法
1.1 材料
供试材料为渝丰榨菜种子,购于重庆市三千种业有限公司。含有植物表达载体pCANapEGFP质粒(图1)的根癌农杆菌EHA105由南方山地园艺学教育部重点实验室构建及保存;Taq DNA聚合酶、DNA marker等购自北京全式金生物工程有限公司;抗生素卡那霉素(Kan)、链霉素(Str)、羧苄青霉素(Carb)等购自上海生工生物工程技术服务有限公司;除草剂 Basta(有效成分为PPT,草丁膦)购于日本化学工业株式会社;NAA、6-BA、乙醇、0.1%升汞等为国产试剂。

图1 pCANapEGFP表达载体示意图
1.2 方法
1.2.1 芥菜转化 PPT筛选浓度确定 芥菜无菌苗的获得参照曹必好等(2003)的方法进行,切取苗龄7 d的渝丰榨菜子叶和下胚轴,分别在MS+2 mg·L-16-BA+0.2 mg·L-1NAA+3%蔗糖+0.6%琼脂的分化培养基中预培养(子叶预培养2 d,下胚轴预培养14 d至始分化),然后转至分别添加0、2、4、6、8 mg·L-1PPT的分化培养基中,3次重复,每次重复15个子叶或下胚轴,14 d后统计各浓度PPT下芥菜子叶及下胚轴的成活率,确定PPT筛选的最佳浓度。
1.2.2 根癌农杆菌介导的芥菜转化 参照曹必好等(2003)的方法进行并作了适当修改:以苗龄7 d的渝丰榨菜下胚轴作为农杆菌介导转化的外植体,以MS+2 mg·L-16-BA+0.2 mg·L-1NAA+3%蔗糖+0.6%琼脂为分化培养基,预培养和共培养各2 d,农杆菌浓度OD600为0.5~0.6,浸菌10 min。筛选培养基为MS+2 mg·L-16-BA+0.2 mg·L-1NAA+8 mg·L-1PPT+400 mg·L-1Carb+3%蔗糖+0.6%琼脂;生根培养基为MS+0.2 mg·L-1NAA+8 mg·L-1PPT+400 mg·L-1Carb+3%蔗糖+ 0.6%琼脂。
1.2.3 转基因芥菜植株总 DNA的提取及 PCR鉴定 转基因芥菜叶片总DNA的提取参照王关林和方宏筠(2002)的 CTAB法。PCR扩增用Napin启动子的上游引物和EGFP报告基因的下游引物,Nap-F:5'-CAAGCTTCTCTCATC CCCTTTTAAACCAAC-3';pGFP-2:5'-TTAC TTGTACAGCTCG TCCATGCCG-3'。扩增条件为:94 ℃预变性 5 min;94 ℃变性 40 s,56 ℃退火 40 s,72 ℃延伸 1 min 40 s,循环 30 次;72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳进行检测。
1.2.4 转基因芥菜中EGFP的表达检测 分别取转基因植株开花后15、25、35 d和完熟的种子(图2)做徒手切片,在荧光显微镜(LEICA CTR5000)下分别观察种皮、子叶和胚根3个部位,进行EGFP的表达检测;转基因T1代种子萌芽过程中,分别取根、下胚轴和子叶进行荧光表达检测。

图2 不同发育阶段的转基因芥菜种荚
2 结果与分析
2.1 PPT浓度对芥菜离体子叶及下胚轴生长的影响
除草剂Basta对植株再生有很强的抑制作用,在基因转化过程中获得抗性芽的关键是使用合适的筛选压:除草剂浓度过高,对转化细胞造成强烈的毒害作用,致使大量外植体在筛选培养基上很快死亡;浓度太低,对抗性芽不能进行严格筛选,会产生假抗性芽和大量嵌合体(杨广东 等,2002;李鹏 等,2008)。从表1可以看出,PPT对芥菜离体子叶及下胚轴的分化均有抑制作用,PPT浓度为2 mg·L-1的分化培养基中子叶的成活率仅64.4%,下胚轴的成活率为37.8%;随着PPT浓度的升高,子叶和下胚轴的成活率均急剧下降,在PPT浓度为8 mg·L-1时子叶和下胚轴全部死亡。因此,在筛选培养基中添加浓度为8 mg·L-1的PPT可对转基因芽体进行有效筛选。

表1 PPT浓度对芥菜离体子叶和下胚轴生长的影响
2.2 转基因芥菜植株的获得及PCR检测
农杆菌介导转化芥菜下胚轴,经多次继代培养,筛选出抗性芽(图 3-a),将其切下置于生根培养基上生根(图 3-b),以获得抗性植株。对所获得的4株抗性植株幼叶提取总基因组 DNA,并用 Nap-F和 pGFP-2引物扩增Napin启动子和EGFP报告基因区域,结果均扩增出预期 1.1 kb大小的片段(图 4),证明所得抗性植株均为转基因植株。

图3 农杆菌介导转化芥菜下胚轴的植株再生过程
2.3 Napin-EGFP融合基因在转基因芥菜中的表达特性
2.3.1 转基因植株种子的荧光检测 在开花后15 d的芥菜种子种皮中不能检测到绿色荧光(图 5-a),而胚根和子叶中已能检测到绿色荧光(图 5-e、i),且以胚根根尖的绿色荧光最强(图 5-e)。随着种子发育,在开花后25 d的种子种皮中能检测出明显的绿色荧光(图5-b),随着种子继续发育,种皮、胚根和子叶中的绿色荧光均逐渐增强(图 5-c、d、f、g、h、j、k、l),至种子完熟时,各部位绿色荧光最强(图 5-d、h、l)。由此可见,Napin控制外源 EGFP基因在种皮、子叶、胚根中均有表达,且从种子发育的某个时期开始直到种子完熟,但在种皮中的表达滞后于在子叶和胚根中的表达。
2.3.2 转基因 T1代种子萌发过程中各部位的荧光检测 种子萌动时,芥菜胚根和子叶均能检测到强的绿色荧光(图6-a、b);约1 d后,子叶展开,在幼苗下胚轴和根中仍能检测到绿色荧光,但下胚轴的荧光强度强于根中的荧光强度(图6-c、d);至幼苗子叶转绿(约2 d),已检测不出下胚轴中的绿色荧光(图6-e);随着幼苗生长至1片真叶期(约14 d),根中的绿色荧光也消失(图6-f)。由此可见,在种子萌发过程中EGFP基因的表达量没有增加,即Napin启动子在该阶段并没有启动下游基因的表达。
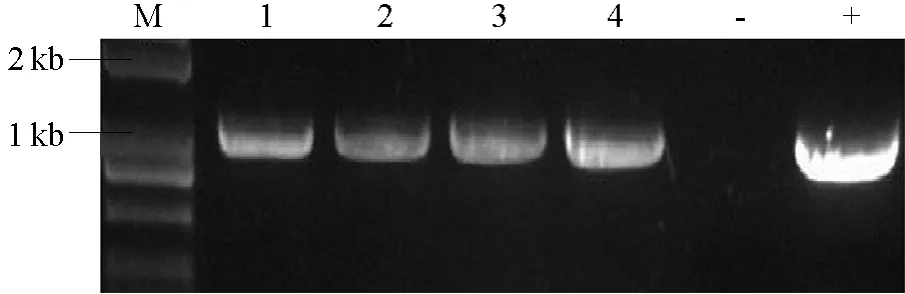
图4 转基因芥菜中Napin启动子的鉴定

图5 转基因芥菜种子各部位的EGFP表达情况

图6 转基因T1代种子萌动至幼苗1片真叶期EGFP表达情况
3 结论与讨论
本试验将从油菜中克隆的种子特异启动子 Napin与报告基因(增强型绿色荧光蛋白基因,EGFP)融合,通过根癌农杆菌介导转入芥菜,经PPT筛选抗性植株,经鉴定所得抗性植株全为转基因植株。通过对转基因芥菜种子及 T1代幼苗进行荧光检测,表明 Napin启动子驱动外源EGFP基因在转基因芥菜种子子叶、胚根、种皮中均有表达,且随着种子逐渐成熟,种子各部位绿色荧光逐渐增强;在T1代幼苗中的表达仅在种子萌发初期的子叶、下胚轴和胚根中存在,至植株生长至1片真叶期时,各部位绿色荧光全部消失。
出现这种结果的原因可能是 Napin启动子驱动基因的表达与种子发育阶段具有明显的关联性。Napin启动子控制外源基因在芥菜中的表达从种子发育的某个时期开始,直到种子完熟,因此在T1代幼苗生长初期仍存在大量的外源基因表达产物,随着植株日渐长大,产物相对浓度降低,直至检测不到。这与Murphy等(1989)认为Napin蛋白在油菜中的积累从种子发育中期开始直到种子完熟变干的结论相似。这也表明 Napin启动子控制外源基因的表达与该蛋白本身的表达特性相关,且在属内差异不大。本试验结果对 Napin启动子在植物,尤其是芸薹属植物中的应用提供依据,将该启动子用于调控脂肪酸改良、抗病虫等基因,可为优良种子的生产提供参考。
曹必好,雷建军,宋洪元,秦耀国.2003.芥菜农杆菌高效遗传转化体系初步建立.华南农业大学学报:自然科学版,24(4):48-51.
李丽,张景昱,杜桂森,宋艳茹.2001.种子特异性启动子(napinB promoter)分离、表达载体构建及转基因植物获得.植物学通报,18(2):216-220.
李鹏,张磊,胡琳,高崇,余大杰,许为钢.2008.小麦遗传转化中优良受体基因型及L-PPT适宜浓度的筛选.麦类作物学报,28(2):193-196.
刘建民,李运涛,甘露,李红,栗茂腾.2008.napin基因启动子克隆及进化分析.生物技术通报,(s):188-191.
王关林,方宏筠.2002.植物基因工程.北京:科学出版社:742-744.
肖娜,武玉花,肖玲,吴刚,卢长明.2008.油菜种子特异表达启动子pNapB和pFAE1的结构与功能比较研究.中国油料作物学报,30(1):1-9.
熊兴华,官春云,李恂,谭小力,李家洋.2003.油菜种子特异表达Napin基因启动子的克隆及序列分析.生物技术,13(3):4-5.
杨广东,朱桢,李燕娥,朱祝军.2002.几种抗生素对大白菜种子发芽及离体子叶再生的影响.华北农学报,17(1):55-59.
Huaken A,Baumert A,Milkowskl C,Becker H C,Strack D,Moilers C.2005.Resveratrol glucoside(Piceid)synthesis in seeds of transgenic oilseed rape(Brassica napus L.).Theor Appl Genet,111(8):1553-1562.
Murphy D J,Cummins I,Kang A S.1989.Synthesis of the major oil-body membrane protein in developing rapeseed(Brassica napus)embryos.Integration with storage-lipid and storage-protein synthesis and implications for the mechanism of oil-body formation.Biochem J,258(1):285-293.
Swarnalatha Devi I,Dinesh kumar V,Ansari N A,Sivasankar A.2010.Studies on the expression pattern of seed-specific napin promoter(BcNAI)in transgenic(Nicotiana tabacum L.)tobacco seeds.International Journal of Environmental Science and Development,1(1):20-23.
Tan H L,Yang X H,Zhang F X,Zheng X,Qu C M,Mu J Y,Fu F Y,Li J N,Guan R Z,Zhang H S,Wang G D,Zuo J R.2011.Enhanced seed oil production in canola by conditional expression of Brassica napus LEAFY COTYLEDON1 and LEC1-LIKE in developing seeds.Plant Physiol,156(3):1577-1588.
