老年早期糖尿病性心肌病变患者血糖强化治疗前后氧化应激水平的变化
2012-05-15宋成运杜大勇赖晓辉李运田张世俊
黄 海, 宋成运*, 杜大勇, 柳 杨, 赖晓辉, 江 枫, 李运田, 张世俊
(解放军第305医院: 心脏中心1, 全军老年病实验室中心2, 北京 100017)
2004年美国糖尿病学会(American Diabetes Association, ADA)年会提出了糖尿病及其慢性并发症都是同一发病机制, 即高糖损伤的共同基础—— 氧化应激[1]。而糖尿病性心肌病(diabetic cardio-myopathy, DCM)作为糖尿病慢性并发症之一, 表现为特殊的心肌疾病进程。其病理学表现为心肌微血管的内皮细胞和内膜纤维增生、毛细血管管腔变窄,使心肌发生广泛而持久的慢性缺血缺氧, 造成心肌退行性变和广泛的小灶性坏死, 心肌间质纤维化和心肌胶原网络重构。DCM早期临床表现为心脏舒张功能减退, 最后导致心脏收缩功能减退、心脏扩大及各种心律失常, 而氧化应激是引起心肌损伤的关键所在[2]。本研究旨在探讨老年早期DCM患者经胰岛素泵强化治疗前后氧化应激水平的变化。
1 对象与方法
1.1 对象
选择2009年2月至2011年10月我院心脏病中心确诊为老年早期 DCM 患者 30例(糖尿病按照WHO1999年诊断标准)。入选标准: 年龄≥65岁;有明确且病史较久的糖尿病(病史≥5年); 采用美国通用公司GE VIVID7彩色多普勒超声心动图仪进行心脏超声检查 E/A<1(二尖瓣心室充盈早期血流速度峰值为E峰, 晚期心室充盈心房收缩血流速度峰值为A峰), 射血分数正常; 所有患者行冠状动脉造影术或冠状动脉 CT造影排除冠心病;患者经尿微量白蛋白检查合并有糖尿病性肾病Ⅱ或Ⅲ期, 或经眼底检查合并糖尿病性视网膜病变Ⅱ或Ⅲ期。排除标准: 1个月内曾使用过抗氧化应激药物(如α-硫辛酸、维生素E、降脂药等); 原发性心肌病及高血压、甲状腺功能亢进等特异性心肌病; 糖尿病性肾病、糖尿病性视网膜病变Ⅳ期及以上。男 18例, 女 12例, 年龄 65~78(75.6±8.3)岁, 体质量指数 22.0~28.5(25.4±3.1), 糖化血红蛋白7.0%~10.8%(7.5±1.4)%。治疗方法: 停用原有降糖药物, 采用门冬胰岛素(商品名: 诺和锐)注射液, 经丹纳胰岛素泵皮下持续输注强化治疗10~15d, 使空腹血糖(fasting blood glucose, FBG)<6.5mmol/L, 餐后 2小时血糖(2 hour postprandial blood glucose, 2hPBG)<8.0mmol/L。
1.2 实验室测定
所有患者治疗前后抽静脉血, 离心取血浆进行超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)及丙二醛(malondialdehyde, MDA)测定(南京建成生物有限公司试剂盒), 操作步骤严格按说明书进行。采用全自动生化检测仪测定FBG、2hPBG、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)。化学发光免疫法测定空腹胰岛素(fasting insulin, FINS)。游离脂肪酸(free fatty acid, FFA)运用质谱仪采用气质联用法测定(军事医学科学院完成)。稳态模型(homeostasis model assessment, HOMA)胰岛素分泌功能指数(Homa-β)=20×FINS/(FBG-3.5)和胰岛素抵抗指数(Homa-IR)=FBG×FINS/22.5。
1.3 统计学处理
全部数据用SPSS16.0统计软件处理。计量资料结果采用±s表示, 统计方法采用自身前后对照t检验。因 Homa-β和 Homa-IR为非正态分布, 取自然对数后进行统计分析。
2 结 果
2.1 治疗前后氧化应激指标的变化
胰岛素泵治疗后SOD和GSH-PX水平与治疗前相比明显升高(P<0.01), 而 MDA水平明显降低(P<0.01; 表 1)。
表1 胰岛素泵治疗前后SOD, GSH-PX, MDA的变化Table 1 SOD, GSH-PX and MDA levels before and after insulin pump therapy (n =30,±s)
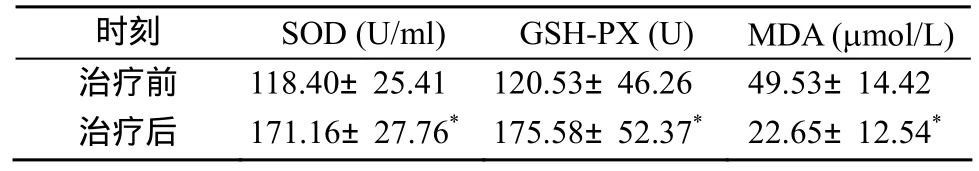
表1 胰岛素泵治疗前后SOD, GSH-PX, MDA的变化Table 1 SOD, GSH-PX and MDA levels before and after insulin pump therapy (n =30,±s)
注: SOD: 超氧化物歧化酶; GSH-PX: 谷胱甘肽过氧化物酶;MDA: 丙二醛。与治疗前比较, *P<0.01
时刻 SOD (U/ml) GSH-PX (U) MDA (μmol/L)治疗前 118.40±25.41 120.53±46.26 49.53±14.42治疗后 171.16±27.76* 175.58±52.37* 22.65±12.54*
2.2 治疗前后生化代谢指标及胰岛素敏感性的变化
胰岛素泵治疗后FBG、2hPBG、TC、TG、LDL、FFA与治疗前相比明显降低(P<0.05)。Homa-β与治疗前相比明显升高(P<0.05), 而Homa-IR明显降低(P<0.05; 表2)。
表2 胰岛素泵治疗前后FBG, 2hPBG, Homa-β, Homa-IR, 血脂及FFA的变化Table 2 FBG, 2hPBG, Homa-β, Homa-IR, lipid and FFA levels before after insulin pump therapy (n =30,±s)

表2 胰岛素泵治疗前后FBG, 2hPBG, Homa-β, Homa-IR, 血脂及FFA的变化Table 2 FBG, 2hPBG, Homa-β, Homa-IR, lipid and FFA levels before after insulin pump therapy (n =30,±s)
注: FBG: 空腹血糖; 2hPBG: 餐后2小时血糖; Homa-β: 稳态模型胰岛素分泌功能指数; Homa-IR: 稳态模型胰岛素抵抗指数; TC: 总胆固醇; TG: 甘油三酯; LDL-C: 低密度脂蛋白胆固醇; FFA: 游离脂肪酸。与治疗前比较,*P<0.05
治疗前 10.96±2.63 18.50±3.24 11.80±5.50 5.90±1.82 8.44±0.90 6.84±1.83 5.11±1.35 0.73±0.10时刻 FBG(mmol/L) 2hPBG(mmol/L) Homa-β Homa-IR(mmol/L)TC(mmol/L)TG(mmol/L) LDL-C(mmol/L) FFA(mmol/L)治疗后 5.64±0.53* 7.74±1.46* 73.32±12.20* 2.50±1.12* 4.40±0.45* 2.80±1.01* 3.01±0.73* 0.34±0.11*
2.3 治疗前后心脏舒张功能改善的变化
胰岛素泵治疗后左室舒张功能E/A值与治疗前相比明显升高[(1.09±0.23)vs(0.74±0.35),P<0.01], 本组治疗有效率达86.7%(26例)。
3 讨 论
自 Rubler等[3]在 1972年提出 DCM 定义后,DCM 越来越受到临床广泛的重视, 其发病具体机制与糖基化终产物增多、脂代谢紊乱、肾素血管紧张素醛固酮系统激活、多元醇通路和己糖胺通路活性增高、蛋白激酶C活化等有关[4,5]。高血糖引起线粒体活性氧的产生, 从而引起细胞内氧化应激反应,是导致上述发病机制的中心环节。胰岛素泵持续皮下输注胰岛素更接近正常人的胰腺分泌, 迅速解除高血糖毒性, 保护残存的胰岛细胞恢复功能[6]。本研究结果显示, 所有患者经胰岛素泵强化治疗后,FBG和2hPBG在很短时间内都得到很好的控制, 降低了高糖毒性。长期高FFA血症等脂代谢异常引发的脂毒性可致 β细胞损伤, 加重胰岛素抵抗, 导致细胞坏死、凋亡。本组患者治疗后TC, LDL-C, TG及FFA水平明显下降, 减少了脂毒性。Homa-β明显升高, 而Homa-IR明显下降, 提示患者胰岛β细胞功能有所恢复, 胰岛素抵抗明显减轻。
SOD活力反映了机体清除O2−的能力。GSH-PX是重要的催化H2O2分解的酶, 具有保护细胞膜的作用。而MDA反映了机体细胞受自由基攻击的程度。治疗后, 所有患者 SOD、GSH-PX水平明显升高,MDA水平明显降低, 表明患者经胰岛素泵强化治疗后氧化应激水平明显降低, 更有效地阻止了DCM的发生发展。
通过对患者左室舒张功能的观察, 发现胰岛素强化治疗能明显改善患者左室舒张功能, E/A比值较治疗前有显著差异, 其有可能通过降低氧化应激水平而起作用。
本研究结果表明, 老年早期 DCM 患者采用持续胰岛素皮下输注强化治疗可有效改善和恢复β细胞功能, 降低糖脂毒性及氧化应激水平, 改善心脏舒张功能, 获得较好的临床治疗效果。但由于该研究入选条件较高, 样本量偏小, 尚待多中心、大规模的随机对照研究进一步论证。
[1]Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes, 2005, 54(6): 1615-1625.
[2]Okoshi K, Guimarães JF, Di Muzio BP,et al. Diabetic cardiomyopathy[J]. Arq Bras Endocrinol Metabol, 2007,51(2): 160-167.
[3]Rubler S, D lugash J, Yuceoglu YZ,et al. New type of cardiomyopathy associated with diabetic glomerolosclerosis[J].Am J Cardiol, 1972, 30(6): 595-602.
[4]Sasso FC, Rambaldi PF, Carbonara O,et al. Perspectives of nuclear diagnostic imaging in diabetic cardiomyopathy[J].Nutr Metab Cardiovasc Dis, 2010, 20(3): 208-216.
[5]Zhou GH, Li XK, Hein DW,et al. Metallothionein suppresses angiotensinⅡinduced nicotinamide adenine dinucleotide phosphate oxidase activation, nitrosative stress,apoptosis, and pathological remodeling in the diabetic heart[J]. J Am Coll Cardiol, 2008, 52(8): 655-666.
[6]黄 海, 祝开思, 王 平, 等. 新诊断的 2型糖尿病患者胰岛素强化治疗前后氧化应激水平的变化[J]. 中国糖尿病杂志, 2011, 19(5): 338-339.
