耐力运动促进骨骼肌卫星细胞线粒体能量代谢及其对成肌分化的影响
2012-05-12薄海王逊陈啟祥吉力立张勇
薄海 王逊 陈啟祥 吉力立 3, 张勇 ,1
1军事医学科学院环境医学研究所(天津 300050) 2天津体育学院天津市运动生理学与运动医学重点实验室(天津 300381) 3明尼苏达大学运动科学系,MN 55455,美国 4武警后勤学院部队训练医学教研室(天津 300162)
骨骼肌具有高度可塑性,适当运动能够有效促进肌肉肥大,从而提高肌肉工作能力。肌肉发生是肌肉肥大的重要生物学基础,骨骼肌卫星细胞(satellite cells)在成体肌肉发生过程中起着关键作用。卫星细胞具有自我更新、增殖和分化特性,被定义为肌肉干细胞。卫星细胞在MyoD等成肌调节因子作用下成肌分化(myogenic differentiation)为肌管,不仅能与原有肌纤维融合,修复或强化肌肉结构,还能形成新的肌纤维[1]。研究表明,一次性运动可激活卫星细胞,促进增殖使其数量增加;多次重复运动可提高其成肌分化能力[2]。
Charifi等[3]发现,14 周跑台训练显著增加骨骼肌卫星细胞数量、肌纤维中的肌核数量及肌纤维横截面积。成熟肌纤维中的肌核是不能分裂的,因而增加的肌核来源于分化的卫星细胞。Shefer等[4]则发现,2周跑台训练可显著提高骨骼肌MyoD、Myf5等成肌分化标志因子表达。以上结果表明耐力运动训练可提高卫星细胞分化能力。运动对卫星细胞的作用机制一般认为与其“微环境”变化有关,如肌肉微损伤诱发炎症反应、肌纤维旁分泌IGF-1、MGF等生长因子[5]。但卫星细胞内组分对运动的应答机制缺乏研究。
卫星细胞增殖与分化是两个矛盾的过程,增殖是细胞周期循环的过程,而分化是使细胞不可逆地退出细胞周期。增殖状态卫星细胞线粒体含量很少,其能量代谢以无氧糖酵解为主;当其进入成肌分化阶段,线粒体有氧代谢逐渐占据优势以适应成熟肌细胞的生理功能[6]。研究表明,线粒体DNA拷贝数、呼吸链复合体表达及线粒体氧化磷酸化水平在成肌分化过程中进行性增加[7]。 此外,Jahnke 等[8]发现,线粒体生物合成可通过影响胞浆钙离子浓度逆向调控成肌细胞细胞周期。上述结果提示线粒体数量和质量参与调控卫星细胞分化的启动和进程。我们推测,运动可能通过影响卫星细胞线粒体能量代谢以调控成肌分化。
本研究建立了小鼠中等负荷耐力训练模型,并分离骨骼肌卫星细胞进行原代培养,观察反复运动刺激对未分化卫星细胞中线粒体能量代谢的影响;并在体外诱导分化,探讨运动干预后卫星细胞分化过程中线粒体能量代谢的变化规律,及其对成肌分化能力的影响。
1 材料和方法
1.1 实验动物与分组
雄性C57BL/6小鼠24只,体重18~20g,2月龄,由北京华阜康生科技股份有限公司提供,生产许可证:SCKK(京)2009-0004,生产批号:1003428,级别SPF级。分笼饲养,自由饮水、进食,饲养温度21~24℃,相对湿度45~55%。将小鼠随机分为2组:安静对照组(N 组,n=12)和运动训练组(T 组,n=12),组间体重无显著性差异。T组小鼠置于小动物跑台中,进行中等负荷耐力运动训练,即0°,17 m/min(相当于 65%VO2max),每天 1次,每次 1 h,每周 5次,共12周。该运动模型已被证明可促进小鼠骨骼肌卫星细胞活化,肌纤维内肌核增加[9]。N组小鼠每日置于静止跑台1 h。本实验动物饲养、取材及指标测定均在天津体育学院天津市运动生理学与运动医学重点实验室完成。实验动物使用许可证号:天津体育学院动物实验室:(津)2005-0006。
1.2 骨骼肌形态学观察
末次训练后24 h,记录小鼠体重,脱颈处死,完整切取小鼠单侧腓肠肌,称量湿重。将其横向切断,浸泡于10%甲醛中固定48 h,常规石蜡包埋,肌肉横切面切片,厚度8 μm,常规HE染色。BI-2000型图像分析系统测量肌纤维横截面积。
1.3 骨骼肌卫星细胞原代培养
为了提高原代培养卫星细胞产量,减少体外增殖时间,本研究将2只小鼠作为一个样本提取卫星细胞并测定相关指标,最终N组和T组样本量均为6。将1.2中已处死并切除单侧腓肠肌的小鼠整体浸泡于75%酒精中15分钟消毒。无菌条件下取小鼠双下肢剩余肌肉(股四头肌、比目鱼肌、腓肠肌),剔除脂肪筋膜和血管,PBS漂洗3遍。将组织块剪为肉糜,再用PBS冲洗3次,静置1 min后,弃去漂浮组织和上层液体。加入5倍体积0.1%Ⅱ型胶原蛋白酶,37℃在磁力搅拌器慢速搅拌下消化90 min。800g离心10分钟,吸除上清液,加入5倍体积0.25%胰蛋白酶,37℃在磁力搅拌器慢速搅拌下消化10 min后,加入10%胎牛血清1ml终止消化。1000g离心10分钟,吸除上清液,加入5ml生长培养基 (高糖DMEM培养基,10%胎牛血清,2%马血清,100 U/ml青霉素+链霉素),反复吹打后依次通过100目、200目和400目不锈钢细胞筛过滤。细胞悬液加入100 mm细胞培养皿,采用差速贴壁法除去成纤维细胞,先将细胞在37℃温箱中培养2 h,吸取未贴壁的细胞悬液,以105/ml左右的细胞密度接种于60 mm细胞培养皿,放于含5%CO2的37℃培养箱中培养,48 h后首次换液,以后每48 h换液1次。免疫化学染色方法鉴定骨骼肌卫星细胞的肌源性标志结蛋白desmin的表达。
1.4 骨骼肌卫星细胞分化培养
当细胞增殖至80%融合时,弃去生长培养基,PBS冲洗3次,加入分化培养基(高糖DMEM培养基,2%马血清,100 U/ml青霉素+链霉素)继续培养,倒置显微镜拍照各组细胞生长形态。各组细胞分别于分化0 h和24 h收集细胞,0.25%胰酶消化,消化完全后加入生长培养基终止消化,800g离心10分钟,并进行细胞计数。考马斯亮蓝法测定细胞总蛋白含量。
1.5 线粒体呼吸功能测定
采用Oxygraph-2k细胞呼吸测量仪(Oroboros,Austria)测定透膜细胞中线粒体氧耗速率[10]。反应体系3 ml,37℃恒温,以固定速度搅拌。细胞重悬于3 ml呼吸测定介质(130 mM KCl,10 mM Hepes,1 mM EDTA,2.5 mM KH2PO4,1.5 mg defatted BSA,pH 7.4),加入10 μM洋地黄皂甙透膜3 min。稳定后加入5 mM苹果酸和10 mM谷氨酸启动态4呼吸。平稳后加入5 mM ADP启动态3呼吸。ADP耗尽后重又回到态4呼吸。记录仪记录耗氧曲线。计算态3(State 3,ST3)和态 4(State 4,ST4)呼吸速率(nmol O2/min·mg pro)和呼吸控制比(RCR)。
1.6 ATP合成活力测定
采用荧光素-荧光素酶发光法[11],用 20/20n型发光仪(Turner Biosystem,USA)测定ATP合成活力。细胞重悬于0.5 ml测定介质 (0.5 mM EDTA,10 mM Hepes,5mM KH2PO4,2.5 mM MgCl2)中,加入 5 μM 洋地黄皂甙透膜3 min。加入20 μM荧光素酶、5 mM苹果酸和10 mM谷氨酸,记录发光强度变化率为本底,加入4 μM ADP后启动线粒体ATP合成反应,记录发光强度变化率。二者差值为线粒体ATP合成活力(nmol/min·mg pro)。
1.7 线粒体膜电位测定
采用JC-1荧光探针检测线粒体膜电位[12]。将细胞重悬于0.9 ml JC-1染色工作液(碧云天生物公司),加入5 μM洋地黄皂甙透膜3 min。加入避光37℃水浴20 min。水浴后加入5 mM苹果酸和10 mM谷氨酸启动态4呼吸,于荧光分光光度计(Beckman,USA)下测定绿色荧光 (激发波长490 nm,发射波长530 nm)和红色荧光(激发波长525 nm,发射波长590 nm)。用红色荧光(聚合物)数值/绿色荧光(单体)数值表示线粒体膜电位。
1.8 Western blot法检测相关蛋白表达
每个样本收集5×106个细胞,加入5倍体积RIPA蛋白裂解液(碧云天生物公司),冰浴10 min,且每隔5 min在漩涡混合仪震荡30秒。4℃12000g离心15min,将上清转移至新离心管中,即得细胞总蛋白产物。采用考马斯亮蓝法测定提取蛋白浓度,分装,-80℃保存。Western blot法检测细胞MyHC、COXⅣ、AMPK、p-AMPK(Thr 172)和 p21 蛋白表达量,以β-tubulin作为内参。取5×106细胞接种于100mm细胞培养皿,观察细胞融合度为80%时进行总蛋白的提取,将提取蛋白根据样品浓度不同加入2×SDS上样缓冲液,混合液100℃加热5 min,冰浴冷却。在垂直电泳仪(BIO-RAD,USA)上用 10 μg 蛋白质样品经15%SDS-PAGE分离后,转移于PVDF膜上。1∶1000一抗(Abcam)4℃静置孵育过夜,洗涤3次,再以1∶1000辣根过氧化物酶标记的对应二抗室温孵育1小时,充分洗涤后,使用ECL试剂盒发光显影,X线胶片压片曝光,扫描定量各条带的相对灰度值。以N组0 h条带灰度值为100%,其他两组条带灰度值与N组0 h条带灰度值的比值,即为其相对表达量(%)。
1.9 统计学分析
2 结果
2.1 体重、腓肠肌湿重及肌纤维横截面积
T组小鼠体重和N组比较无明显差异(P>0.05);T组腓肠肌湿重和湿重/体重比值略高于N组,但无统计学意义(P>0.05);形态学结果显示,T组肌纤维横截面积显著高于 N 组(P<0.05)(表 1,图 1)。

表1 两组小鼠体重、腓肠肌湿重及肌纤维横截面积比较

图1 两组(左为N组,右为T组)腓肠肌肌纤维横截面积(×40)
2.2 原代培养骨骼肌卫星细胞desmin免疫化学染色鉴定
免疫化学染色结果表明,原代培养的卫星细胞呈现胞浆丰富的梭形或纺锤形细胞,经计数,desmin抗体免疫化学染色阳性细胞数占细胞总数比例>90%(图2)。Desmin在骨骼肌卫星细胞胞浆中呈强阳性表达,胞浆染色呈棕黄色,而成纤维细胞等杂质细胞不着色。表明本研究原代培养的卫星细胞纯度较高,可满足实验要求。
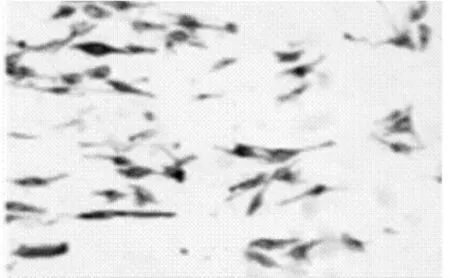
图2 原代培养骨骼肌卫星细胞desmin免疫化学染色鉴定结果
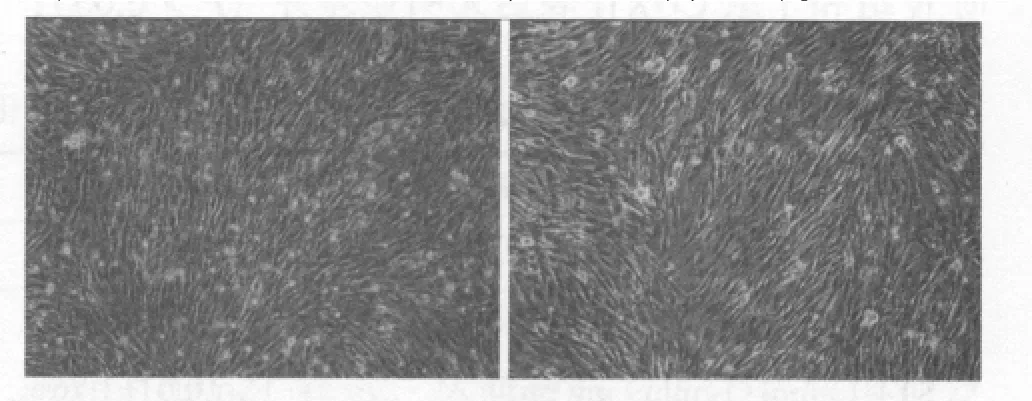
图3 两组(左为N组,右为T组)骨骼肌卫星细胞成肌分化24 h 肌管形成情况(×100)。
2.3 骨骼肌卫星细胞成肌分化能力
倒置显微镜观察结果显示,卫星细胞诱导24 h后,T组大量卫星细胞发生融合,并形成多核的肌管细胞(图3右)。与T组比较,N组细胞融合和形成肌管的数量明显减少 (图3左)。Western-blot结果显示,分化0 h时N组和T组MyHC表达组间比较无明显差异(P>0.05);分化24 h时,T组MyHC表达显著高于N组 (P<0.05)。组内比较,N组和T组24 h时MyHC 表达均显著高于 0 h(P<0.01)(图 4)。
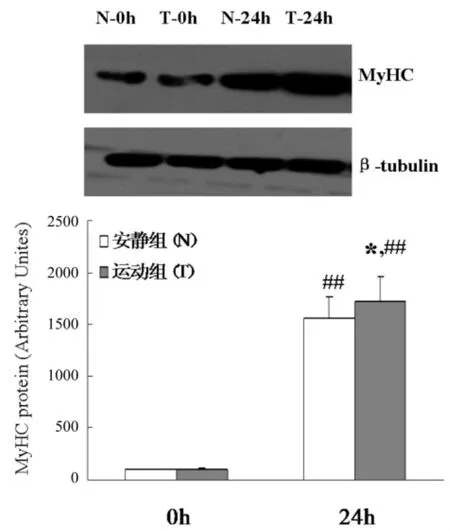
图4 两组骨骼肌卫星细胞成肌分化中MyHC蛋白表达
2.4 骨骼肌卫星细胞成肌分化中线粒体标志蛋白COXⅣ表达
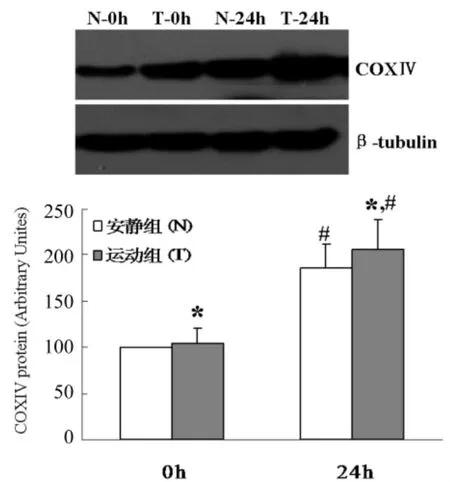
图5 两组骨骼肌卫星细胞成肌分化中COXⅣ蛋白表达
Western-blot结果(图5)显示,组间比较,分化0 h时N组和T组COXⅣ表达无明显差异 (P>0.05);分化24 h时,T组COXⅣ表达显著高于N组 (P<0.05)。组内比较,N组和T组24 h时COXⅣ表达均显著高于 0 h(P<0.05)。
2.5 骨骼肌卫星细胞成肌分化中线粒体能量代谢指标(表2)
组间比较,0 h和 24 h时,T组 ST3、RCR和ATP合成活力均显著高于N组(P<0.05)。0 h时T组膜电位较N组有升高趋势,但无统计学意义(P>0.05),24 h时T组膜电位显著高于N组(P<0.05)。
组内比较,N组和T组ST3、ST4表达在24 h时均显著高于 0 h(P<0.05)。
2.6 两组骨骼肌卫星细胞成肌分化中相关信号通路指标
Western-blot结果(图 6、7、8)显示,组间比较,0 h和24 h时T组p21蛋白表达均显著高于N组 (P<0.05),0 h和24 h时T组p-AMPK蛋白表达均显著低于N组(P<0.05),两组AMPK蛋白表达无明显差异(P>0.05);组内比较,N组和T组24 h时p21蛋白表达均显著高于0 h(P<0.01),两组24 h和0 h AMPK和p-AMPK无明显差异(P>0.05)。

表2 两组骨骼肌卫星细胞成肌分化中线粒体能量代谢指标比较(n=6)
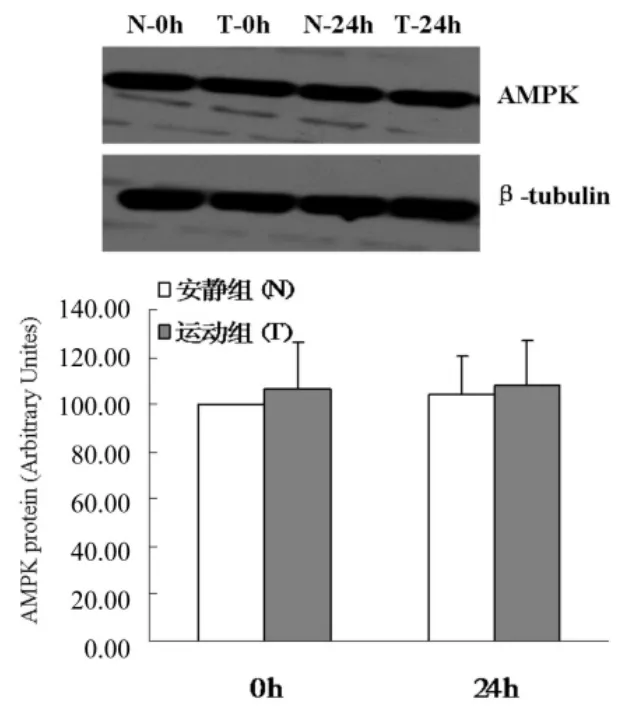
图6 两组骨骼肌卫星细胞成肌分化中AMPK蛋白表达

图7 两组骨骼肌卫星细胞成肌分化中p-AMPK蛋白表达

图8 两组骨骼肌卫星细胞成肌分化中p21蛋白表达
3 讨论
本研究建立了小鼠中等负荷耐力训练模型,腓肠肌湿重/体重比值及肌纤维横截面积结果显示,所采用的运动模型有效促进了骨骼肌肥大。卫星细胞成肌分化是肌肉肥大的生物学基础之一。本研究分离了骨骼肌卫星细胞,原代培养并诱导成肌分化,结果表明,分化24 h后,与安静组比较,运动组细胞融合及形成肌管的数量明显增加,成肌分化标志蛋白MyHC表达显著升高。这表明耐力运动可通过提高卫星细胞成肌分化能力促进肌肉肥大。值得注意的是,本研究中的卫星细胞分化是在离体环境中进行的,与在体“微环境”中的炎性物质和生长因子等无关。这表明反复运动刺激使卫星细胞未分化时其细胞内组分即发生改变,而这种“积累效应”足以引起分化能力的差异。
研究者逐渐认识到线粒体能量代谢是干细胞由增殖向分化切换的重要事件。Varum等[13]发现利用抗霉素A抑制线粒体复合体Ⅲ活性,有利于保持胚胎干细胞 (ESCs)自我更新状态和多潜能干性。Pietila等[14]利用流式细胞技术分拣JC-1标记的间充质干细胞(hMSCs),发现线粒体膜电位高的hMSCs更倾向于分化,而膜电位低的hMSCs倾向于分裂增殖。本研究中,分化0 h时,与安静组比较,运动组线粒体ST3显著升高,ST4无明显变化,因而RCR显著升高。此外,线粒体ATP合成活力和膜电位均显著升高。这表明耐力运动提高了未分化卫星细胞中线粒体能量代谢水平。
本研究测量了透膜细胞线粒体的整体能量代谢水平,为探讨其变化是否与线粒体数量有关,我们检测了线粒体标志蛋白COXⅣ表达量。结果表明,分化0 h时,运动组COXⅣ表达与安静组无明显差异,因而线粒体能量代谢上调与线粒体数量无关。RCR升高表明线粒体偶联程度增加。Chen等[15]发现,过表达解偶联蛋白2(UCP2)使C2C12成肌细胞保持于增殖状态而抑制分化,成肌调节因子MyoD可通过上调肌肉特异性Micro RNA-113a抑制成肌细胞UCP2表达,继而促进成肌分化。我们推测,运动训练可能通过MyoD途径抑制卫星细胞线粒体解偶联呼吸。此外,Leiter等[16]发现,机械牵拉卫星细胞可刺激一氧化氮(NO)产生。 最近 Palma 等[11]发现,NO 可通过抑制Drp1介导的线粒体分裂促进成肌分化。我们前期研究也证明,运动过程中骨骼肌线粒体趋向分裂时伴随ST4增加,而线粒体趋向融合时则伴随ST3和ATP合成活力和膜电位上调[17]。我们推测,NO途径是运动上调卫星细胞线粒体能量代谢的潜在途径。
卫星细胞从增殖阶段向分化阶段转化的关键步骤即细胞周期的退出。细胞周期蛋白依赖性蛋白激酶抑制因子p21蛋白已被证明可通过阻止卫星细胞进入S期以启动分化,p21敲除鼠骨骼肌修复和再生能力明显降低,表现为肌萎缩[18]。Williamson等发现,AMPK激动剂AICAR通过下调FOXO3A表达抑制其下游p21表达,从而抑制C2C12成肌细胞分化,作者认为AMPK-p21途径可能是成肌分化的能量检测路径[19]。AMPK是细胞能量变化感受器,AMP/ATP比值升高使AMPK激活。本研究中,分化0 h时,与安静组比较,AMPK蛋白表达无明显变化,而p-AMPK表达明显减少,同时p21蛋白表达显著升高。我们推测,耐力运动提高了未分化卫星细胞线粒体能量代谢水平,从而抑制AMPK活化,继而上调其下游p21表达,使卫星细胞更易于启动分化。
为了进一步探讨运动诱导的未分化卫星细胞线粒体“积累效应”对成肌分化的影响,本研究检测了分化24 h时各组细胞线粒体能量代谢及相关通路的变化。与安静组比较,运动组AMPK活化水平明显降低,p21表达显著升高。这表明AMPK-p21途径在分化进程中依然发挥效应。与分化0 h比较,运动组 ST3(+136%)、ST4(+44%)、RCR(+75%)、ATP 合成活力(+240%)、膜电位(+105%)均显著升高,安静组 ST3(+107%)、ST4(+31%)、RCR(+61%)、ATP 合成活力(+221%)、膜电位(+95%)亦显著升高。这些结果表明,运动组线粒体能量代谢指标增加幅度均高于安静组。此外,运动组COXⅣ和表达增加幅度亦高于安静组(79%vs.66%)。以上提示,与安静组比较,运动诱导的高活性线粒体可在成肌分化中进一步促进线粒体能量代谢和生物合成。最近Lee等[20]研究发现,在成肌细胞中过表达线粒体呼吸链复合体Ⅰ可促进线粒体能量代谢水平,同时增加活性氧(ROS)生成,促进成肌分化;同时使用抗氧化剂反而抑制了分化。我们前期研究发现,ROS可通过PGC-1α、Mfn1 等多条途径上调线粒体能量代谢[17,21]。 我们推测,未分化卫星细胞中高活性线粒体可能通过增加ROS生成,并激活其下游信号通路,进一步促进成肌分化中线粒体能量代谢。
4 总结
耐力运动训练可提高未分化卫星细胞线粒体能量代谢水平,继而抑制AMPK活化而增加p21表达,从而促进成肌分化启动;研究还提示,高活性线粒体可在成肌分化进程中进一步促进线粒体能量代谢,继而加速分化,具体机制有待研究。
[1]Sacco A,Doyonnas R,Kraft P,et al.Self-renewal and expansion of single transplanted muscle stem cells.Nature,2008,456(7221):502-506.
[2]Parise G,Mckinnell IW,Rudnicki MA.Muscle satellite cell and atypical myogenic progenitor response following exercise.Muscle Nerve,2008,37(5):611-619.
[3]Charifi N,Kadi F,Feasson L,et al.Effects of endurance training on satellite cell frequency in skeletal muscle of old men.Muscle Nerve,2003,28(1):87-92.
[4]Shefer G,Carmeli E,Rauner G,et al.Exercise running and tetracycline as means to enhance skeletal muscle stem cell performance after external fixation.J CellPhysiol,2008,215(1):265-275.
[5]Snijders T,Verdijk LB,Van LL.The impact of sarcopenia and exercise training on skeletal muscle satellite cells.Ageing Res Rev,2009,8(4):328-338.
[6]Aguer C,Gambarotta D,Mailloux RJ,et al.Galactose enhances oxidative metabolism and reveals mitochondrial dysfunction in human primary muscle cells.PLoS One,2011,6(12):e28536.
[7]Remels AH,Langen RC,Schrauwen P,et al.Regulation of mitochondrial biogenesis during myogenesis.Mol Cell Endocrinol,2010,315(1-2):113-120.
[8]Jahnke VE,Sabido O,Freyssenet D.Control of mitochondrial biogenesis,ROS level,and cytosolic Ca2+concentration during the cell cycle and the onset of differentiation in L6E9 myoblasts.Am J Physiol Cell Physiol,2009,296(5):1185-1194.
[9]Fontana K,White KE,Campos GE,et al.Morphological changes in murine skeletal muscle in response to exercise and mesterolone.J Electron Microsc(Tokyo),2010,59(2):153-164.
[10]Comelli M,Domenis R,Bisetto E,et al.Cardiac differentiation promotes mitochondria development and ameliorates oxidative capacity in H9c2 cardiomyoblasts.Mitochondrion,2011,11(2):315-326.
[11]Palma CD,Falcone S,Pisoni S,et al.Nitric oxide inhibition of Drp1-mediated mitochondrial fission is critical for myogenic differentiation.Cell Death Differ,2010,17(11):1684-1696.
[12]Chen K,Zhang Q,Wang J,et al.Taurine protects transformed rat retinal ganglion cells from hypoxia-induced apoptosis by preventing mitochondrial dysfunction.Brain Res,2009,1279:131-138.
[13]Varum S,Momcilovic O,Castro C,et al.Enhancement of human embryonic stem cell pluripotency through inhibition of the mitochondrial respiratory chain.Stem Cell Res,2009,3(2-3):142-156.
[14]Pietila M,Lehtonen S,Narhi M,et al.Mitochondrial function determines the viability and osteogenic potency of human mesenchymal stem cells.Tissue Eng Part CMethods,2010,16(3):435-445.
[15]Chen X,Wang K,Chen J,et al.In vitro evidence suggests that miR-133a-mediated regulation of uncoupling protein 2(UCP2) is an indispensable step in myogenic differentiation.J Biol Chem,2009,284(8):5362-5369.
[16]Leiter JR,Anderson JE.Satellite cells are increasingly refractory to activation by nitric oxide and stretch in aged mouse-muscle cultures.Int J Biochem Cell Biol,2010,42(1):132-136.
[17]Ding H,Jiang N,Liu H,et al.Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle.Biochim Biophys Acta,2010,1800(3):250-256.
[18]Hawke TJ,Meeson AP,Jiang N,et al.p21 is essential for normal myogenic progenitor cell function in regenerating skeletal muscle.Am J Physiol Cell Physiol,2003,285(5):1019-1027.
[19]Williamson DL,Butler DC,Alway SE.AMPK inhibits myoblast differentiation through a PGC-1alpha-dependent mechanism.Am J Physiol Endocrinol Metab,2009,297(2):304-314.
[20]Lee S,Tak E,Lee J,et al.Mitochondrial H2O2 generated from electron transport chain complex I stimulates muscle differentiation.Cell Res,2011,21(5):817-834.
[21]丁虎,刘晓然,刘丹霞,等.急性运动诱导大鼠骨骼肌线粒体生物合成:H2O2参与介导PGC-1α转录.中国运动医学杂志,2008,27(2):136-143.
