4种植物生长调节剂对切花菊保鲜效果和生理作用的影响
2012-05-10马海燕郑春雷李永华
马海燕,李 永,郑春雷,李永华
(1.河南农业大学林学院,河南 郑州450002;2.鹤壁市淇滨区园林局,河南鹤壁458030)
菊花(Dendranthema×grandiflorum Ramat)为菊科菊属多年生宿根草本植物,约占鲜切花总产量的30%[1].近年来,越来越多的植物生长调节剂因为具有某一种或多种功效而被用于切花保鲜中.如将 GA3,6-BA,KT,PPP333,B9,CCC,TDZ 等植物生长调节剂应用于百合[2]、睡莲[3]、紫罗兰[4]、鸢尾[5]等切花的采后处理,可以显著改善这些切花的瓶插品质,提高观赏价值,延长瓶插寿命.然而目前植物生长调节剂在切花菊保鲜上研究相对单一[6~8],因此拓宽切花菊保鲜液领域的研究,充分利用现有植物生长调节剂,并与传统保鲜剂的主要成分及作用方法相结合,寻找出最佳的切花菊保鲜剂配方显得非常必要且具有生产实践意义.本研究以切花菊品种‘夏黄’为试材进行瓶插保鲜试验,研究不同植物生长调节剂对切花菊瓶插寿命、观赏品质和生理变化的影响,以期为植物生长调节剂在切花菊保鲜上的应用提供理论依据.
1 材料与方法
1.1 供试材料
试验材料为切花菊品种‘夏黄’,花冠黄色,由郑州市顺达高新农业技术有限公司提供.选择健壮新鲜,花朵大小及开放程度(直径4.532 cm)一致,花茎长而挺直,且长度、粗度比较整齐一致(花茎长度大于45 cm),叶片墨绿色,舌状花无损伤,无病虫害的切花菊.采后于4℃冷藏条件下运回实验室,进行瓶插处理.
1.2 试验方法
试验于2010-07至2010-09在河南农业大学林学院人工气候室内进行,室温(23±1)℃,相对湿度 80%,平均光照强度 2 000 μmol·m-2·s-1.瓶插前将切花菊在蒸馏水中斜45°剪切,留茎长约35 cm,去掉部分多余叶片,上部留8片完好叶片.
1.2.1 不同植物生长调节剂对切花菊保鲜效果的影响 在基本保鲜液(20 g·L-1S+200 mg·L-18-HQ+200 mg·L-1CA)的基础上,分别加入6-BA,GA3,KT,PP3334 种不同植物生长调节剂,以基本保险液为对照,各植物生长调节剂的质量浓度经预备试验确定(表1).将处理好的切花菊插入500 mL三角瓶中,每瓶4枝,装250 mL保鲜液,用脱脂棉封住瓶口防止水分蒸发.每个处理5次重复,每天观察记录各处理的保鲜效果,记录瓶插寿命.
1.2.2 GA3和6-BA对切花菊瓶插期间生理变化的影响 根据切花菊瓶插寿命及外观形态指标选出对切花菊保鲜效果较好的6-BA和GA3,以基本保鲜液为对照(CK),GA3和6-BA处理为处理Ⅰ和处理Ⅱ瓶插保鲜液,进一步研究GA3和6-BA对切花菊生理变化的影响.将处理好的切花菊插入500 mL三角瓶中,每瓶4枝,装250 mL保鲜液,用脱脂棉封住瓶口防止水分蒸发.每个处理5次重复,每天观察记录,隔天取样(花样取自外缘向内的第3~5层舌状花,叶样取茎中间部分3~5片叶).每3 d换1次保鲜液,保鲜液pH值4.5左右(用柠檬酸调节).
1.3 测定方法
瓶插寿命参照郭维明等[6]、郭碧花[7]的标准,为从瓶插日起至花冠50%舌状花干枯萎蔫、出现褐斑、失去观赏价值所需天数.花径为每天9:00用游标卡尺测量花冠平展最大直径.鲜重变化率=(瓶插期花枝质量-瓶插初期花枝质量)/瓶插初期花枝质量×100%.水分平衡值:称取花枝、溶液、瓶的重量,求和,2次连续称量之差即为该段时间内花枝的失水量;称取溶液和瓶的重量,求和,2次连续称量之差即为花枝的吸水量;吸水量和失水量之差即为花枝的水分平衡值.以上4个指标均取12枝花的平均值.MDA含量采用硫代巴比妥酸法测定;游离脯氨酸含量采用茚三酮法测定;叶片叶绿素含量用80%丙酮提取法测定;可溶性蛋白含量采用考马斯亮蓝法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定.以上指标均作3次重复,采用DPS及EXCEL软件进行数据处理.
2 结果与分析
2.1 不同植物生长调节剂处理对切花菊瓶插寿命和品质的影响
从表1可知,各植物生长调节剂均能显著延长切花菊的瓶插寿命,GA3,6-BA,KT,PP333处理的切花菊分别比基本保鲜液处理的瓶插寿命增加了4.1,12.4,6.8,9.5 d,并且各处理间均差异显著(P<0.05);与基本保鲜液处理的最大花径相比,GA3,6-BA,KT 处理分别增加了 1.956,0.763 ,0.179 cm,而PP333处理最大花径小于基本保鲜液处理.在试验过程中,GA3处理花径增大最为显著,与初始花径相比增大了6.252 cm,但开放速度较快,小花颜色较淡;6-BA处理失水萎焉速度最慢,瓶插寿命最长,能有效增大切花菊花径,与初始花径相比增大了5.059 cm,开放时小花饱满,维持的时间最长,整体观赏性最好;KT处理能有效增大切花菊花径和瓶插时间,但增大花径效果低于GA3和6-BA,瓶插寿命低于6-BA和PP333;PP333处理叶片大而厚、呈墨绿色,能有效延缓切花菊的开放速度、延长其开放时间,但会抑制切花菊花径的增加.

表1 植物生长调节剂对切花菊最大花径和瓶插寿命的影响Table 1 Effects of different plant growth regulators on flower diameter and vase life of cut Chrysanthemum
2.2 GA3和6-BA处理对切花菊鲜重变化率和水分平衡值的影响
从图1-a可知,3种处理的变化趋势大致相同,都呈先增大后下降的趋势,但上升幅度和0值出现的时间不同,处理Ⅰ和处理Ⅱ总体高于CK,且CK处理水分平衡值0值出现最早.处理Ⅰ的上升幅度最大,切花菊的鲜重变化率最大增加达36.38%,在整个瓶插期间鲜重变化率均大于0,第9天以后下降迅速,鲜重变化率开始低于处理Ⅱ.处理Ⅱ的鲜重变化率最大增加34.10%,0值出现得最晚,在瓶插第23天左右出现,与处理Ⅰ在瓶插前5 d差异不显著,随后差异逐渐加大.
由图1-b可知,各处理的切花菊从瓶插开始起水分平衡值即呈逐渐下降趋势.瓶插初期各处理的水分平衡值均为正值,随后逐渐降低,出现负值,表明瓶插初期切花菊吸水量大于失水量,随着瓶插天数的增加,吸水量逐渐小于失水量,水分胁迫加剧.CK水分平衡值下降迅速,在第9天出现负值.处理Ⅰ与处理Ⅱ水分平衡值下降速度均比CK慢,处理Ⅰ水分平衡值在第11天出现负值,处理Ⅱ水分平衡值负值出现得最晚,在第13天出现,比CK推迟了6 d.整个瓶插过程中,前7 d处理Ⅰ的水分平衡值最高,随后下降较快,开始低于处理Ⅱ.综合分析表明,在切花菊保鲜液中添加GA3和6-BA均能显著提高切花菊的吸水能力,增加鲜重变化率,改善切花菊体内水分状况,减轻水分胁迫对切花菊造成的危害,GA3处理瓶插前期效果较好,但后期效果不如6-BA处理.

图1 保鲜液处理对切花菊鲜重变化率和水分平衡值的影响Fig.1 Effects of preservatives on change ratio of fresh weight and water balance value of cut Chrysanthemum
2.3 GA3和6-BA处理对切花菊小花中MDA和游离脯氨酸含量的影响
由图2-a可知,3种处理的MDA含量的变化趋势相似.前5 d,MDA含量均逐渐降低,第5天后开始增加.在整个瓶插过程中,CK的MAD含量总体高于处理Ⅰ和处理Ⅱ,处理Ⅱ的变化趋势比CK和处理Ⅰ相对缓和,处理Ⅰ的切花菊小花中MDA含量比同期 CK 低 0.231 ~ 1.412 μmol·g-1,处理Ⅱ的切花菊小花中MDA含量比同期CK低0.082 ~ 2.348 μmol·g-1.MDA 含量与植物器官衰老程度相关,其含量越高表明植物衰老程度越大.综合分析表明,在保鲜液中添加6-BA能有效缓解切花菊小花中MDA含量增加的趋势,从而延缓衰老、延长切花菊的瓶插寿命,这与6-BA处理的切花菊瓶插寿命最长相一致.
由图2-b可知,前5 d,各处理的游离脯氨酸含量均逐渐降低且相互之间差别不大,随后差距逐渐加大.CK处理含量上升的趋势相比处理Ⅰ和处理Ⅱ明显.处理Ⅰ的游离脯氨酸含量低于同期基本保鲜液 CK处理,与同期 CK相比低 1.433~10.583 μg·g-1,但比 6-BA 处理高,且在瓶插第11天后,游离脯氨酸含量迅速增加,这与GA3处理的切花菊在瓶插后期鲜重变化率和水分平衡值迅速下降相一致.在整个瓶插过程中,处理Ⅱ游离脯氨酸含量的增加趋势均低于CK和处理Ⅰ,比同期CK 低0.180 ~24.983 μg·g-1.脯氨酸是一种渗透调节物质,能够反映植物受到的水分胁迫程度.瓶插后期,各处理的脯氨酸含量都有所上升,CK处理大幅度上升最早,说明花枝受到水分胁迫最早.含GA3和6-BA的处理Ⅰ与处理Ⅱ大幅度上升的时期均晚于CK处理,且处理Ⅱ相比处理Ⅰ增加趋势相对缓和.这说明含GA3,6-BA的保鲜剂均能有效延缓减轻切花菊在瓶插期间的水分胁迫,且6-BA的效果好于GA3.

图2 保鲜液处理对切花菊小花中丙二醛和游离脯氨酸含量的影响Fig.2 Effects of preservatives on MDA and free proline content in the ray florets of cut Chrysanthemum
2.4 GA3和6-BA处理对切花菊叶片中叶绿素含量和小花中可溶性蛋白含量的影响
由图3-a可知,在瓶插过程中,切花菊叶片叶绿素含量呈逐渐下降趋势,保鲜剂可延缓叶绿素的降解速度.CK处理的叶片叶绿素含量在第5天达到最大值,出现时间最早.处理Ⅰ和处理Ⅱ均在第7天达到最大值,都有较好的保绿效果,且处理Ⅱ的叶绿素含量均高于CK与处理Ⅰ.第13天以后处理Ⅰ和处理Ⅱ之间差异达到显著水平(P<0.05).与同期CK相比,处理Ⅰ和处理Ⅱ叶片中叶绿素含量最大分别提高7.35%和12.29%.
由图3-b可知,前3 d,CK与处理Ⅰ和处理Ⅱ之间差异不显著,且可溶性蛋白质含量均逐渐升高.在整个瓶插期间,处理Ⅰ和处理Ⅱ的可溶性蛋白含量均高于CK处理.第7天后,处理Ⅰ和处理Ⅱ之间差异加大,处理Ⅰ蛋白质含量下降较快,处理Ⅱ的含量明显高于处理Ⅰ,说明6-BA可有效的缓解蛋白质含量的降解.与同期CK相比,GA3和6-BA处理叶片中可溶性蛋白质含量最大分别增加22.15%和 23.01%.试验数据表明,含 GA3,6-BA的保鲜剂均能有效减轻切花菊在瓶插期间叶绿素和蛋白质含量的下降,且瓶插后期6-BA处理的效果显著高于GA3处理.

图3 保鲜液处理对切花菊叶片中绿素含量和小花中可溶性蛋白含量的影响Fig.3 Effects of preservatives on chlorophyll content in the leaves and soluble protein content in the ray florets of cut Chrysanthemum
2.5 GA3和6-BA处理对切花菊切花菊小花中SOD和CAT活性的影响
由图4可知,在切花菊瓶插过程中,各处理的SOD和CAT活性均表现为先上升后下降的趋势,但变化幅度不同.处理Ⅰ和处理Ⅱ相比CK处理均能有效提高切花菊小花中SOD和CAT的活性,缓解其下降速度,处理Ⅱ小花中的SOD和CAT活性增幅最大,下降也比处理Ⅰ缓慢.SOD和CAT能够清除植物体内的活性氧、保护细胞膜,其活性的大小与植物抗病、抗逆境胁迫、抗衰老等有关.含GA3和6-BA的处理均能增大SOD和CAT活性,从而提高了切花菊清除自由基的能力,含6-BA的保鲜剂处理效果最好,这与6-BA处理的切花菊瓶插寿命最长相符合.
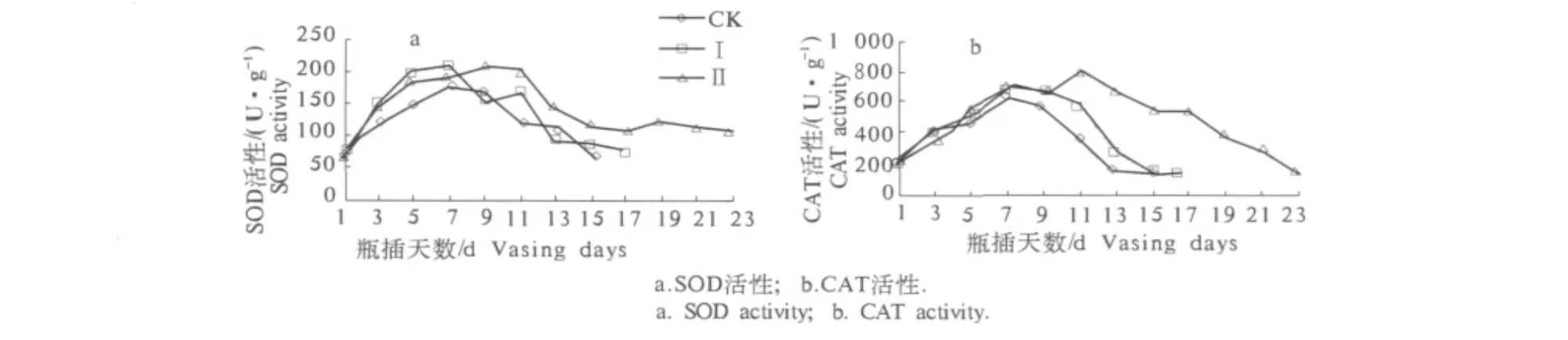
图4 保鲜液处理对切花菊小花SOD活性和CAT活性的影响Fig.4 Effects of preservatives on SOD activity and CAT activity in the ray florets of cut Chrysanthemum
3 讨论
鲜切花在采摘后就脱离了母株,失去了能量和水分来源,在瓶插期间逐渐失水萎蔫、走向衰老,主要原因是瓶插期间水分的胁迫、能源的缺乏、乙烯的生成及真菌、细菌的滋生等[9].本试验以黄色切花菊品种‘夏黄’为试材,在基本保鲜液(20 g·L-1S+200 mg·L-18-HQ+200 mg·L-1CA)的基础上,分别加入 GA3,6-BA,KT,PP333等 4 种不同植物生长调节剂,研究其保鲜效果;结果发现,6-BA和GA3处理的效果较好,并以此为基础,以基本保鲜液为对照(CK),进一步研究了GA3和6-BA对切花菊生理变化的影响.在整个瓶插过程中,6-BA和GA3的综合保鲜效果较为理想,6-BA在延长切花菊瓶插寿命方面效果最好,整体观赏性也最高,但在增大花径方面不如GA3.
试验数据表明,6-BA和GA3均能有效缓解切花菊瓶插期间的水分胁迫,维持其体内的水分平衡,增加切花鲜重,这与在黄花石蒜等切花上的一些研究结果相同[2,10].脯氨酸含量的增加是植物受到逆境伤害的征兆,而MDA含量的不断积累会导致膜结构及生理完整性的破坏,进而加速衰老[11].与同期 CK(基本保鲜液)相比,6-BA 和 GA3处理的 MDA 含量分别低0.082 ~2.348 μmol·g-1和 0.231 ~1.412 μmol·g-1,游离脯氨酸含量分别低 0.180 ~24.983 和 1.433 ~10.583 μg·g-1,这说明6-BA和GA3有效缓解了切花菊瓶插期间MDA和游离脯氨酸的积累.可溶性蛋白质是维系植物生命的重要基础物质,其含量的下降被认为是植物衰老的一个重要指标[12].叶绿素含量的下降则促进了叶片的衰老,而HALERY[13]指出叶片亦是切花重要的质量指标.6-BA和GA3处理与同期CK相比,可溶性蛋白含量最大分别增加23.01%和22.15%,叶片中叶绿素含量最大分别提高12.29%和7.35%,这表明6-BA和GA3能有效减缓切花菊小花中蛋白质含量和叶片中叶绿素含量的下降.活性氧会造成膜脂过氧化,发生膜渗漏,从而引起切花衰老.SOD和CAT在清除活性氧中起着关键作用,它们共同作用消除植物体内活性氧的伤害,SOD和CAT活性越强,说明其清除活性氧自由基的能力也越强.6-BA和GA3有提高SOD和CAT活性的作用,从而可延长切花菊的瓶插寿命.切花菊在瓶插期间,SOD和CAT均表现为先上升后下降的趋势,这与百合等切花上的研究结果相似[14,15].综上所述,植物生长调节剂 6-BA 和 GA3在切花菊保鲜上用量少,且效果明显,对瓶插期间切花菊外观形态和生理功能的保持具有促进作用,在切花菊保鲜上具有一定的应用前景.
[1] 孙向丽,张启翔,潘会堂.菊花采后生理与技术研究进展[J].西北林学院学报,2006,21(6):84-89.
[2] 刘 丽,曾长立,康六生,等.6-BA和 GA3配伍对百合切花保鲜效果的影响[J].江汉大学学报:自然科学版,2009,37(2):102 -105.
[3] 章玉平,罗剑雄,刘靖国.GA3等5种植物生长调节剂对睡莲切花的保鲜效应[J].园艺学报,2004,31(3):392-394.
[4] 王慧娟,孟月娥,赵秀山,等.几种植物生长调节剂对紫罗兰切花的保鲜效应[J].中国农学通报,2008,24(2):269-271.
[5] MACNISH A J,JING C Z,REID M S.Treatment with thidiazuron improves opening and vase life of iris flowers[J].PostharvestBiology and Technology, 2010,56:77-84.
[6] 郭维明,章志红,房伟民.6-BA对切花菊瓶插期间生理效应的调节[J].园艺学报,1997,24(4):364 -368.
[7] 郭碧花.SA对黄色菊花切花的保鲜效应研究[J].西华师范大学学报:自然科学版,2009,30(1):97-99.
[8] D HONT K,LANGESLAG J,DAHLHAUS B L.The effect of different growth regulators and chemical treatments used during postharvest for preserving quality of Chrysanthemums[J].Acta Hort,1991,298:211 - 214.
[9] PETRIDOU M,VOYIATZI C,VOYIATZIS D.Methanol,ethanol and other compounds retard leaf senescence and improve the vase life and quality of cut Chrysanthemum flowers[J].Postharvest Biology and Technology,2001,23:79 -83.
[10]胡小京,耿广东,张素勤,等.6-BA对黄花石蒜切花保鲜效果的影响[J].西南师范大学学报:自然科学版,2009,34(5):129 -132.
[11] HALLIWELL B.The structure and function of chloroplasts in green leaves cell[M].Oxford:Charend on Press,1981.
[12] HALEVY A H,MAYAK S.Senescence and postharvest physiology of cut flowers:Part 21[J].Horticulture Review,1981,3:59 -143.
[13]HALERY A H.Objective and subjective parameters of quality evaluation of cut flower[J].Acta Hort,1989,261:227-231.
[14]薛秋华,孙 玲,潘东明.百合切花衰老过程中生理变化初报[J].中国农学通报,2005,21(11):180 -182.
[15]李 霞,张玉刚,郑国生,等.芍药切花瓶插期衰老进程及膜脂过氧化研究[J].园艺学报,2007,34(6):1491-1496.
