hTERT反义寡核苷酸对子宫内膜癌细胞增殖的影响
2012-05-09杨蓉娟许艳蕾刘雪芹魏丽莉
杨蓉娟,许艳蕾,刘雪芹,魏丽莉
(河北省石家庄市第四医院妇产科,河北石家庄 050011)
hTERT反义寡核苷酸对子宫内膜癌细胞增殖的影响
杨蓉娟,许艳蕾,刘雪芹,魏丽莉
(河北省石家庄市第四医院妇产科,河北石家庄 050011)
目的探讨人端粒酶催化亚基(human telomerase reverse transcriptase,hTERT)反义寡核苷酸对子宫内膜癌细胞增殖的影响。方法反义寡核苷酸转染ishikawa细胞系,采用TRAP-ELISA法检测转染后细胞端粒酶的活性,观察其前后的变化。MTT法检测细胞活性,流式细胞仪观察细胞周期及细胞凋亡率变化。结果转染细胞的端粒酶活性及细胞生长都明显受到抑制。流式细胞仪检测到细胞凋亡峰,细胞阻滞于使细胞停滞在G0~G1期,并诱导细胞凋亡,正义寡核苷酸则无此作用。结论端粒酶hTERT为靶点的反义寡核苷酸可明显抑制子宫内膜癌细胞的增殖,且具有促凋亡作用。
端粒,末端转移酶;寡核糖核酸类,反义;细胞凋亡
子宫内膜癌是妇科常见的三大恶性肿瘤之一,是危害女性健康的常见恶性肿瘤之一,由于激素替代治疗的广泛应用,发病率逐年上升,长期雌激素对子宫内膜的持续作用是引起子宫内膜癌的主要危险因素,同时多基因遗传也参与了子宫内膜癌的发病。近来端粒-端粒酶机制成为肿瘤研究的新热点,端粒酶通过催化端粒合成,保持端粒长度而维持细胞分裂能力,其活性与细胞增殖衰老及肿瘤分化、浸润、转移能力密切相关[1]。人端粒酶催化亚基(human telomerase reverse transcriptase,hTERT)基因是决定端粒酶活性最重要的催化亚基。有研究[2]表明,95%子宫内膜癌组织的端粒酶阳性,内膜癌的形成可能和端粒酶的异常激活有关。所谓反义核酸技术是一种根据碱基互补原则,用人工合成或生物合成的与特定的基因互补的DNA或RNA片段(或其化学修饰物)阻断从基因到蛋白的信息流,从而达到抑制或阻断基因表达的技术。反义寡核苷酸是一类人工合成或构建的重组载体表达的寡核苷酸片段,通过碱基互补的原理,干扰基因的解旋、复制、转录、mRNA的剪接、加工、翻译等各个环节,从而调节细胞的生长、分化等。我们采用针对hTERT基因的反义寡核苷酸(antisense oligodexynucleotides,ASODN)转染子宫内膜癌细胞株ishikawa,观察其对细胞的生长抑制作用及其机制,探讨子宫内膜癌基因治疗的新方法。
1 材料与方法
1.1 hTERT反义寡核苷酸的设计合成:从基因库中查出hTERT反义寡核苷酸的碱基序列,设计出互补于起始密码子区的反义片段,选择起始密码子上游6个碱基及后续的14个碱基,共20个碱基长度为作用的靶序列的ASODN另外合成一段hTERT基因的正义寡核苷酸(sense oligodexynucleotides,SODN)作为对照,每一条链均进行全硫代修饰。由北京赛百盛基因技术有限公司合成,寡核苷酸贮藏于-20℃冰箱中备用,使用时用双蒸水溶解稀释成所需浓度。
1.2 细胞培养与转染:子宫内膜癌细胞株购于北京医科大学第一医院实验室,于10%新生牛血清(56℃灭活30min)、100U/mL青霉素、100U/m L链霉素的RPMI-1640培养基中,在37℃、5%CO2饱和湿度的恒温培养箱中培养。细胞贴壁生长,0.25%胰酶消化,每周传代2~3次,实验所用细胞保持在对数生长,分为反义寡核酸组、正义寡核酸组、空白对照组。分别加入含10%新生牛血清RPMI-1640培养液并加入不同浓度的寡核苷酸,终浓度分别为2.5、5、10μmol/L,每孔设3个复孔。空白对照组加入等量的培养液。24h更换相应浓度的寡核苷酸1次。
1.3 端粒酶活性的测定:端粒酶活性的检测用PCR-ELISA方法。按照试剂盒说明书进行操作。取反应管,实验分空白组、反义寡核酸组5μmol/L、正义寡核酸组5μmol/L,分别于转染24、48、72h后按以上方法处理细胞,取TRAP反应模板,各加入45μL反应混合物,加入2μL已处理的标本,混匀,加入30μL液体石蜡,置25℃水浴保温30min,在PCR仪上循环,94℃120s,94℃30s,48℃30s,72℃90s,72℃300s循环35次,循环结束后,在微孔中加入杂交反应液,再加入扩增产物25μL混匀,设立阴阳及空白对照,置37℃恒温反应60min。然后加入显色剂A、B。37℃避光显色10min,加入终止液,终止反应。在波长450nm读取OD值。
1.4 凋亡细胞和细胞周期的检测:采用碘化丙啶(propidumiodide,PI)一步插入法DNA定量荧光染色法,染液中含PI 50ng/m L。上机检测前去除样本中70%乙醇,调整每份样品的细胞数为1×106/mL,每样品中加入DNA染液1mL,在40C冰箱中染色30min,以300目筛网过滤成单细胞悬液。应用FACS-420型流式细胞仪分析细胞凋亡率和细胞周期,每份样本检测1万个细胞,每组共检测3个样本,重复3遍。DNA细胞周期则通过B.D公司提供的相应流式细胞分析软件,计算出细胞周期各时相分布百分比,依据细胞时相分布计算出细胞增殖指数,其公式为,PI=[(S+G2M)/(G0+S+G2M)]× 100%。
1.5 细胞增殖抑制实验:实验分为反义组、正义组、空白对照组。分别加入含10%新生牛血清RPMI-1640培养液并加入不同浓度的寡核苷酸,终浓度分别为5、10、15μmol/L,每孔设3个复孔。空白对照组加入等量培养液。24h更换相应浓度的寡核苷酸1次。分别于转染后24、48、72h,在培养皿中按培养液量的10%加入MTT溶液,继续培养4h吸尽培养液,加入与培养液相同量的DMSO,然后振荡10min,使结晶充分溶解。立即于自动酶标仪492nm波长测定各孔A值。
1.6 统计学方法:应用SPSS10.0统计软件进行单因素方差分析,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 hTERT反义核苷酸对子宫内膜癌ishikawa细胞的增殖影响:采用MTT法测定细胞增殖抑制率可知反义核苷酸组细胞生长明显出现抑制,与反义核苷酸作用的浓度和时间呈依赖性。2.5μmol/L反义寡核苷酸作用于细胞24h其细胞增殖抑制率为19.11%,与正义组细胞增殖抑制率6.41%相比差异有统计学意义(P<0.01)。随作用时间延长抑制率增加,作用72h其抑制率为42.70%。随作用浓度的增加其抑制率增加,10μmol/L反义寡核苷酸作用于细胞72h其增殖抑制率为68.80%,最为显著,与相同浓度的正义组细胞增殖抑制率11.40%相比差异有统计学意义(P<0.01)。不同浓度反义寡核苷酸作用于相同时间,反义组之间比较差异有统计学意义(P<0.05)。提示hTERT反义核苷酸对子宫内膜癌ishikawa细胞的生长有明显抑制作用。见表1。
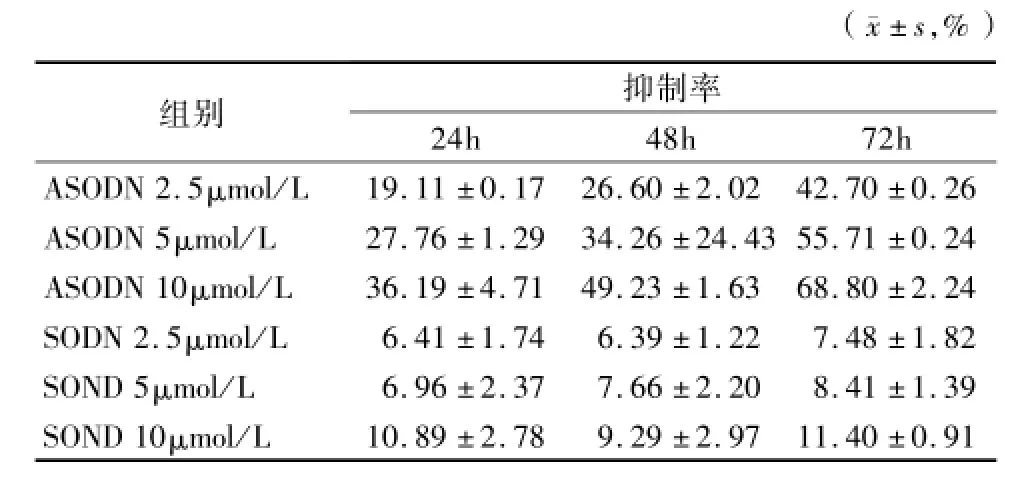
表1 hTERT反义寡核苷酸对子宫内膜癌细胞增殖抑制率比较
2.2 ASODN对子宫内膜癌ishikawa细胞端粒酶活性的影响:ASODN对子宫内膜癌ishikawa细胞端粒酶活性的抑制作用随着作用时间的延长而增强。在72 h端粒酶活性由0.855±0.025降至0.247± 0.01,抑制作用显著(P<0.01)。而空白组及正义寡核苷酸组则无明显抑制作用。
2.3 流式细胞仪检测:hTERT反义核苷酸对子宫内膜癌ishikawa细胞凋亡和细胞周期的影响:用流式细胞仪检测到不同浓度的反义核苷酸作用于子宫内膜癌细胞48h后出现了一群亚G1期细胞即凋亡细胞,随反义核苷酸作用浓度的增加细胞凋亡率越来越高。2.5~10μmol/L不同浓度反义核苷酸细胞凋亡率分别为12.46、18.24、26.65,差异有统计学意义(P<0.01)。在同一浓度条件下反义组与正义组及空白组细胞凋亡率相比较,差异有统计学意义(P<0.01),而正义组与空白组差异无统计学意义(P>0.05)。进一步用流式细胞仪分析细胞周期发现hTERT反义核苷酸对细胞周期有明显影响,与正义组和空白组相比,反义组细胞G0~G1期细胞增多,S期细胞和G2~M期细胞减少,差异有统计学意义(P<0.01)。并呈浓度依赖性。增殖指数在同一作用浓度,反义组与正义组和空白组相比,差异有统计学意义(P<0.05),不同作用浓度,反义组之间比较差异有统计学意义(P<0.01)。而正义寡核酸组与空白对照组相比较差异无统计学意义(P> 0.05)。说明hTERT反义核苷酸明显抑制子宫内膜癌细胞ishikawa增殖,与细胞增殖抑制实验结果相符合。见表2,3。
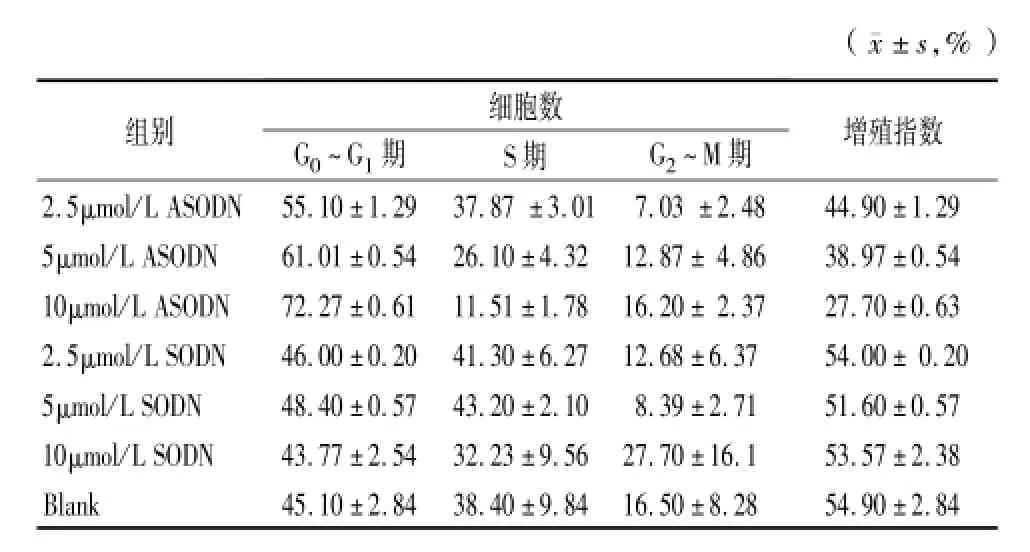
表2 hTERT反义核苷酸对子宫内膜癌ishikawa细胞周期的影响

表3 hTERT反义寡核苷酸作用于细胞48h细胞凋亡率比较
3 讨 论
反义核酸技术是用人工合成的或生物合成的特定互补的DNA或RNA片段阻断从基因到蛋白的信息流,以达到抑制或阻断基因表达的生物新技术。20世纪80年代早期人们发现细菌内的一类基因组DNA自发转录的反义RNA,通过碱基互补原理与靶RNA(主要是mRNA)配对结合抑制靶RNA的功能,从转录水平和翻译水平调节相关基因的表达,发挥其生物学作用。随着研究的深入,反义核酸技术迅速地发展起来,反义寡核苷酸其优点在于高度靶特异性(碱基互补)、设计多样、合成容易及高度的局部性和针对性,是常规药物的设计、生产、作用所不能比拟的。
端粒酶由蛋白催化亚基和指导端粒合成的RNA模板组成,即为具有逆转录酶特性的核蛋白酶[1]。端粒酶的主要组分为:①端粒酶催化亚单位。②RNA分子或端粒酶RNA,它包含了添加端粒酶重复结构的模板区。人类hTR已被克隆。③大量的端粒酶相关蛋白。hTERT是一个最近才被克隆出来的单拷贝基因,其基因组含有逆转录酶催化区域高度保守的特异序列。端粒是真核线形染色体末端结构,由端粒DNA和端粒结合蛋白组成。它由一端高度保守的重复序列(TTAGGG)n组成,方向5′—3′,长度5~15kb[2],端粒长度的维持需要端粒酶的激活。自身携带模板是端粒酶区别于一般的纯蛋白逆转录酶的主要特征之一。国外学者[3]对乳腺癌、卵巢癌、肺癌、膀胱癌、食管癌等进行广泛深入研究。实验说明hTERT基因反义寡核苷酸能以序列特异性方式抑制hTERT的表达,从而抑制端粒酶的活性,也说明了hTERT与端粒酶活性密切相关,hTERT可能是反义核酸治疗的另一个非常好的靶基因。hTERT基因的mRNA全部序列,根据hTERT基因mRNA的序列分析,设计出互补于起始密码子区的反义片段,选择起始密码子上游6个碱基及后续的14个碱基,共20个碱基长度为作用的靶序列。hTERT ASODN的序列为5′-GGAGCGCGCGGCATCGCGGG-3′;另外合成一段hTERT基因的正义寡核苷酸(sense phosphorothioate oligodeoxynucleotide,SODN)序列作为对照,正义链序列为5′-CCCGCGATGCCGCGCGCTCC-3′,均经计算机网上检索证实与hTERT基因以外的已知人类基因无同源性。每一条链均对其进行全硫代修饰。本实验结果显示,通过MTT发现2.5μmol/L反义核苷酸作用于96孔板,每孔细胞浓度1×104/mL后24h后细胞生长受到抑制,抑制率为其抑制作用并随作用时间和作用浓度的增加而加强;10μmol/L作用72h时抑制率为抑制效果最强,与正义组与空白组相比差异有统计学意义(P>0.05),而正义组与空白组相比差异无统计学意义,细胞生长不受影响。说明hTERT反义寡核苷酸能抑制子宫内膜癌ishikawa细胞的生长。一些学者[4]认为,端粒酶抑制剂对细胞的增殖抑制可能与诱导凋亡有关。端粒酶活性被抑制导致一些已经处于极短的端粒不能维持功能,细胞染色体发生断裂、融合、DNA破坏,触发细胞凋亡[5]。研究凋亡最敏感的方法是流式细胞仪检测。用FCM检测细胞凋亡率与细胞周期发现反义核苷酸作用于内膜癌细胞48h后可测到凋亡峰,细胞凋亡时形成的DNA碱基片段于G1期前形成的亚峰,即凋亡峰。而正义组与空白组未见明显的凋亡峰。细胞周期是细胞生长、分裂时,依次经过G1、S、G2、M期,一分为二,周而复始的过程,称之为细胞分裂周期。FCM结果表明反义组细胞G0~G1期细胞增多,S期和G2~M期细胞减少,增殖指数也随之减少,并呈浓度依赖性。与正义组和空白组相比差异有统计学意义(P<0.01)。正义组和空白组相比差异无统计学意义(P>0.05)。研究[6]发现,端粒酶活性是细胞周期依赖性调控。端粒酶在DNA复制期激活,以保持端粒延长,因此,在细胞周期中,端粒酶活性经G1~S期逐渐升高,S期最高,G2~M最低,G0~G1期几乎处于静止期。实验证明hTERT反义寡核苷酸在细胞进入DNA合成期前引起DNA损伤,使细胞停滞在G0~G1期,并诱导细胞凋亡[7]。
自从1992年美国食品与药品管理局首次批准反义药物用于临床治疗以来,反义技术成为研究的热点。大多数恶性肿瘤细胞依靠端粒酶维持不断复制增生,端粒酶抑制剂有可能成为肿瘤治疗的新策略。反义技术应用于临床有明显的优势,反义寡核苷酸针对性强,特异性高,几乎可以完全阻断靶基因的翻译,具有良好的抑制效果。端粒酶应用于临床仍有许多问题有待解决。但是人们依然相信在将来肿瘤治疗策略的研究中,端粒酶将起着十分重要的作用。
[1] CAIRNEY CJ,HOARE SF,DAIDONE MG,et al.High level of telomerase RNA gene expression is associated with chromatin modification,the ALT phenotype and poor prognosis in liposarcoma[J].Br JCancer,2008,98(8):1467-1474.
[2] SHAMMAS MA,KOLEY H,BATCHU RB,et al.Telomerase inhibition by RNA causes senescence and apoptosis in Barrettsˊ adenocarcino-ma cells:mechanism and therapeutic potentia[J]. Mol Cancer,2007,15(4):24.
[3] ASTEC/EN 5 STUDY GROUP,BLAKE P,SWART AM,et al. Adjuvant external beam radiotherapy in the treatment of endometrial cancer(MRC ASTEC and NCIC CTG EN.5 randomised trials):pooled trial results,systematic review,and meta-analysis[J].Lancet,2009,373(9658):137-146.
[4] CHEN M,YANG B,ZHANG X.Effects of telomerase activity on carcinogenesis and survival in laryngeal carcinoma[J].Int Med Res,2008,36(2):336-342.
[5] GLOVER L,ALSFORD S,BEATTIE C,et al.Deletion of a trypanosome telomere leads to loss of silencing and progressive loss of terminal DNA in the absence of cellcycle arrest[J].Nucleic Acids Res,2007,35(3):872-880.
[6] TONOOKA K,KABSHIMA T,SHIBATA T,et al.Facile assay of telomerase activity utilizing a DNA-detectable chemiluminogenic reagent[J].Anal Sci,2008,24(4):471-475.
[7] KIM IS,SONG YM,CHO TH,et al.Synergistic action of static stretching and BMP-2 stimulation in the osteoblastdifferentiation of C2C12myoblasts[J].JBiomech,2009,42(16):2721-2727.
(本文编辑:刘斯静)
R737.33
B
1007-3205(2012)07-0832-04
2012-04-17;
2012-05-20
杨蓉娟(1977-),女,河南林州人,河北省石家庄市第四医院主治医师,医学硕士,从事妇产科疾病诊治研究。
10.3969/j.issn.1007-3205.2012.07.033
