功能性饮料中11种水溶性维生素的高通量检测技术研究
2012-05-08李强,李挥,庞坤,俞婧,夏静
李 强,李 挥,庞 坤,俞 婧,夏 静
(河北省食品质量监督检验研究院,河北 石家庄 050091)
维生素是人和动物为维持正常生理功能而必需从外界食物中获取的一类微量有机物质,分为脂溶性和水溶性两类。功能性饮料是通过调整饮料中天然营养素的成分和含量比例以适应某些特殊人群营养需求的饮品,其中多添加各种水溶性维生素,主要包括有:维生素B1、维生素B2、吡哆胺、吡哆醛、吡哆醇、泛酸、烟酸、烟酰胺、生物素、叶酸、维生素B12[1-2]。目前国家标准(GB/T5009)中只规定了其中几种维生素的单项单次检测方法[3],由于水溶性维生素多以离子形态存在于水溶液中,多采用的离子对试剂作为流动相这样会在不同程度对色谱柱及泵造成破坏[4]。且大多数报道中[5-8]只针对5~8种维生素进行研究,且报道中由于样品的不同,实验的具体步骤和分离效果也有很大的不同[9-10]。
目前对水溶性维生素检测方法的研究主要有微生物法、荧光光度法、HPLC法及HPLC-MS/MS法[11]。其中HPLC法及HPLC-MS/MS法具有一定的优越性,且已成为维生素分析的主流方法。但考虑到HPLC法更具有普遍性和便捷性,本研究采用HPLC法进行试验,此外考虑对色谱柱的保护,未使用离子对试剂为流动相,而采用甲醇和磷酸二氢钾进行梯度洗脱,结合DAD检测器和荧光检测器进行测定。该方法具有快速、简便、准确、灵敏等特点,应用于大规模的产品检测具有一定的意义。
1 材料与方法
1.1 材料与仪器
维生素B1、维生素B2、吡哆胺、吡哆醛、吡哆醇、泛酸、烟酸、烟酰胺、生物素、叶酸、维生素B12标准品(Sigma公司,纯度>99%);甲醇,乙醇为色谱纯;其余所用试剂均为分析纯;实验用水为密理博纯水机制得。
液相色谱仪(美国,Aglient 1200)、固相萃取装置(美国安捷伦公司);AS超声波清洗器(天津奥特赛恩斯仪器有限公司);RT15T高速冷冻离心机(上海天美公司);AE 200分析天平(法国Mettler公司);氮吹仪(Organomation Associates,Jnc.);涡流振荡器(德国IKA公司);C18固相萃取柱(60mg/3ml,美国安捷伦公司)。
1.2 实验方法
1.2.1 色谱条件
色谱柱:Diamonsil C18反相色谱柱(150×4.6μm,5μm);流动相:甲醇和0.05mol/L磷酸二氢钾溶液梯度洗脱,洗脱程序见表1;流速:0.6mL/min;
二极管阵列检测器检测波长:维生素B1(280nm)、泛酸(210nm)、烟酸(261nm)、烟酰胺(261nm)、生物素(210nm)、叶酸(362nm)、维生素B12(261nm);
荧光检测器检测波长:维生素B2(λex=462nm,λem=522nm)、吡哆胺(λex=293nm,λem=355nm)、吡哆醛(λex=293nm,λem=355nm)、吡哆醇(λex=293nm,λem=355nm)、进样量:20μL;柱温:40℃;运行时间:30min。
1.2.2 标准溶液的制备
维生素标准贮备液:维生素B1、吡哆胺、吡哆醛、吡哆醇、泛酸、烟酸、烟酰胺、维生素B12、生物素标准贮备液(1g/L,0.01mol/L HCl);维生素 B2(0.1g/L,以少量氨水溶解后用水定容);叶酸(1g/L,以少量稀KOH溶解后,用0.01mol/L HCl定容)。贮备液于4℃冰箱保存,将标准贮备液稀释成不同浓度的混合标准使用液,需临用现配。
1.2.3 样品处理
为去除饮料中干扰成分,采用固相萃取来进行提取和净化,取5mL样品加入20mL磷酸溶液,超声振荡5min后,加入活化好的固相萃取小柱,离心后依次用pH4.2的水和10mL甲醇洗脱溶出。溶出液氮气吹干后溶解并定容至1mL流动相中,过膜备用。
2 结果与讨论
2.1 色谱条件的优化
2.1.1 测定波长的选择
对11种水溶性维生素分别在190nm~600nm做紫外光谱扫描,得到各物质的最大吸收波长:维生素B1(265nm)、维生素 B2(375nm)、吡哆胺(261nm)、吡哆醛(261nm)、吡哆醇(261nm)、泛酸(200nm)、烟酸(261nm)、烟酰胺(261nm)、生物素(200nm)、叶酸(280nm)、维生素B12(261nm);分别对维生素B2、吡哆胺、吡哆醛、吡哆醇混合标准溶液用λex=280nm,λem=380nm;λex=293nm,λem=395nm;λex=320nm,λem=410nm;λex=462nm,λem=522nm条件进行测定。结果表明λex=462nm,λem=522nm是维生素B2的最佳测定条件;λex=293nm,λem=395nm是吡哆胺、吡哆醛、吡哆醇的最佳测定条件。结合上述条件,最终选定1.2.1中的波长做为测定波长。另外为实现11种维生素的同步测定,在设定洗脱程序中加入荧光检测器在15min时由λex=293nm,λem=395nm切换为λex=462nm,λem=522nm。分离色谱图见图1,图2。

图1 梯度洗脱DAD检测210nm时各种维生素的分离色谱图

图2 梯度洗脱荧光检测各维生素的分离色谱图
2.1.2 流动相选择
分离水溶性维生素多用到辛烷磺酸钠等离子对试剂进行洗脱分离,但离子对实际会在一定程度上破坏色谱柱并缩短寿命,因此本实验采用了磷酸盐水溶液(0.05mol/L)和甲醇,结合梯度洗脱。当甲醇比例超过5%时,维生素B5、烟酰胺、烟酸、维生素B1、叶酸会很快流出且峰形重叠,同时甲醇低于40%维生素B2的出峰时间大于30min,因此采用梯度洗脱。经反复实验得到的洗脱程序中0~10min时A∶B=4∶96可使吡哆胺、烟酸、维生素B1、吡哆醛、吡哆醇、烟酰胺得到很好的分离;20~25min时A∶B=40∶60时泛酸、叶酸、维生素B12、生物素、维生素B2进行分离,获得了良好的分离效果。

表1 分离11种水溶性维生素较佳分离洗脱程序
2.2 线性范围和检出限
以标准溶液浓度为横坐标(x),色谱峰面积为纵坐标(y),求得回归方程,回归方程、相关系数及检出限见表2。由表2可以看出,11种维生素线性关系良好,相关系数均大于0.999。
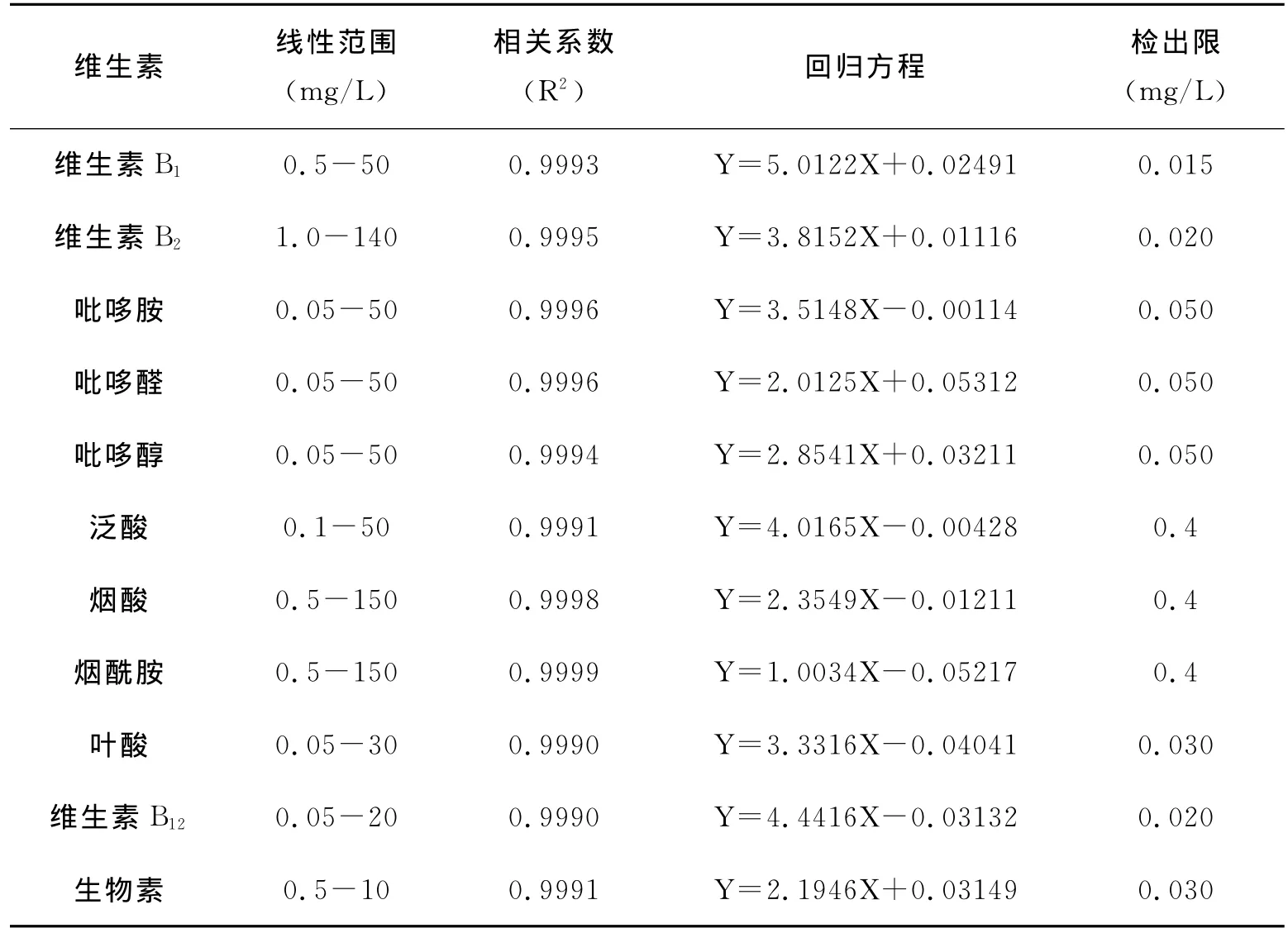
表2 11种水溶性维生素的回归方程、相关系数及检出限
2.3 加标回收实验和精密度实验
对已知浓度的饮料样品进行三个水平的添加回收实验,每个水平重复5次。其平均回收率和RSD值结果见表3所示。表3数据表明,11种水溶性维生素的回收率为93%~107%,相对标准偏差(RSD)为0.3%~3.7%,本方法的回收率与精密度均能满足要求。
2.4 几种饮料的测定结果
运用本方法对市场上购买的3种品牌饮料进行了检测,测定结果见表4。可见其维生素实际含量与产品标注值的相符程度,本方法重复性、灵敏度和准确性都比较满意,操作简便,可满足功能饮料中水溶性维生素日常检验的需要。

表3 回收率实验结果(n=5)
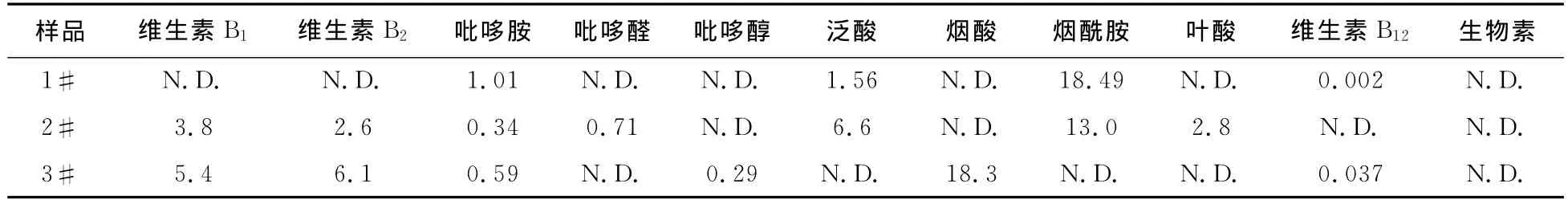
表4 实际样品测定结果 (单位:mg/L)
3 结论
建立了功能性饮料中同时测定11种水溶性维生素的高效液相色谱法。此方法样品处理简单,分离度好,提高了检测的效率,且准确性和重复性,具有一定应用于大规模检测的实际意义。
[1] 常相娜,黄荣清,王正平等.B族维生素测定方法研究进展[J].科学技术与工程,2004,4(4):312-316.
[2] 刘源,翟丽萍,相有章等.维生素分析方法的研究现状及进展[J].中国地方病防治杂志,2006,21(1):29-31.
[3] GB/T5009-2010.食品安全国家标准.
[4] 王一红,冯家力,潘振球等.液相色谱-串联质谱法分析10种水溶性维生素[J].中国卫生检验杂志,2007,17(7):1160-1164.
[5] 成志强,孙成均,黎源倩.反相高效液相色谱法同时测定食品和多维片中8种水溶性维生素[J].分析化学,2001,29(9):1068-1071.
[6] 吴淑君,庄志辉,朱孟丽等.高效液相色谱法测定保健品中的6种水溶性维生素及咖啡因[J].色谱,2006,24(3):319-322.
[7] 李克,王华娟,潘朝辉等.离子对反相高效色谱法同时测定复合维生素片中4种水溶性维生素[J].色谱,2003,21(1):66-69.
[8] Marcin L M,Anna L,Wojcieh C,et al.High performance liquid chromatography method for the simultaneous determination of thiamine hydrochloride,pyridoxine hydrochloride and cyanocobalam in pharmaceutical formulations using coulometric electronchemical and ultraviolet detection[J].J Chramatogrv A,2005,1094:91-98.
[9] 龙州雄,万春花,胡海山.RP-HPLC法同时测定多维胶囊中八种水溶性维生素[J].理化检验-化学分册,2006,42(3):215-218.
[10] 崔蓉,李皎,王洪伟.水溶性维生素的高效液相系统色谱法测定方法的研究[J].中国卫生检验杂志,2005,15(1):55-57.
