硫辛酸对糖尿病周围神经病变的疗效观察
2012-05-08韩瑞平谷春芳
韩瑞平,谷春芳
(1.哈励逊国际和平医院心血管内科,河北省衡水053000;2.哈励逊国际和平医院内分泌科,河北衡水 053000)
·论 著·
硫辛酸对糖尿病周围神经病变的疗效观察
韩瑞平1,谷春芳2
(1.哈励逊国际和平医院心血管内科,河北省衡水053000;2.哈励逊国际和平医院内分泌科,河北衡水 053000)
目的观察硫辛酸(alpha-lipid acid,ALA)治疗糖尿病周围神经病变(diabetic periphery neuropathies,DPN)的临床疗效,以及对氧化应激和内皮功能的影响。方法将120例患者随机分为治疗组60例(ALA 600mg静脉滴注)和对照组60例(灯盏花素40mg/d静脉滴注,维生素B1100mg/d、维生素B12250μg/d肌内注射);并检测治疗前后氧化应激功能指标和血管细胞黏附分(vascular cell adhesion molecular-1,VCAM-1)、细胞间黏附分子(intercelluar adhesion molecular-1,ICAM-1)的水平。结果治疗组肢体疼痛、麻木、发热、发凉以及感觉减退的改善率分别为70.7%、78.7%、58.8%、63.3%、59.4%,均明显高于对照组的34.8%、43.1%、23.8%、29.4%、27.8%(P<0.05),神经传导速度、血流动力学的改善也优于对照组(P<0.05)。ALA可抑制氧化应激反应,降低ICAM-1的水平(P<0.01),升高超氧化物歧化酶活力(P<0.01),降低丙二醛含量(P<0.05),VCAM-1治疗前后差异无统计学意义。结论ALA治疗DPN疗效满意。可抑制DPN患者氧化应激反应及降低ICAM-1水平。
糖尿病神经病变;硫辛酸;治疗结果
糖尿病周围神经病变(diabetic periphery neuropathies,DPN)是糖尿病常见的慢性并发症,患病率高达40% ~50%,严重影响患者生活质量。DPN发生主要是由氧化应激导致的微血管病变和神经损伤引起,目前尚缺乏疗效显著的治疗手段[1-2]。近年来,我院在临床上应用硫辛酸(alpha-lipid acid,ALA)治疗DPN取得一定的效果。本研究旨在观察抗氧化剂ALA对DPN患者的确切疗效,以及ALA对氧化应激和内皮功能的影响,为DPN的治疗寻找新的途径。
1 资料与方法
1.1 一般资料:选择2009年1月—2010年12月在本院住院治疗、按WHO(1999年)标准[3]诊断为2型糖尿病且肌电图检查存在DPN的患者120例。入选患者排除近期服用有抗氧化应激作用的药物如维生素E、维生素C、β-胡萝卜素、谷胱甘肽及调脂药物者;急性感染、肿瘤、肝病、心力衰竭、急性脑梗死及酮症酸中毒者;其他因素引起的神经病变者。参照随机数字表,将患者按入院先后随机分为治疗组60例,男性38例,女性22例,年龄51~76岁,平均(66.3±7.1)岁;对照组60例,男性36例,女性24例,年龄52~79岁,平均(65.2±6.7)岁。2组性别、年龄、症状、病程相比,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法:常规饮食控制加口服降糖药和(或)胰岛素控制血糖在良好的状态,治疗前15d停用止痛药。治疗组ALA 600mg/d加入250mL生理盐水中避光静脉滴注。对照组灯盏花素40mg加入生理盐水250mL静脉滴注,维生素B1100mg、维生素B12250μg肌内注射,1次/d。2组均连续应用2周。
1.3 观察指标:观察治疗组治疗前后糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、超氧化物歧化酶( superoxide dismutase, SOD)、 丙 二 醛(malondiacdehyde,MDA)、血管细胞黏附分子 -1(vascular cell adhesion molecular-1,VCAM-1)、细胞间黏附分子-1(intercelluar adhesion molecular-1,ICAM-1)变化;观察治疗组与对照组治疗前后症状改善、血流动力学、运动神经传导速度(motor nerve conduction velocity,MNCV)、感觉神经传导速度(sensory nerve conduction velocity,SNCV)变化以及不良反应。
1.4 疗效判断:显效,自觉症状明显好转或消失,神经传导速度较前增加或恢复正常;有效,自觉症状有改善,神经传导速度较前略有增加;无效,症状无改善或恶化,神经传导速度无变化。
1.5 统计学方法:应用SPSS16.0软件包进行数据处理,计量资料以±s表示,采用t检验,计数资料以百分率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 ALA治疗前后血糖及血脂水平的变化:ALA治疗后,HbA1c、TG、TC和LDL-C水平均较治疗前有所降低,同时HDL-C水平略有上升,但是差异无统计学意义,见表1。
表1 ALA治疗前后血糖及血脂水平比较(n=60,±s)

表1 ALA治疗前后血糖及血脂水平比较(n=60,±s)
HbA1c:glycosylated hemoglobin;TC:total cholesterol;TG:total glycerin;HDL-C:high density liporotein-cholesterol;LDL-C:low density lipoprotein-cholesterol
组别 HbA1c(%) TC(c/mmol·L-1) TG(c/mmol·L-1) HDL-C(c/mmol·L-1) LDL-C(c/mmol·L-1)治疗前 9.38±1.94 5.11±1.23 2.01±0.61 1.17±0.32 2.5 1±0.61 5±0.82治疗后 8.87±2.11 4.71±0.92 1.54±0.68 1.40±0.21 2.2
2.2 ALA治疗前后外周神经病变症状改善情况:2组治疗后,肢体疼痛、麻木、发热、发凉以及感觉减退均有不同程度的改善,治疗组明显优于对照组(P<0.05),见表2。

表2 2组治疗后症状改善比较 (n=60,例数,%)
2.3 2组治疗前后血流动力学变化:与治疗前比较,治疗后2组血流动力学指标,如全血黏度、血浆黏度、红细胞压积及纤维蛋白原均明显改善(P< 0.05),且治疗组改善更为显著(P<0.05),见表3。2.4 2组治疗前后神经传导速度变化:治疗组治疗后MNCV及SNCV较治疗前明显增加(P<0.05),以尺神经SNCV改善更显著,治疗组明显优于对照组(P<0.05),见表4。
表3 2组治疗前后血流动力学变化比较(n=60,±s)
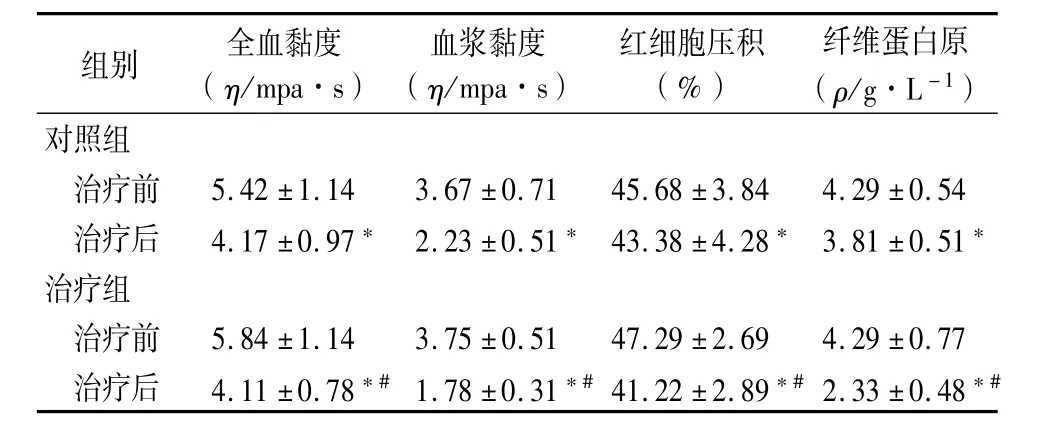
表3 2组治疗前后血流动力学变化比较(n=60,±s)
*P<0.05与治疗前比较 #P<0.05与对照组比较(t检验)
组别 全血黏度(η/mpa·s)血浆黏度(η/mpa·s)红细胞压积(%)纤维蛋白原(ρ/g·L-1)对照组治疗前 5.42±1.14 3.67±0.71 45.68±3.84 4.29±0.54治疗后 4.17±0.97* 2.23±0.51* 43.38±4.28* 3.81±0.51*治疗组治疗前 5.84±1.14 3.75±0.51 47.29±2.69 4.29±0.77治疗后 4.11±0.78*#1.78±0.31*#41.22±2.89*#2.33±0.48*#
表4 2组治疗前后神经传导速度变化比较(n=60,±s,υ/m·s-1)

表4 2组治疗前后神经传导速度变化比较(n=60,±s,υ/m·s-1)
*P<0.05与治疗前比较 #P<0.05与对照组比较(t检验)MNC:motor nerve conduction velocity;SNCV:sensory nerve conduction velocity
组别MNCV SNCV尺神经 胫神经 尺神经 胫神经对照组治疗前 43.21±3.22 33.28±3.17 41.31±2.18 33.64±4.28治疗后 46.38±2.18 36.18±5.11 46.49±3.28* 35.29±2.66治疗组治疗前 44.69±4.11 34.29±2.58 41.29±3.29 32.91±3.14治疗后 47.83±3.59*#37.18±2.85*#45.62±2.98*#34.51±2.18*#
2.5 ALA治疗前后氧化应激和内皮功能变化:与治疗前相比,ALA治疗14d后患者SOD活力升高(P<0.01),MDA含量降低(P<0.05),ICAM-1水平降低(P<0.01),VCAM-1治疗后有下降趋势,但差异无统计学意义(P>0.05),见表5。
表5 ALA治疗前后氧化应激和内皮功能指标比较 (n=60,±s)
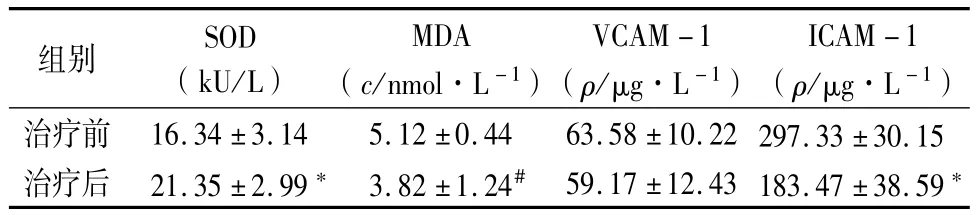
表5 ALA治疗前后氧化应激和内皮功能指标比较 (n=60,±s)
*P<0.01 #P<0.05与治疗前比较(t检验)SOD:superoxide dismutase;MDA:malondiacdehyde;VCAM-1:vascular cell adhesion molecular-1;ICAM-1:intercelluar adhesion molecular-1
组别 SOD(kU/L)MDA(c/nmol·L-1)VCAM-1(ρ/μg·L-1)ICAM-1(ρ/μg·L-1)治疗前 16.34±3.14 5.12±0.44 63.58±10.22 297.33±30.15治疗后 21.35±2.99* 3.82±1.24# 59.17±12.43 183.47±38.59*
2.6 不良反应:治疗组20例出现疼痛、皮肤发红,疗程结束以后症状均消失,对照组无明显不良反应。
3 讨 论
糖尿病神经病变的发病机制复杂,线粒体超氧化物产生过多是导致糖尿病慢性并发症的共同机制,这为抗氧化物治疗提供了理论依据。ALA被誉为“万能抗氧化剂”,在生物体内可清除自由基和活性氧,螯合金属离子,维持机体正常的抗氧化剂水平,共同发挥生物抗氧化作用[5]。SOD能清除超氧阴离子保护细胞免受损伤,其对机体氧化与抗氧化的平衡起至关重要的作用[5]。研究[6]发现ALA可明显抑制高糖引起的活性氧产物增加。MDA是脂质过氧化产物,可反映体内脂质过氧化的程度。本研究结果显示,ALA治疗后患者SOD活力显著升高,血清MDA含量明显减少。提示ALA可以提高抗氧化应激的能力,清除过氧化脂质,保护细胞免受损伤。
DPN起病隐匿,进展缓慢,其主要病理改变是神经纤维发生节段性脱髓鞘,轴索再生能力受损而出现“退化”[6-7],特点为感觉神经受累较早,临床表现为肢体麻木、疼痛等,其发病机制目前有以下观点:①血糖水平升高,引起神经组织非酶促作用使糖尿病患者神经受损;②血液黏稠度增高,使神经微血管血流减慢,诱发血栓形成,导致周围神经缺血、缺氧;③脂肪代谢紊乱,不但直接损坏神经细胞的结构和功能,而且还减少舒血管因子的产生,对髓鞘本身的修复有一定影响,因此治疗的关键就是降低血黏度,疏通微循环,增加血流量,从而改善缺血缺氧状态,增加营养神经的血液灌流[8]。本研究结果显示,ALA作为一种强效抗氧化剂,其临床疗效明显优于对照组,在神经传导速度及血流动力学改善方面亦优于对照组,对肝肾功能无损伤。
糖尿病患者长期高血糖形成糖基化终产物(advanced glycation end products,AGEs),导致内皮功能损伤进而出现血管细胞因子和趋化因子的激活,后者又激活细胞表面黏附因子的表达如VCAM-1、ICAM-1[2],导致微循环障碍,形成缺血-炎症的恶性循环,加速糖尿病神经病变的发生和发展[9]。研究[10]证实,ALA对肿瘤坏死因子-α和AGEs等引起的核因子-κB的活化有很强的抑制作用,可使细胞黏附分子ICAM-1和VCAM-1的表达下调,减少内皮细胞因子和内皮素的表达,缓解内皮功能紊乱。本研究显示,ALA治疗2周后DPN患者中ICAM-1水平明显下降。提示ALA可以保护血管内皮细胞不受AGEs所诱导的氧化应激损伤,缓解内皮功能紊乱,减慢神经病变的进展。这为ALA在临床的应用提供了新的证据。本研究还显示VCAM-1在ALA治疗后有下降趋势,但差异无统计学意义。考虑与DPN中VCAM-1、ICAM-1有不同的贡献[11-12],或者ALA对VCAM-1、ICAM-1作用不同有关[13-15]。此外,在临床应用中,还需要关注水针和冻干粉针的差别。以水针形式制成的ALA从生产到患者使用都呈液体状态,这种剂型生产成本较低,但稳定性差、有效期较短;而且因为水针剂型需要稳定剂苯甲醇、乙二胺等,可能引起输液反应等不良反应。而冻干粉针剂型的ALA药物保存稳定性好、不易变质,有效期显著延长,一般可达3~4年;且无任何添加剂,对患者安全性显著提高。故在临床应用中优先选择冻干粉针剂型的ALA。
[1] 龚小花,郑景晨.氧化应激与糖尿病神经病变[J].国际内分泌代谢杂志,2006,26(增刊):16-18.
[2] BROWNLEE M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414:813-820.
[3] 李雪莉,姜亚云,张景玲,等.WHO与美国糖尿病学会糖尿病诊断标准的异同[J].中华内分泌代谢杂志,2000,16(2):89 -90.
[4] 黄涛,黄开勋.α-硫辛酸的生物医学功能[J].生命的化学,2004,24(11):58,59-60.
[5] VINCENT AM ,MCLEAN LI,BACKUS C,et al.Shorterm hyperglycem ia produces oxdative damage and apoptosis in neurons[J].FASEB J,2005,19:638-640.
[6] BAYDAS G,DONDER E,KILIBOZ M,et al.Neuroprotec tion by alpha-lipoic acid in streptozotocin-induced diabetes[J]. Biochemistry(MOSC),2004,69(9):1001-1005.
[7] SINGH N,ARMSTRONG D G,LIPSKY B A.Preventing foot ulcers in patients with diabetes[J].JAMA,2005,293(2):217-228.
[8] 《中国糖尿病防治指南》组.中国糖尿病防治指南[M].北京:北京大学医学出版社,2004:2-7.
[9] 李仕明.糖尿病足(肢端坏疽)检查方法及诊断标准(草案)[J].中国糖尿病杂志,1996,4(2):126.
[10] 汤春芳,刘云国,徐卫华,等.硫辛酸的研究概况[J].中国生化药物杂志,2005,26(1):52-55.
[11] ZHANG W J,FREI B.Alpha-lipoic acid inhibits TNF-alphainduced NF - kappaB activation and adhesion molecule expression in human aortic endothelial cells[J].FASEB J.2001,15(13):2423-2432.
[12] 于建,苏珂.前列腺素E1治疗老年糖尿病足疗效观察[J].临床荟萃,2001,16(2):1018-1019
[13] OSIECKI H.The role of chronic inflammation in cardiovascular disease and its regulation by nutrients[J].Alhern Med Rev,2004,9(1):32-53.
[14] ARMSTRONG DG,LAVERY LA,LISWOOD PJ,et al.Infrared dermal thermometry for the high-risk diabetic foot[J].Phys Ther,1997,77(2):169-175.
[15] ARMSTRONG DG,HOLTZ-NEIDERER K,WENDEL C,et al. Skin temperature monitoring reduces the risk for diabetic foot ulceration in high-risk patients[J].Am J Med,2007,120(12):1042-1046.
(本文编辑:赵丽洁)
R587.25
B
1007-3205(2012)09-1056-04
2012-03-05;
2012-06-08
韩瑞平(1953-),男,河北衡水人,哈励逊国际和平医院副主任医师,从事心血管内科疾病诊治研究。
10.3969/j.issn.1007-3205.2012.09.025
