枯草芽孢杆菌工程菌产耐酸性高温α-淀粉酶发酵条件的优化
2012-05-08刘逸寒徐艳静薄嘉鑫路福平
胡 博,刘逸寒,徐艳静,薄嘉鑫,路福平
(工业发酵微生物教育部重点实验室;天津科技大学生物工程学院,天津 300457)
α-淀粉酶作为淀粉酶的一种,是目前最重要、最古老、应用范围最广的工业酶制剂之一,其中耐高温α-淀粉酶凭借其热稳定上的优势已经占据了很大的市场[1].耐高温α-淀粉酶目前被广泛地应用于味精、啤酒、有机酸、酒精等食品发酵以及淀粉工业[2-3].目前,国内外市场中常用的耐高温α–淀粉酶的最适 pH范围为 6~7[4],在酸性条件下酶活明显降低,甚至失去活性,已经不能满足酸性条件下淀粉原料深加工工艺的要求,因此对耐酸性α-淀粉酶的需求日益上升.近几年来国内开展了大量的针对产耐酸性α-淀粉酶菌株发酵条件优化的研究,王淑军等[5]对 1株产耐热酸性α-淀粉酶的超嗜热古菌进行了发酵条件的优化,经优化后α-淀粉酶活力达到了 500,U/mg;刘雅琴等[6]在筛选出的耐酸性α-淀粉酶产生菌的基础上对其进行发酵培养基与发酵条件的优化,最终α-淀粉酶活力达到 31.4,U/mL,比初始时提高了 0.65倍;莫新迎等[7]通过单因素实验和响应面分析法对 1株产耐酸性α-淀粉酶的小孢根霉菌培养基组分进行优化,α-淀粉酶活力较优化前提高了 0.15倍,达到259.902,U/g干物质,但其酶活力均不高.
本实验通过对本课题组前期研究获得的可高效表达耐酸性高温α-淀粉酶枯草芽孢杆菌工程菌株pWB-amyd/WB600[8-10]发酵条件进行优化,旨在提高耐酸性高温α-淀粉酶活力,为以淀粉为原料的深加工工业的发展提供有力支撑.
1 材料与方法
1.1 菌株
产耐酸性高温α-淀粉酶工程菌株 pWB-amyd/WB600,由本实验室构建[9]并保藏.以初始发酵培养基及未优化的发酵条件进行发酵培养,初始酶活力为1,890,U/mL.
1.2 培养基
斜面培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,琼脂粉 20,卡那霉素 0.03,pH 自然.
种子培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,卡那霉素 0.03,pH 自然.
初始发酵培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,pH 自然.
1.3 培养方法
种子的培养:取冻存于–70,℃的工程菌株 pWB-amyd/WB600,将其接种到新鲜斜面培养基,37,℃培养 18,h后,挑取单菌落接入种子培养基,37,℃、200,r/min摇床培养16,h,得到种子液.
初始发酵培养:以 1%接种量接种至装液量50,mL发酵培养基的 250,mL三角瓶中,在 37,℃、160,r/min培养36,h.
1.4 生长曲线的绘制
配制 400,mL发酵培养基分装至 250,mL三角瓶,编号为 1—8,每瓶装液量 50,mL,121,℃灭菌20,min,待用.从新鲜斜面培养基挑取单菌落接入含有发酵培养基的三角瓶中,于 37,℃、200,r/min摇床振荡培养.每隔一定时间取样.将菌液适当稀释至吸光度在0.1~1.0范围内,用分光光度计于光程1,cm、波长 600,nm条件下测定其吸光度.以时间为横坐标,吸光度为纵坐标绘制重组菌生长曲线.
1.5 发酵培养基优化
1.5.1 碳源的选择
选择 10,g/L的葡萄糖、麦芽糖、蔗糖、可溶性淀粉、糊精、玉米粉、薯干粉作为碳源,氮源为10,g/L的蛋白胨,比较不同碳源对产酶的影响,确定最适碳源.再以10,g/L的蛋白胨为氮源,加入10、20、30、40、50,g/L的最适碳源,确定最适碳源的最优质量浓度.
1.5.2 氮源的选择
以最适质量浓度的最适碳源为培养基基本组分,分别加入 10,g/L的胰蛋白胨、蛋白胨、酵母膏、牛肉膏、尿素、NH4NO3、NH4Cl,比较不同氮源对产酶的影响,确定最适氮源.再以最适质量浓度的最适碳源为培养基基本组分,加入 10、20、30、40、50,g/L 的最适氮源,确定最适氮源的最优质量浓度.
1.5.3 金属离子Ca2+对产酶的影响
以最优质量浓度的最适碳源、氮源为培养基基本组分,加入 0、0.2、0.4、0.6、0.8、1.0,g/L 的 Ca2+进行发酵,确定Ca2+的最优质量浓度.
1.5.4 Na2HPO4对产酶的影响
以最优浓度的最适碳源、氮源、Ca2+为培养基基本组分,加入 0、4、8、12、16,g/L 的 Na2HPO4进行发酵,确定Na2HPO4的最优质量浓度.
1.5.5 正交实验
利用 L9(34)正交实验筛选出玉米粉、蛋白胨、CaCl2和Na2HPO4的最佳配比.
1.6 发酵条件优化
1.6.1 培养基初始pH对产酶的影响
以上述优化后的培养基配方为基础,用一定浓度的 NaOH或 HCl溶液调节培养基初始 pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0 进行发酵,确定培养基最适初始pH.
1.6.2 接种量对产酶的影响
以原始发酵培养条件为基础,分别按 1%、2%、3%、4%和 5%的接种量接种到优化后的最优培养基中,在 37,℃、160,r/min培养 36,h,取样测定酶活力,确定最适接种量.
1.6.3 装液量对产酶的影响
按优化后所得的最适接种量将种子液分别接种于装有 20、30、40、50、60、70,mL 发酵培养基的250,mL三角瓶中,在 37,℃、160,r/min培养 36,h,取样测定酶活力,确定最适装液量.
1.6.4 摇床转速对产酶的影响
将种子液接种到发酵培养基中,接种量和装液量均按照优化后的结果,在 37,℃条件下,摇床转速分别为 120、160、200、240,r/min 培养 36,h,取样测定酶活力,确定最适摇床转速.
1.6.5 发酵温度对产酶的影响
将种子液接种到发酵培养基中,接种量、装液量及摇床转速均按照优化后的结果,在27、32、37、42,℃分别培养36,h,取样测定酶活力,确定最适发酵温度.
1.7 酶活检测
参照QB/T 2306—1997[11].酶活力单位定义:在70,℃、pH 6.0条件下,1,min液化1,mg可溶性淀粉成为糊精所需要的酶量,即为 1个酶活力单位,以U/mL表示.

式中:X,样品的酶活力(U/mL);c,测试的酶液浓度(U/mL);n,样品的稀释倍数;16.67,换算常数.
2 结果与分析
2.1 生长曲线的测定
工程菌株pWB-amyd/WB600生长曲线如图1所示.由图 1可知,0~12,h为生长的延滞期;12~18,h为对数生长期;从18,h开始进入稳定期.由于在对数生长中后期,菌体量较大,此时菌体还未发生自溶,因此确定在接种后18,h时收集菌体.
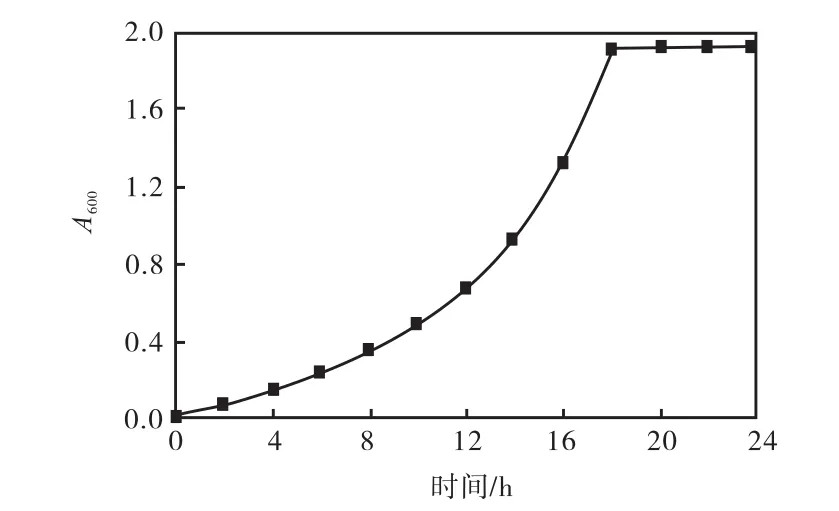
图1 工程菌株pWB-amyd/WB600生长曲线Fig.1 Growth curve of pWB-amyd/WB600
2.2 发酵培养基的优化
2.2.1 碳源对产酶的影响
初始发酵培养基中无特定的碳源,胰蛋白胨和酵母提取物仅能维持菌体生长至A600为3.0左右[12],为了考察重组菌株对碳源的利用情况,本实验选择了几种常用的碳源进行碳源的优化.由表 1结果可知,玉米粉是产酶的最佳碳源,耐酸性高温α-淀粉酶活力达到最高值,为 2,090,U/mL,其余依次为可溶性淀粉、糊精、薯干粉、蔗糖、葡萄糖、麦芽糖.玉米粉的最优质量浓度实验结果表明,随着玉米粉质量浓度的增加,耐酸性高温α-淀粉酶活力也随之增加,当玉米粉质量浓度为 20,g/L时,耐酸性高温α-淀粉酶活力达到最高,为 2,310,U/mL.当继续加大玉米粉质量浓度时,其耐酸性高温α-淀粉酶活力不再随玉米粉质量浓度的增加而增加,反而随之下降,所以本实验选取20,g/L为玉米粉的最适质量浓度.
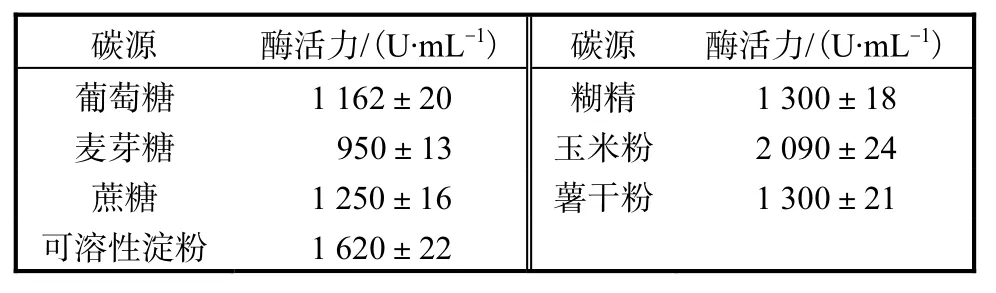
表1 碳源对产酶的影响Tab.1 Effects of carbon resource on the yield of enzyme
2.2.2 氮源对产酶的影响
为了考察重组菌株对碳源的利用情况,实验中同时对有机氮源和无机氮源进行研究,选择 10,g/L的胰蛋白胨、蛋白胨、酵母膏、牛肉膏、玉米浆、尿素、NH4NO3、NH4Cl作为氮源,碳源为20,g/L的玉米粉,其他条件相同,结果见表2.
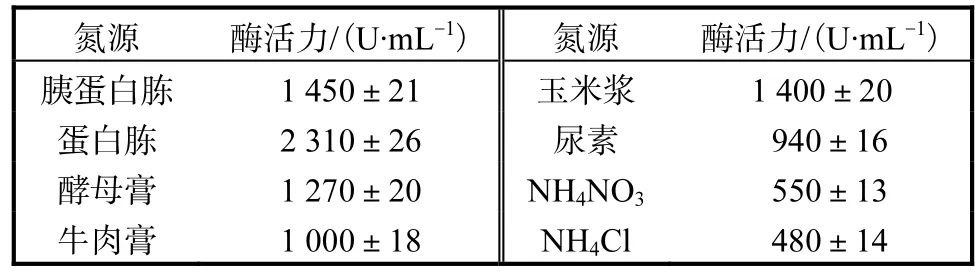
表2 氮源对产酶的影响Tab.2 Effects of nitrogen resource on the yield of enzyme
由表 2可知,重组菌株利用以上氮源培养时,有机氮源对产酶的促进作用明显优于无机氮源.单一的无机氮源作为培养基中的氮源,菌体生长缓慢,产酶量较低.而有机氮源中,蛋白胨是最佳的氮源,其主要成分是各种氨基酸、肽类等可溶性氮化合物,耐酸性高温α-淀粉酶活力达到最高值,为2,310,U/mL.蛋白胨最优浓度实验结果表明,随着蛋白胨浓度的增加,耐酸性高温α-淀粉酶活力也随之增加,当蛋白胨质量浓度为 30,g/L时,耐酸性高温α-淀粉酶活力达到最高,为2,620,U/mL.所以本实验选取30,g/L为蛋白胨最适质量浓度.
2.2.3 金属离子Ca2+质量浓度对产酶的影响
根据 Machius等[13]的研究可知,Ca2+的添加对产地衣芽孢杆菌α-淀粉酶有明显的促进作用,这是因为产地衣芽孢杆菌α-淀粉酶是一种金属酶,金属离子Ca2+与之结合,有利于保持α-淀粉酶的结构稳定性及其活力.故选用不同质量浓度的 Ca2+进行发酵,由图2中可以看出,随着Ca2+质量浓度的增加,耐酸性高温α-淀粉酶活力也随之增加,当 Ca2+质量浓度为 0.6,g/L时,耐酸性高温α-淀粉酶活力达到最高,为2,740,U/ mL.当继续加大Ca2+质量浓度时,其耐酸性高温α-淀粉酶活力不再随Ca2+质量浓度的增加而增加,反而随之下降,所以本实验选取0.6,g/L为Ca2+最适质量浓度.

图2 CaCl2质量浓度对产酶的影响Fig.2 Effects of CaCl2concentration on the yield of enzyme
2.2.4 磷酸盐质量浓度对产酶的影响
磷酸盐对微生物产酶的作用是非常重要的,磷是细胞合成核酸必需的一种元素,也是加快吸收葡萄糖,促进细胞生长不可或缺的一种物质.所以耐酸性高温α-淀粉酶活力随着磷酸盐质量浓度的增加而增加,当磷酸盐浓度为8,g/L时,耐酸性高温α-淀粉酶活力达到最高,为 2,870,U/mL.但是随着磷酸盐质量浓度的继续升高,耐酸性高温α-淀粉酶活力却随之下降,所以本实验选取 8,g/L为磷酸盐最适质量浓度(图 3).
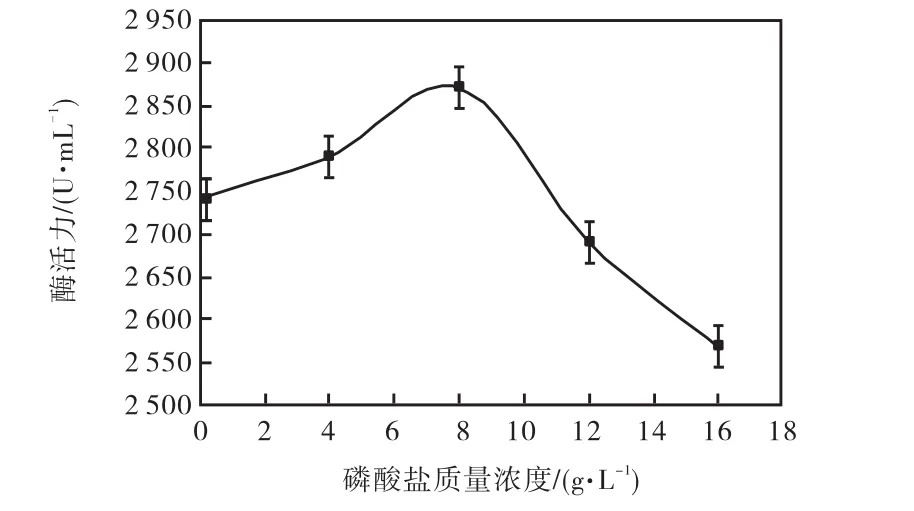
图3 磷酸盐质量浓度对产酶的影响Fig.3 Effects of Na2HPO4 concentration on the yield of enzyme
2.2.5 正交实验
利用 L9(34)正交实验筛选出玉米粉、蛋白胨、CaCl2和Na2HPO4的最佳配比,结果见表3.

表3 培养基配方正交实验结果及其极差分析Tab.3 Results and variance analysis of orthogonal experiment of medium components
由表 3可知,在玉米粉、蛋白胨、CaCl2和Na2HPO4这4种培养基组分的不同配比中,耐酸性高温α-淀粉酶活力最高的组合为(g/L):玉米粉 20,蛋白胨 30,CaCl20.5,Na2HPO48.极差分析结果表明4个因素的影响程度依次为:玉米粉>蛋白胨>Na2HPO4>CaCl2.
由于从理论上优化得到的培养基不在正交实验表中,经验证实验结果表明,耐酸性高温α-淀粉酶活力达到 3,280,U/mL,此活力大于正交实验中出现的所有结果,验证了选取该结果的正确性.因此,确定最适发酵培养基配方为(g/L):玉米粉 20,蛋白胨30,CaCl20.5,Na2HPO48.
2.3 发酵条件
2.3.1 培养基初始pH对产酶的影响
pH是影响微生物正常生理活动的一个重要因素.由图4结果显示,发酵培养基初始pH在5.0~8.0之间,都可产生耐酸性高温α-淀粉酶,初始pH为6.5时,即发酵培养基自然 pH,耐酸性高温α-淀粉酶活力最高,达到3,280,U/mL.所以本实验选取pH,6.5为最适初始pH.

图4 初始pH对产酶的影响Fig.4 Effects of pH on the yeild of enzyme
2.3.2 接种量对产酶的影响
由图 5结果显示,在接种量为 1%时,由于菌体数量过低,减少了蛋白质分泌总量,因此酶活力较低.当以 2%的接种量进行发酵培养时,菌体蛋白分泌较高,酶活力显著提高,耐酸性高温α-淀粉酶活力最高,达到 3,450,U/mL.随着接种量继续增加,耐酸性高温α-淀粉酶活力却随之下降.根据余晓红等[14]的研究可知,这是由于培养基中菌体相对密度增大,导致菌体生长时所需培养基成分不足同时溶氧不足,菌体生长状态不良,反而使酶活力降低造成的,所以本实验选取2%为最适接种量.

图5 接种量对产酶的影响Fig.5 Effects of inoculation volume on the yield of enzyme
2.3.3 装液量对产酶的影响
在微生物发酵过程中,能够提供充足的氧分对于提高产酶量具有重要的作用,在一定范围内,装液量越低,产酶量越高.由图 6结果显示,装液量在30,mL以上时,随着装液量的增加,发酵过程中溶氧量不足,菌体生长受到抑制,导致耐酸性高温α-淀粉酶活力下降.当装液量为30,mL时,耐酸性高温α-淀粉酶活力达到最高,为 3,670,U/mL.装液量为 20,mL时,虽然溶解氧量充足,但是由于养分不足,菌体生长缓慢,导致耐酸性高温α-淀粉酶活力下降.所以本实验选取30,mL/250,mL为最适装液量.

图6 装液量对产酶的影响Fig.6 Effects of medium volume on the yield of enzyme
2.3.4 摇床转速对产酶的影响
摇床转速同样影响发酵液中氧气的溶解量.由表 4结果显示,当摇床转速较低时,发酵液中氧气的溶解量不足,不利于菌体生长,导致耐酸性高温α-淀粉酶活力下降,因而耐酸性高温α-淀粉酶活力随着转速的升高而变高,当达到200,r/min时,耐酸性高温α-淀粉酶活力达到最高,为3,980,U/mL.随着摇床转速的继续升高,耐酸性高温α-淀粉酶活力却随之降低,所以本实验选取200,r/min为最适摇床转速.

表4 转速对产酶的影响Tab.4 Effects of rotation speed on the yield of enzyme
2.3.5 温度对产酶的影响
培养温度对菌株产酶的影响结果见表5.

表5 培养温度对产酶的影响Tab.5 Effects of cultivated temperature on enzyme production
由表 5结果显示,低温不利于菌株生长产酶,随着温度升高,反应速度加大,生长代谢加快,生产期提前,菌株的产酶量大幅度提高,当温度到达 37,℃时,菌体的生长最旺盛,菌株的产酶活力大幅度增加,耐酸性高温α-淀粉酶活力达到最高,为 3,980,U/mL.但是随着温度的继续升高使得菌体易于衰老,发酵周期缩短,导致产物的最终产量降低.所以本实验选取37,℃作为最适发酵温度.
3 结 论
枯草芽孢杆菌工程菌株 pWB-amyd/WB600,具有高拷贝的重组表达质粒,且具有良好地遗传稳定性,可高效表达耐酸性高温α-淀粉酶.本研究在此基础上,对该工程菌株进行发酵培养基及发酵条件的优化.分别研究碳源、氮源、金属离子以及磷酸盐对耐酸性高温α-淀粉酶活力的影响,通过正交实验进一步分析,确定最适发酵培养基为(g/L):玉米粉 20,蛋白胨 30,CaCl20.5,Na2HPO48.同时,确定了摇瓶最佳发酵工艺:将重组菌的单菌落接种于种子培养基(50,mL/250,mL三角瓶)中,于 37,℃、200,r/min条件下培养18,h后,以2%接种量接种于优化后的发酵培养基(30,mL/250,mL 三角瓶)中,初始 pH 6.5,37,℃、200,r/min培养 36,h后,最终得到的耐酸性高温α-淀粉酶活力为3,980,U/mL,是优化前活力的2.1倍.
[1] 胡建恩,曹茜,杨帆,等. 耐高温α-淀粉酶高密度高表达发酵条件的优化[J]. 食品科学,2012,33(1):219-225.
[2] 张强,黄丹,王川. 耐高温α-淀粉酶产生菌的选育研究[J]. 中国酿造,2008(7):21-23.
[3] Haki G D,Rakshit S K. Developments in industrially important thermostable enzymes:A review[J]. Bioresour Technol,2003,89(1):17-34.
[4] 刘逸寒,李玉,路福平,等. 耐酸性高温α-淀粉酶突变基因在大肠杆菌中的表达及酶学性质研究[J]. 食品与发酵工业,2007,33(2):36-41.
[5] 王淑军,陆兆新,秦松,等. 超嗜热古菌耐热酸性α-淀粉酶的发酵条件和酶学性质研究[J]. 海洋与湖沼,2009,40(1):19-26.
[6] 刘雅琴,乌日娜,段金华. 耐酸性α-淀粉酶产生菌的发酵条件优化[J]. 安徽农业科学,2010,38(35):19888-19890.
[7] 莫新迎,高梅莹,韩丹,等. 耐酸性α-淀粉酶产生菌筛选及培养基优化[J]. 中国酿造,2010(4):85-88.
[8] 刘逸寒,李玉,田琳,等. 耐酸性高温α−淀粉酶突变基因的异源表达及纯化[J]. 化学与生物工程,2007,24(3):58-62.
[9] Liu Yihan,Lu Fuping,Li Yu,et al. Characterisation of mutagenised acid-resistant alpha-amylase expressed in Bacillus subtilis WB600[J]. Applied Microbiology Biotechnology,2008,78:85–94.
[10]Liu Yihan,Lu Fuping,Li Yu,et al. Acid stabilization of Bacillus licheniformis alpha amylase through introduction of mutations[J]. Applied Microbiology Biotechnology,2008,80:795–803.
[11]中国轻工总会. QB/T 2036–1997 耐高温α-淀粉酶制剂[S]. 北京:中国轻工业出版社,1998.
[12]黄鹤,杨晟,李仁宝,等. 重组青霉素 G 酰化酶在枯草芽孢杆菌中的表达条件优化[J]. 中国生物化学与分子生物学报,2001,17(2):173–177.
[13]Machius M,Declerck N,Huber R,et al. Kinetic stabilization of Bacillus licheniformis α-amylase through introduction of hydrophobic residues at the surface[J]. J Biol Chem,2003,278(13):11546–11553.
[14]余晓红,汪志君,方维明. 麦汁中啤酒酵母的最适接种量研究[J]. 酿酒科技,2003(4):73-74.
