5-(4-琥珀酰胺基)苯基-10,15,20-三苯基卟啉及其锌配合物的制备及光谱研究
2012-05-05庄长福张加研吴春华秦永剑师同顺
庄长福,王 瑛,张加研,吴春华,秦永剑,师同顺
(1.西南林业大学材料工程学院,云南 昆明 650224;2.吉林大学化学学院,吉林 长春 130021)
卟啉化合物广泛存在于动植物的体内。卟啉具有的多齿配位作用和特殊的大环共轭芳香体系,使得它与金属离子所形成的配合物具有众多独特的物理化学特性,在生命过程中起着非常重要的作用。卟啉功能分子的合成与应用研究在药物化学、材料化学、电化学等领域受到了广泛关注[1~4],其中已有不少不对称卟啉的合成与应用研究的报道,但不对称四苯基卟啉配合物的相关报道较少。作者在此由5-(4-氨基)苯基-10,15,20-三苯基卟啉合成了一种不对称酰胺基苯基卟啉和相应的金属锌配合物,对其结构进行了表征,并对卟啉配体和金属配合物的拉曼光谱进行了研究。其合成路线见图1。
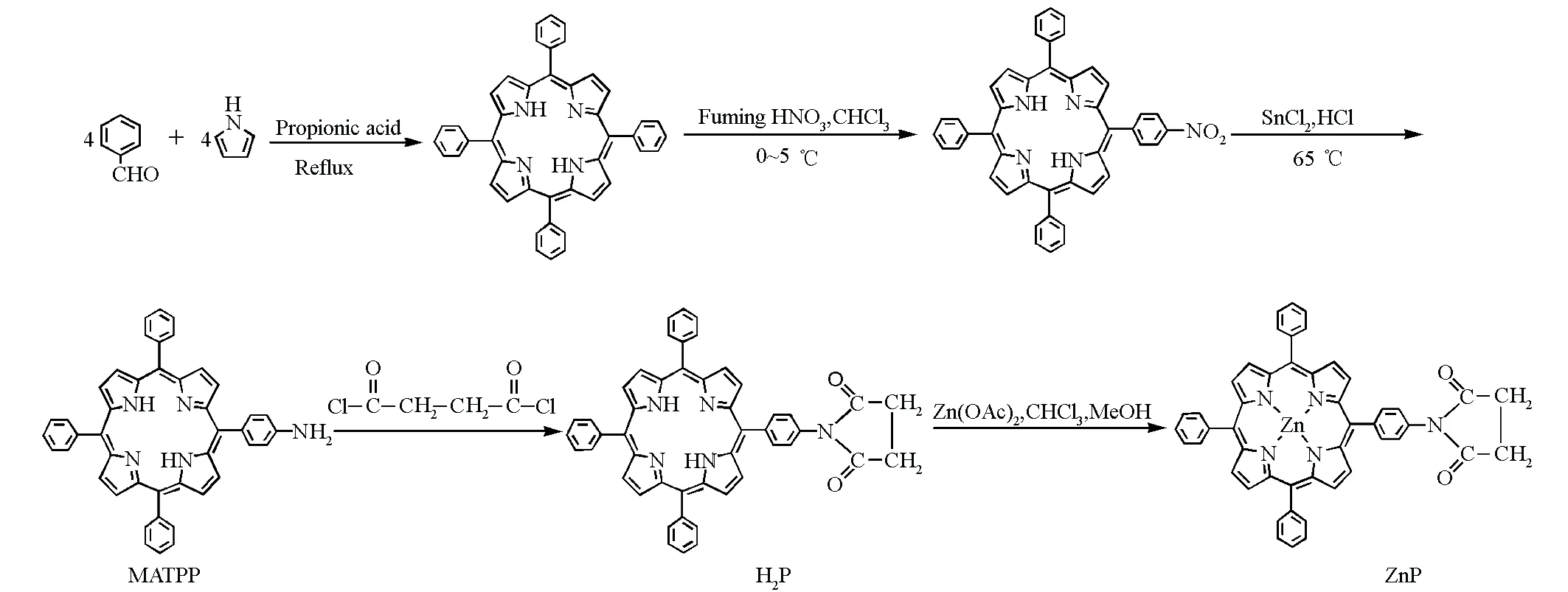
图1 H2P和ZnP的合成路线
1 实验
1.1 试剂和仪器
所用化学试剂均为分析纯。
Varian Unity-500(500 MHz)型波谱仪(CDCl3为溶剂);Nicolet 5PC FTIR型红外光谱仪(KBr 压片);Perkin-Elemer240C型自动元素分析仪;Shimadzu UV-240型紫外可见分光光度计,日本岛津公司;CFR MALDI-TOF型质谱仪,美国Axima;Renishawinvia型共聚焦显微拉曼光谱仪(激发波长514.5 nm,10%衰减,20倍镜头,固体样品压片)。
1.2 方法
1.2.1 5-(4-氨基)苯基-10,15,20-三苯基卟啉(MATPP)的合成
MATPP参照文献[5]合成。
1.2.2 H2P的合成
向装有20 mL CHCl3/DMF(体积比9∶1)的三口瓶中加入60 mg 4-二甲氨基吡啶(DMAP)和2 mL干燥过的三乙胺,并加入210 mg MATPP,搅拌1 h后,逐滴滴加丁二酰氯0.3 mmol,常温反应24 h。加入150 mL 蒸馏水,再用氯仿萃取,浓缩,以200~300目硅胶柱层析,用三氯甲烷淋洗,收集第一带紫色固体即为H2P,产率54%。C48H29N5O2元素分析实验值(理论值,%):C 77.75(77.81),H 6.58(6.53),N 6.01(6.05)。
1.2.3 ZnP的合成
取H2P 200 mg溶解于20 mL氯仿中,逐滴滴加溶有100 mg Zn(OAc)2·2H2O的甲醇溶液10 mL,室温搅拌30 min,混合溶液经减压蒸干,再用少量氯仿将其重新溶解,并经200~300目硅胶柱层析提纯,用氯仿淋洗得到第一带为未反应的配体H2P,用乙醇-氯仿(体积比2∶100)淋洗得到第二带为产品带,浓缩此带真空干燥,即得到紫红色固体ZnP,产率84%。C48H27N5O2Zn元素分析实验值(理论值,%):C 77.36(77.42),H 6.54(6.49),N 6.00(6.02)。
2 结果与讨论
2.1 核磁共振氢谱分析和质谱
核磁共振氢谱(1HNMR)分析表明,H2P的明显特征是峰位置受卟啉环电流效应的影响而产生位移。1HNMR(CDCl3),δ,ppm:8.839~8.888(m,8H,β-Pyrrole),8.312~8.340(m,2H,o-Phenyl),8.194~8.221(m,6H,o-Triphenyl),7.708~7.784(m,9H+2H,p,m-Triphenyl+m-Phenyl),3.073(s,4H,-CH2-CH2-),-2.779(s,2H,Pyrrole N-H)。与配体H2P相比,ZnP的卟啉环N-H在-2.767 ppm的化学位移消失,这是形成卟啉配合物的标志之一,而其它峰的位置仅略有移动。
卟啉配体H2P的质谱图见图2。
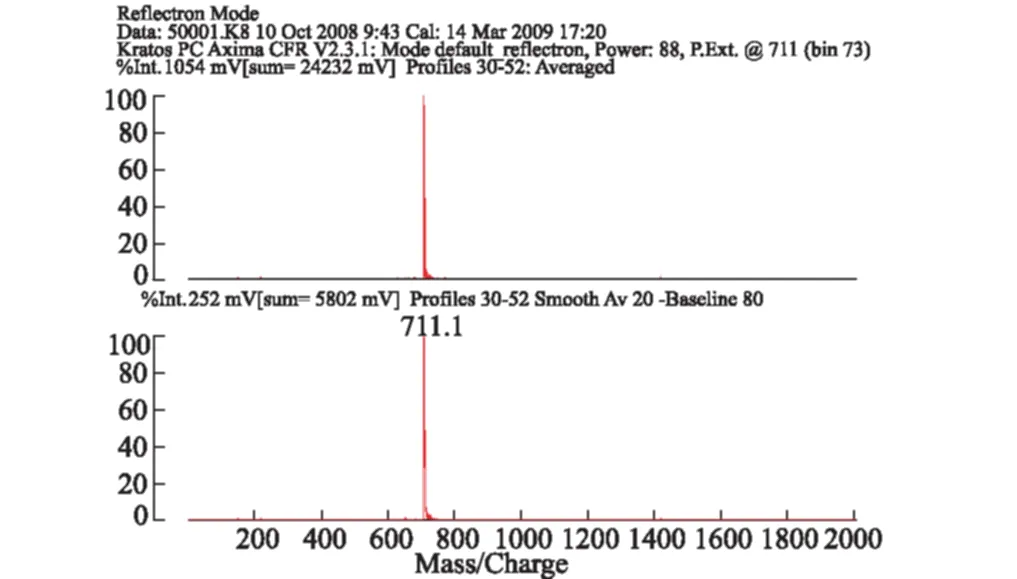
图2 H2P的质谱图
由图2可知,分子离子峰为711.1,接近理论值711.8,证明合成了目标化合物。
2.2 紫外可见吸收光谱分析
H2P和ZnP的紫外可见吸收光谱见图3。

图3 H2P 和ZnP的紫外可见吸收光谱
卟啉的紫外可见吸收光谱包括电子从基态S0跃迁至两个最低激发单重态S2(Soret 带)和S1(Q 带),电子从S0→S1在可见光区域(500~700 nm)产生4个弱Q带,从S0→S2在近紫外区(380~450 nm)产生强Soret吸收带。由图3可知,H2P的Soret带出现在419 nm,4个弱的Q带分别为514 nm、551 nm、591 nm、645 nm。ZnP的Soret带出现在419 nm,Q带出现在548 nm、586 nm。与配体H2P相比,配合物ZnP的Q带数减少且发生移动,这是由于卟啉大环的中心被金属离子配位后,卟啉配合物的对称性发生变化,从配体H2P的D2h变成了配合物ZnP的D4h,而且能级靠近,减少了分子轨道的分裂程度,简并度增大,从而使吸收峰的数目减少。该结果与文献[6]报道相符。
2.3 红外光谱分析
不对称卟啉配体H2P和金属卟啉配合物ZnP的红外光谱图见图4。

图4 H2P 和ZnP的红外光谱
由图4可知,卟啉配体H2P的红外光谱中,966 cm-1和3318 cm-1处为卟啉环中吡咯N-H 的弯曲和伸缩振动峰[7];2924 cm-1和 2851 cm-1处为CH2的C-H振动峰;1718 cm-1处为酰胺Ⅰ带羰基强振动峰;1596 cm-1和1474 cm-1处为苯环的骨架振动峰;1350 cm-1处为吡咯环的C-N 伸缩振动峰,这个吸收峰位对金属离子的取代特别敏感;1315 cm-1处为酰胺基的C-N振动峰;CPh-N振动峰由氨基卟啉MATPP的1280 cm-1向高波数移动至1318 cm-1,这是因为单体MATPP中的氨基反应生成酰胺键,致使C-N振动发生移动[7]。与配体H2P相比,配合物ZnP的C-N 伸缩振动峰由1350 cm-1向低波数移动至1340 cm-1,这是由于M-N键的形成削弱了ZnP的C-N键的结果[8];H2P在卟啉环中心966 cm-1处的弯曲振动和3318 cm-1处的N-H伸缩振动峰消失,这是因为H2P的卟啉孔穴中N-H键上的氢原子被金属离子取代,M-N键生成。上述现象证明卟啉配体H2P生成了金属卟啉配合物ZnP[9]。
2.4 拉曼光谱分析
MATPP、MATPPZn、H2P和ZnP的拉曼光谱数据见表1。
由表1可知,MATPP和H2P光谱中1547 cm-1、1548 cm-1处吸收峰归属于Cβ-Cβ伸缩振动ν2模式,而在MATPPZn和ZnP光谱中分别移动至1545 cm-1、1550 cm-1处;在1350 cm-1附近的偏振带是一重要结构敏感带,归属于ν4(Pyrrole half-ring)伸缩振动,对氮和金属配位敏感,在MATPP和H2P光谱中分别位于1361 cm-1、1356 cm-1处,谱带强度较强,而在MATPPZn和ZnP光谱中分别向低波数移至1347 cm-1、1353 cm-1,且强度变小。卟啉与金属离子配合的频率移动可以用dx2-y2电子对卟啉的排斥作用和金属离子半径解释。由于Zn2+具有较大的离子半径,因此外环化学键Cβ-Cβ和Cα-Cm拉长,致使对应化学键振动频率下降[10]。此外,依据配位化学晶体场理论,由于Zn2+的d轨道发生了能级分裂,有2个电子在dx2-y2上,对卟啉环的4个氮原子有排斥作用,导致卟啉“心膨胀”,结构灵敏带的频率下降[6]。MATPP和H2P光谱中1239 cm-1处出现的振动峰归属为Cm-Ph的振动,而在MATPPZn和ZnP光谱中分别移动到1232 cm-1、1228 cm-1处,这是因为金属离子引入后,卟啉环和苯环之间产生了扭曲[11]。406 cm-1附近包含M-N配位的伸缩振动和卟啉弯曲振动模式,此谱带对金属配位敏感。

表1 MATPP、MATPPZn、H2P和ZnP的拉曼光谱数据
3 结论
合成了5-(4-琥珀酰胺基)苯基-10,15,20-三苯基卟啉配体(H2P)及其锌配合物(ZnP),通过元素分析、质谱、紫外可见吸收光谱、核磁共振氢谱、红外光谱等测试方法对其结构进行确认,并对H2P和ZnP的拉曼光谱进行了研究。结果表明,H2P和ZnP的紫外可见吸收光谱、红外光谱及拉曼光谱都有很大区别。
参考文献:
[1] Johnson D G,Niemczyk M P,Minsek D W,et al.Photochemical electron transfer in chlorophyll-porphyrin-quinone triads:The role of the porphyrin-bridging molecule[J].J Am Chem Soc,1993,115(13):5692-5701.
[2] Li G Y,Che C M.Highly selective intra- and intermolecular coupling reactions of diazo compounds to formcis-alkenes using a ruthenium porphyrin catalyst[J].Org Lett,2004,6(10):1621-1623.
[3] Bonnett R.Photosensitizers of the porphyrin and phthalocyanine series for photodynamic therapy[J].Chem Soc Rew,1995,24(1):19-21.
[4] Gust D,Moore T A,Moore A L,et al.Long-lived photoinitiated charge separation in carotene-diporphyrin triad molecules[J].J Am Chem Soc,1991,113(10):3638-3649.
[5] Wang D,Su L J,Cheng X L,et al.Synthesis and purification of porphyrin-Schiff base using ethyl vanillin[J].Chemical Research in Chinese Universities,2007,23(2):135-137.
[6] Wasbotten I H,Conradie T J,Ghosh A.Electronic absorption and resonance Raman signatures of hyperporphyrins and nonplanar porphyrins[J].J Phys Chem B,2003,107(15):3613-3623.
[7] Guo X M,Su L J,Yu L X,et al.Synthesis and characterization of L-glutamic acid bridged porphyrin and its CD spectrum[J].Chem J Chinese Universities,2006,27(3):410-413.
[8] 莫卫民,薛建,胡宝祥,等.红外光谱在烟酸系列化合物制备过程中的应用[J].光谱实验室,2004,21(4):678-680.
[9] Fu S T,Wang K,Xie Z,et al.Synthesis and characterization of novel bridged porphyrin dimmers[J].Chem J Chinese Universities,2004,25(7):1204-1208.
[10] Saini G S S.Resonance Raman study of free-base tetraphenylporphine and dication[J].Spectrochimica Acta Part A,2006,64(4):981-986.
[11] Paulat F,Praneeth V K K,Nalther C.Quantum chemistry-based analysis of the vibrational spectra of five-coordinate metalloporphyrins[M(TPP)Cl][J].Inorganic Chemistry,2006,45(7):2835-2856.
