谷胱甘肽过氧化物酶模拟物研究进展
2012-05-03邓萍蒋君好
邓萍 蒋君好
(重庆医科大学药学院,重庆400016)
谷胱甘肽过氧化物酶模拟物研究进展
邓萍 蒋君好
(重庆医科大学药学院,重庆400016)
回顾谷胱甘肽过氧化物酶模拟物的研究进展,为开发新型谷胱甘肽过氧化物酶模拟物提供科学参考。总结了目前研究比较热门的4种代表性谷胱甘肽过氧化物酶模拟物:小分子模拟物、环糊精为酶模型的模拟物、多肽含硒模拟物、多糖为酶模型的模拟物,分析了其发展趋势。
谷胱甘肽;过氧化物酶;模拟物
1 引言
谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶。它能催化谷胱甘肽(Glutathione,GSH)与过氧化物之间的氧化还原反应,使过氧化物还原成低毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。GSH-Px包括胞浆 GSH-Px、血浆 GSH-Px、胃肠道专属性GSH-Px及磷脂过氧化氢 GSH-Px四种。胞浆GSH-Px主要分布在肝脏红细胞中,其生理功能主要是催化GSH参与氧化还原反应,清除在细胞新陈代谢过程中产生的过氧化物和羟基自由基,减轻细胞膜不饱和脂肪酸的过氧化作用。血浆GSH-Px主要分布于血浆中,其功能与清除细胞外的过氧化氢和参与GSH的运输有关。胃肠道专属性GSH-Px只存在于啮齿类动物的胃肠道中,其功能是避免因摄入脂质过氧化物而造成的机体损害。磷脂过氧化物GSH-Px主要存在于睾丸中,其生物学功能与抑制膜磷脂过氧化有关。
GSH-Px在人体内具有十分重要的生理活性,能防止过氧化物对细胞膜脂质的过氧化作用,从而保护细胞膜和细胞器免受损伤。但它的不稳定性和资源局限性导致其利用率很低,而且作为外源性药物难以透过生物膜进人细胞。因此,开发具有高活性的人工模拟物就成为研究的重点。本文主要针对国内外GSH-Px模拟物的研究现况,着重归纳总结目前研究比较热门的代表性GSH-Px模拟物,预测其研究进展。
2 小分子模拟物
硒是生物体内必需的有益微量元素之一,是谷胱甘肽过氧化物酶的活性中心。合成生物活性高且毒性低的小分子有机含硒化合物仍旧是目前GSH-Px模拟物研究的一个热点。由于碲和硒属于同一主族,它们具有相似的氧化还原特性,因此小分子有机含碲化合物也成为一个关注的重点。
依布硒啉(Ebselen)是公认的GSH-Px模拟物,1983年由Welter等[1]合成。Ebselen又名PZ51,是一种低毒性的含硒有机化合物,易于参加各种氧化还原反应,能清除机体内过多的过氧化物,阻断产生自由基的链式反应,维持机体的正常生理功能。参照GSH-Px的化学反应机理,Fischer等[2-3]提出Ebselen模拟GSH-Px活性的反应机制可以概括为两个循环。随着研究的深入,Zhao等[4-5]提出生物体内的Ebselen可能还存在参与硫氧还蛋白还原酶和硫氧蛋白系统的机制。
依布硒啉模拟GSH-Px活性可能与其含有的苯并异硒唑酮环有关。人们合成了许多含有苯并异硒唑酮环结构的依布硒啉衍生物,并发现有不少衍生物具有GSH-Px活力。肖颖歆等[6-8]合成了一系列的苯并异硒唑酮氨基酸衍生物,这类化合物抗氧化活性的研究表明,他们对Fe2+/半胱氨酸及Vc诱发的大鼠肝微粒体脂质过氧化有抑制作用,部分化合物比依布硒啉更优;同时,采用偶合法测定了其中7种(图1)GSH-Px活性,研究了构效关系,并考察了模拟物浓度、GSH浓度、反应体系温度及pH值等因素对催化活性的影响。研究表明:所有模拟物均显示较好的GSH-Px活性,并且具有明显的构效关系。其中化合物1a、6a和7a与依布硒啉活性相当。
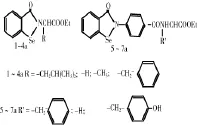
图1 7种依布硒啉衍生物结构
马万超等[9]合成了4种季铵盐型有机硒化合物(图2),经过活性测定,所合成的模拟物活性均比依布硒啉强。二硒化合物的作用可看成是两个单硒化物的作用之和,若将模拟物的活性按每μmol硒计算,则活力大小次序为:1b>2b>4b>依布硒啉>3b。这是由于基团的空间结构越大,使得GSH对硒原子的进攻越困难。依布硒啉分子尽管空间阻碍较小,但其氮原子上不带正电荷,对GSH(中性pH条件下带负电荷)的静电吸引作用减弱。
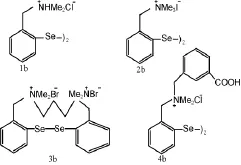
图2 4种季铵盐型有机硒化合物结构
颜雪明等[10]以依布硒啉为先导化合物,合成了7种双苯并异硒唑酮结构的新型依布硒啉类似物(图3)。通过在分子中增加活性基团的数目,考查其生物活性的变化,以探索这一类化合物的构效关系的规律。
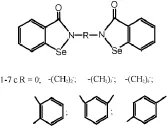
图3 7种双苯并异硒唑酮化合物结构
Kunwar等[11]报道了硒代半胱氨酸衍生物3,3′-二硒代二丙酸(DsePA,图4)对活性氧自由基的清除作用。研究发现DsePA是一个良好的过氧自由基清除剂,其模拟酶活性虽然小于GSH-Px,但它与三氯甲基过氧自由基(CCl3O2,一种模型过氧自由基)反应的双分子速率常数达到2.7×108L/mo1·s。而且DSePA对过氧化物具有很高的反应特异性,同时该化合物的毒性非常小。

图4 3,3′-二硒代二丙酸(DSePA)结构
关于小分子模拟物的活性机制的理论研究,也是一个研究热点。Jalbout等[12]采用量子化学密度泛函理论在B3LYP/6-311G(d,p)水平上对依布硒啉及其衍生物进行了理论研究。Pearson等[13]在B3PW91/6-311G(2df,p)水平分别对依布硒啉、Ebselen selenol、Ebselen diselenide催化 GSH 降解H2O2的三个反应进行了理论计算。单点能量计算采用6-311++G(3df,3pd)基组。研究表明:3个反应的能垒分别为56.7、53.4和35.3 kcal/mol。这表明三者中Ebselen diselenide具有最高的活性。Soujanya等[14]采用量子化学密度泛函理论在B3LYP/6-311G (d)水平上探讨了1,3-dihydro-1-methyl-2H-imidazole-2-selenol(MseI)抗氧化机制。该研究对各反应步骤反应物、产物、过渡态分子结构进行了全优化。研究的结果表明反应具有高度同步协同机制,其中的巯基亲核攻击硒原子是反应的速率决定步骤。
Bhabak等[15]对不同小分子GSH-Px模拟物的活性进行了研究,研究发现分子内的Se···O/N之间存在强的相互作用将降低分子活性。因此,通过改变N原子上的取代基团,提高Se原子的亲核进攻能力将有助于提高所设计分子的活性。
3 环糊精为酶模型的模拟物
环糊精具有疏水的空腔和亲水的表面,可以在水溶液中选择性结合各种有机、无机分子形成主-客体或超分子配合物。这种特性使其在GSH-Px模拟物的研究中得到重要应用。因此,以环糊精为酶模型的模拟物成为谷胱甘肽过氧化物酶模拟物的研究热点之一。该类模拟物主要分为两大类,分别以碲和硒原子作为活性中心。
Liu等[16]以环糊精作为酶模型,将 GSH-Px活性基团-SeH引入β-环糊精合成了6-位硒桥联环糊精(6-SeCD)。经验证,其活力为依布硒啉的4.3倍,而且具有更小的毒性和更好的稳定性。活性增高的原因在于环糊精空腔对GSH-Px的底物GSH和H2O2具有一定的结合能力,它类似于酶的结合部位,因此获得了较好的模拟效果。贾振华等[17]把-SeH基团引入到环糊精上,通过模拟GSH-Px催化实验,检测到硒化环糊精(Se-CD)催化效率较好,其活力可达8.56 U/μmol。Liu等[18]还合成了2,2′-二硒桥连β-环糊精(2-SeCD),研究表明:该化合物具有比Ebselen更好的GSH-Px活力,其催化GSH减少H2O2、叔丁基过氧化氢(t-BuOOH)和异丙苯过氧化氢(CuOOH)的能力分别为7.4、4.5和10.2 U/μmol。Lv等[19]合成了6A,6A′-二环己烷-6B,6B′-二硒-β-环糊精(6-CySeCD),其催化GSH减少 H2O2、t-BuOOH和 CuOOH的能力比6-SeCD和依布硒啉更强。
Ren等[20-23]利用环糊精作为酶模型合成了一种具有谷胱甘肽过氧化物酶活性的物质2-TeCD。2-TeCD具有分子量小、水溶性好、活性高等优点和良好的化学生物学稳定性,其GSH-Px活力是依布硒啉的46倍。张鲲等[24]以β-环糊精作为酶模型,将Te引入β-环糊精中,合成出了2-TeCD,并对其结构进行了表征。采用Wilson辅酶偶联法,间接测定了2-TeCD催化GSH还原H2O2的活力为46.7 U/μmol。通过考察2-TeCD催化GSH还原H2O2反应的动力学,发现反应初速度对底物浓度的双倒数曲线为1组平行线,表明2-TeCD所遵循的催化机制可能为三转移“乒乓”机制。通过考察自由基捕获剂 2,4-二叔丁基甲基苯酚对酶促和自发反应速率的影响,发现2-TeCD催化的酶促反应为非自由基机理。通过考察酶不可逆抑制剂碘乙酸对酶促反应速率的影响,发现2-TeCD催化反应过程中不生成碲醇中间体。Dong等[25]选择了 GSH、3-羧基 -4-硝基苯硫酚(CNBSH)和4-硝基苯硫酚(NBSH)三种不同的硫醇,以H2O2、t-BuOOH和CuOOH作为氧化试剂,研究2-TeCD的活性。研究结果标明,以NBSH作为硫醇时,2-TeCD催化过氧化物减少的二阶速率常数类似天然酶。吕绍武[26]等合成了2-碲桥联β-环糊精,其活力为46.7 U/μmol。Hao等[27]还采用MM2模型构建了化合物的三维模型,对S-硝基苯谷胱甘肽与2-TeCD、2-SeCD联合作用机制进行了研究。
4 多肽含硒模拟物
部分多肽含有半胱氨酸残基,可以通过对其进行化学修饰以模拟GSH-Px。Bell等[28]对枯草杆菌的丝氨酸进行化学修饰获得的物质具有GSH-Px活性。朱振齐等[29-30]以合成的谷氨酸 -γ丝氨酸-甘氨酸(Glu-Ser-Gly)三肽为原料,经苯甲基磺酰氟(PMSF)活化,用硒化氢(H2Se)突变Ser成硒代半胱氨酸(SeCys)制成GseH。并用元素分析及氨基酸分析确定此三肽的组成及并推导出此三肽的结构。研究GSeH的性质,结果表明:此三肽具有GSH-Px活性,其活力比其他一些小分子有机模拟物高,其动力学行为与天然GSH-Px类似。丁兰等[31-32]用诱变剂 PMS活化兔抗人 IgM(Fcμ)片段上特殊活性部位的丝氨酸残基,经H2Se处理转变成SeCys,诱变后的抗体具有GSH-Px活性,其活性为依布硒啉的70多倍;采用化学方法修饰具有底物GSH结合部位的单克隆抗体 (4A4),使其结合部位上的丝氨酸(Ser)转变成GSH-Px的催化基团 SeCys,因而产生高活力的含硒抗体酶(Se-abzyme)。突变的4A4(m4A4)的GSH-Px活力达到了天然酶活力的19%。对m4A4的酶学性质和动力学性质进行研究表明:硒代谷胱甘肽连到4A4结合部位,其GSH-Px活力由3.86 U/μmol提高到598.9 U/μmol。用黄嘌呤氧化酶/次黄嘌呤为中心的肌线粒体自由基损伤模型证明m4A4可减轻活性氧对线粒体的损伤。Liu等[33-34]亦在该领域进行了系列研究。他们制备了具有GSH-Px活力的单链抗体,在单链抗体表达载体pTMF-2F3上去除原2F3基因N端非必需的18个氨基酸,采用新的表达载体pRose质粒,在2F3的N端引入13个氨基酸的前导肽,获得可溶性表达产物,该产物活力为2530 U/μmol。Sun等[35]从含硒多肽的噬菌体中筛选出了具有谷胱甘肽过氧化物酶活性的模拟物:15SeP和5SeP1,这些多肽可以保护细胞免受过氧化氢介导的脂质过氧化和细胞毒作用。Ren等[36]研究发现一些含硒单克隆抗体(即Se-4A4和Se-scFv2F3)具有谷胱甘肽过氧化物酶活性。其中,Se-4A4能减轻黄嘌呤氧化酶诱导活性氧对心脏线粒体的损伤[37]。
5 以多糖为酶模型的模拟物
Haratake等[38]通过把 SeCys结合到具有亲水性的茁霉多糖(Pul)上合成了一种直径约为100至300 nm的GSH-Px模拟物。该模拟物催化GSH还原H2O2的能力比SeCyst提高近20倍。研究发现其模拟物反应的动力学机制与天然 GSH-Px相同,为“乒乓”机制。陈佳等[39]用修饰法合成以透明质酸为骨架的两种新型GSH-Px模拟物:硒化透明质酸(SeHA)及碲化透明质酸(TeHA)。用红外光谱和核磁共振波谱对模拟物的结构进行研究,证明其修饰位点位于透明质酸的N-乙酰氨基葡萄糖的-CH2OH基团。通过模拟酶对3种不同底物H2O2、t-BuOOH和 CuOOH的催化活性的研究表明,CuOOH为该反应的最佳底物。采用Wilson辅酶偶联法测定得到TeHA催化GSH还原H2O2的活力为163.6 U/μmol。其模拟酶反应的动力学机制与天然GSH-Px相同,为“乒乓”机制。
6 结论
GSH-PX模拟物,活性高,可作为肺、心血管、神经退化性及炎症性疾病的治疗药物得到了国内外的广泛关注[40]。综合国内外研究进展,我们认为:取代基对小分子模拟物的活性有较大的影响,可以采用量子化学软件研究其具体化学反应机制,指导分子设计,以开发具有更高活性的小分子模拟物。大分子GSH-PX模拟物的开发可能成为研究的重点,加强其体内过程研究,阐明药理作用机制,对于开发新型化合物具有指导意义。
[1] Welter A,Leyck S,Etschenberg E.Benzisoselenazolones and a process for the treatment of inflammatory diseases[P].US Patent,C07D,4550168,1985-10-29.
[2] Fischer H,Dereu N.Mechanism of the catalytic reduction of hydroperoxides by ebselen:a selenium-77 NMR study[J].Bull Soc Chim Belg,1987,96(10):757-768.
[3] Haenen GR,De Rooij BM,Vermeulen NP,et al.Mechanism of the reaction of ebselen with endogenous thiols:dihydrolipoate is a better cofactor than glutathione in the peroxidase activity of ebselen[J].Mol Pharmacol,1990,37(3):412-422.
[4] Zhao R,Holmgren A.A novel antioxidant mechanism of ebselen involving ebselen diselenide,a substrate of mammalian thioredoxin and thioredoxin reductase[J].J Biol Chem,2002,277(42):39456-39462.
[5] Zhao R,Masayasu H,Holmgren A.Ebselen:a substrate for human thioredoxin reductase strongly stimulating its hydroperoxide reductase activity and a superfast thioredoxin oxidant[J].Proc Natl Acad Sci USA,2002,99(13):8579-8584.
[6] 徐汉生,肖颖歆,刘秀芳.苯并异硒唑酮氨基酸衍生物的合成及其抗脂质过氧化作用[J].有机化学,1995,15(3):252-258.
[7] 肖颖歆,刘秀芳,徐汉生,等.Ebselen氨基酸衍生物的合成及其抗脂质过氧化作用[J].高等学校化学学报,1996,17(6):914-916.
[8] 肖颖歆,黄祖云,刘秀芳,等.苯并异硒唑酮氨基酸衍生物的谷胱甘肽过氧化物酶样活性[J].应用化学,1997,14(3):66-69.
[9] 马万超,罗贵民,王宗睦,等.谷胱甘肽过氧化物酶模拟物的合成及其催化机理研究[J].高等学校化学学报,1993,14(1):141-143.
[10] 颜雪明,李新生,张华,等.双苯并异硒唑酮及其类似物的合成与表征[J].合成化学,2005,13(4):384-385.
[11] Kunwar A,Mishra B,Barik A,et al.3,3′-diselenodipropionic acid,an efficient peroxyl radical scavenger and a gpx mimic,protects erythrocytes(RBCs)from AAPH-induced hemolysis[J]. Chem Res Toxicol,2007,20(10):1482-1487.
[12] Jalbout AF,Hameed AJ,Essa AH.Structural isomers of 2-(2,3 and 4-substituted-phenyl)-1,2-benzisoselenazol-3(2H)-one:A Theoretical Study[J].J Organomet Chem,2008,693(12):2074-2078.
[13] Pearson JK,Boyd RJ.Modeling the reduction of hydrogen peroxide by glutathione peroxidase mimics[J].J Phys Chem A,2006,110(28):8979-8985.
[14] Soujanya Y,Narahari G Sastry.Theoretical elucidation of the antioxidant mechanism of 1,3-dihydro-1-methyl-2 H-imidazole-2-selenol(MSeI)[J].Tetrahedron Letters,2007,48(12):2109-2112.
[15] Bhabak KP,Mugesh G.Functional Mimics of Glutathione Peroxidase:Bioinspired Synthetic Antioxidants[J].Acc.Chem.Res.,2010,43(11):1408-1419.
[16] Liu JQ,Gao SJ,Luo GM,et al.Artificial imitation of glutathione peroxidase with 6-selenium-bridged beta-cyclodextrin [J].Biochem Biophys Res Commun, 1998, 247(2):397-400.
[17] 贾振华,田连生,石万龙.硒化环糊精模拟谷胱甘肽过氧化物酶的研究[J].河北省科学学院学报,2000,17(3):172-174.
[18] Liu J,Luo G,Ren X,et al.A bis-cyclodextrin diselenide with glutathione peroxidase-like activity[J].Biochim Biophys Acta, 2000,1481(2):222-228.
[19] Lv SW,Wang XG,Mu Y,et al.A novel dicyclodextrinyl diselenide compound with glutathione peroxidase activity[J].FEBS Journal,2007,274(15):3846-3854.
[20] Ren XJ,Xue Y,Zhang K,et al.A novel dicyclodextrinyl ditelluride compound with antioxidant activity[J].FEBS Lett,2001,507(3):377-380.
[21] 薛雁,任晓君,张鲲,等.具有谷胱甘肽过氧化物酶活性的小分子模拟物2-TeCD保护线粒体抗氧化损伤[J].中国生物化学与分子生物学报,2002,18(4):506-510.
[22] Ren XJ,Xue Y,Liu JQ,et al.A novel cyclodextrin-derived tellurium compound with glutathione peroxidase activity[J]. ChemBio Chem,2002,3(4):356-363.
[23] Dong ZY,Liu JQ,Mao SZ.Aryl thiol substrate 3-carboxy-4-nitrobenzenethiol strongly stimulating thiol peroxidase activity of glutathione peroxidase mimic 2,2'-ditellurobis(2-deoxy-beta-cyclodextrin)[J].J Am Chem Soc,2004,126(50):16395-16404.
[24] 张鲲,任晓君,牟颖,等.谷胱甘肽过氧化物酶模拟物2-位碲桥联环糊精的合成及催化作用[J].催化学报,2003,24(2):97-102.
[25] Dong ZY,Huang X,Mao SZ,et al.Cyclodextrin-derived mimic of glutathione peroxidase exhibiting enzymatic specificity and high catalytic efficiency[J].Chem Eur J,2006,12(13):3575-3579.
[26] 吕绍武,牟颖,籍月彤,等.两种谷胱甘肽过氧化物酶模拟物抗紫外线损伤的研究[J].吉林大学学报(理学版),2006,44(3):497-500.
[27] Hao YQ,Liu XC,Liu JQ.Association mechanism of S-dinitrophenyl glutathione with two glutathione peroxidase mimics:2,2 cent-ditelluro-and 2,2 cent-diseleno-bridged b-cyclodextrins [J].Molecules,2009,14(3):904-916.
[28] Bell IM,Fisher ML,Wu ZP,et al.Kinetic studies on the peroxidase activity of selensubtilisin[J].Biochem,1999,32(14):3754-3762.
[29] 朱振齐,孙启安,丁兰,等.模拟谷胱甘肽过氧化物酶活性三肽的合成及表征[J].应用化学,1994,11(6):77-79.
[30] 朱振齐,罗贵民,丁兰,等.模拟谷胱甘肽过氧化物酶活性三肽的制备及性质研究[J].生物化学杂志,1995,11(3):338-342.
[31] 丁兰,朱振齐,罗贵民,等.化学诱变抗体模拟谷胱甘肽过氧化物酶[J].生物化学杂志,1994,10(3):296-299.
[32] 丁兰,朱振齐,罗贵民,等.化学修饰单克隆抗体模拟谷胱甘肽过氧化物酶[J].生物化学杂志,1996,12(5):553-558.
[33] Liu JQ,Luo GM,Ren XJ,et al.A bis-cyclodextrin diselenide with glutathione peroxidase-like activity[J].Biochem Biophys Acta,2000,1481(2):222-228.
[34] Liu,Mao SZ,Liu XM,et al.Functional mimicry of the active site of glutathione peroxidase by glutathione imprinted selenium-containing protein[J].Biomacromolecu les,2008,9(1):363-368.
[35] Sun Y,Li TY,Chen H,et al.Selenium-containing 15-mer pep-tides with high glutathione peroxidase-like acivity[J].J Biol Chem,2004,279(36):37235-37240.
[36] Ren X,Gao S,You D,et al.Cloning and expression of a single-chain catalytic antibody that acts as a glutathione peroxidase mimics with high catalytic efficiency[J].Biochem J,2001,359(Pt2):369-374.
[37] Ding L,liu Z,Zhu Z,et al.Biochemical characterization of selenium-containing catalytic antibody as a cytosolic glutathione perxidase mimic[J].Biochem J,1998,332(Pt1):251-255.
[38] Haratake M,Matsumoto S,Ono M,et al.Nanoparticulate glutathione peroxidase mimics based on selenocystine-pullulan conjugate[J].BioconjugChem,2008,19(9):1831-1839.
[39] 陈佳,张博殉,安洋,等.以透明质酸为骨架的新型谷胱甘肽过氧化物酶(GPX)模拟酶的制备及性质研究[J].高等学校化学学报,2006,27(11):2110-2113.
[40] Day BJ.Catalase and glutathione peroxidase mimics[J].Biochem pharmacol,2009,77(3):285-296.
Research Progress of Glutathione Peroxidase Mimics
Deng Ping,Jiang Junhao(School of Pharmacy of Chongqing Medical University,Chongqing 400016,China)
In order to provide scientific and reasonable references for the further study on glutathione peroxidase mimics,the research progress of glutathione peroxidase mimics was reviewed.The results indicated that the current representatives of glutathione peroxidase mimics have four types:small molecule compounds,cyclodextrin as a model for enzyme mimics,selenium-containing peptides as a model for enzyme mimics and polysaccharide as a model for enzyme mimics.The development trend in the future was also analyzed.
Glutathione;Peroxidase;Mimics
10.3969/j.issn.1672-5433.2012.03.007
2011-02-23)
邓萍,硕士,副教授。研究方向:药物化学。
蒋君好,男,执业药师,助理研究员。主要从事高等临床药学教育及药物化学研究。通讯作者E-mail:jiangjunhao82@163.com
