不同能量蛋白水平对绵羊睾丸生精细胞凋亡及相关基因表达的影响
2012-04-25徐晶晶张春香任有蛇岳文斌
徐晶晶,张春香,任有蛇,岳文斌
(山西农业大学 动物科技学院,山西 太谷030801)
细胞凋亡(apoptosis)又称程序性细胞死亡(programmed cell death,PCD),是由基因主导的细胞自主性消亡过程。目前已经证实,睾丸生殖细胞的凋亡与其他细胞的凋亡机制相似,是由多基因参与的复杂过程。Bcl-2家族在细胞凋亡调控中有重要作用,是影响细胞凋亡的关键因素之一。Bcl-2和Bax分别是Bcl-2家族中最有代表性的抑制凋亡和促进凋亡的基因。并且Bax是Bcl-2活性的主要调控因子[1]。研究发现外源营养物质可以调控哺乳动物的生殖细胞发育,并且有大量证据证明不同日粮蛋白水平对动物的生长性能、繁殖性能、精液品质是有影响的[2~6]。本试验利用能量和蛋白质水平同步变化的日粮饲喂绵羔羊,探讨日粮中不同能量蛋白水平对绵羊生精细胞凋亡的影响以及Bcl-2和Bax在此过程中的作用,旨在为通过营养调控手段提高绵羊生殖机能提供理论依据。
1 材料和方法
1.1 试验动物
在山西万荣昌肉羊养殖专业合作社选择18只健康状况良好、体重相似的杜泊×小尾寒羊(杜×小)杂种未去势公羔。
1.2 试验设计及日粮配方
在10天的适应期后,将18只羔羊随机分配到饲喂能量蛋白水平不同的3组中:100%自由采食组、65%采食组和35%采食组。日粮组成符合NRC标准(2007)。试验基础日粮配方及其营养水平见表1。
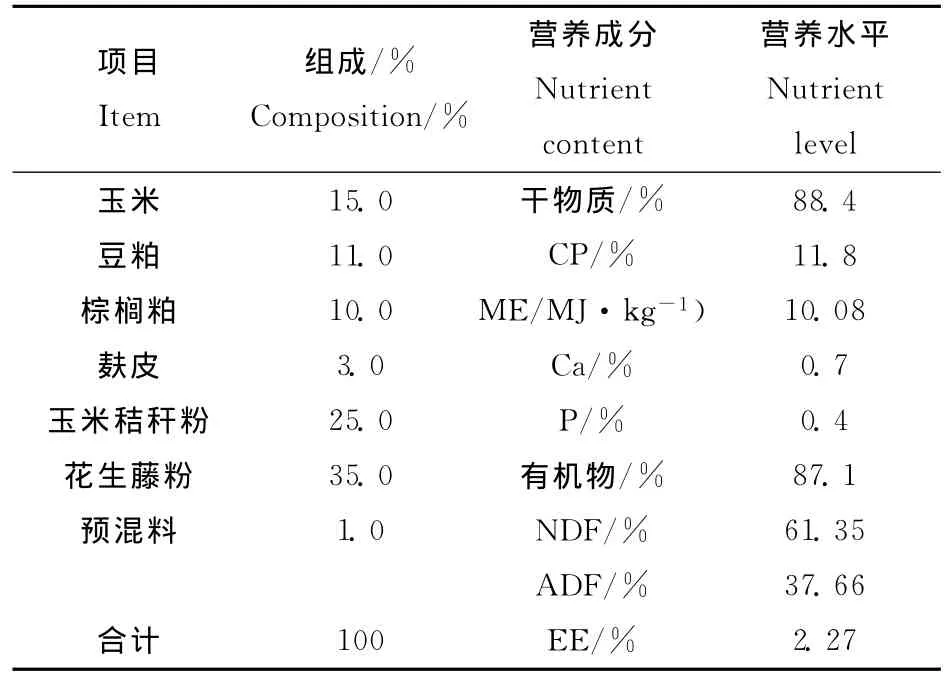
表1 试验基础日粮配方及其营养水平Table 1 Composition and nutrient level of basis diet in this study
1.3 饲养管理
试验于2010年6月~2010年8月在山西万荣昌肉羊养殖专业合作社进行,筛选出的羔羊在试验开始之前进行驱虫处理,并将其单独饲喂于配有料槽和水源的3m2的栏中。每天8∶00饲喂一次,自由饮水。每日晨饲前清除料槽内剩料并称重,保证自由采食组剩料约为饲喂量的10%,并根据前一天自由采食组的采食量计算限饲组每天的饲喂量,每天单独采集饲料和剩料样品(总量的10%采样)保存,然后将这些样品按照每只羊混合为总样品,55℃干燥至少72h,经过1mm孔筛粉碎,保存待测样品。试验羊每周称重一次。各组饲养水平见表2。
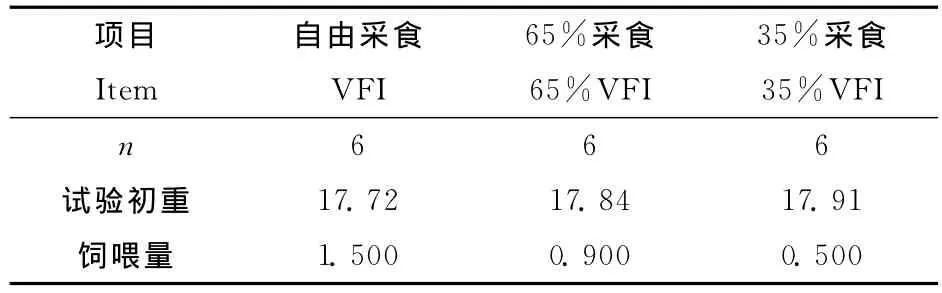
表2 试验各处理组的饲养水平Table 2 Feeding levels of the lambs in different treatments
1.4 屠宰取样
当100%自由采食组公羔体重达到35kg,所有的羔羊禁食禁水16h后,颈静脉放血屠宰,取睾丸组织保存备用。
1.5 检测方法
1.5.1 Bcl-2与Bax mRNA表达的检测
以B2 M 为看家基因,引用Shi等[7]设计的Bcl-2和Bax引物信息,在北京六合华大基因科技股份有限公司重新合成。根据TaKaRa SYBR PrimeScript RT-kit试剂盒进行反转录及PCR扩增,并且逐步优化反应体系,调整cDNA浓度和引物退火温度,筛选出目的基因与内参基因引物的最佳反应条件。试验得出Bcl-2和Bax引物的最适退火温度分别是54℃和56℃。随后进行所有样品目的基因的检测。数据分析采用SPSS18.0统计分析软件进行各组之间的方差分析,分析结果进行显著性检验,显著性水平为0.05。
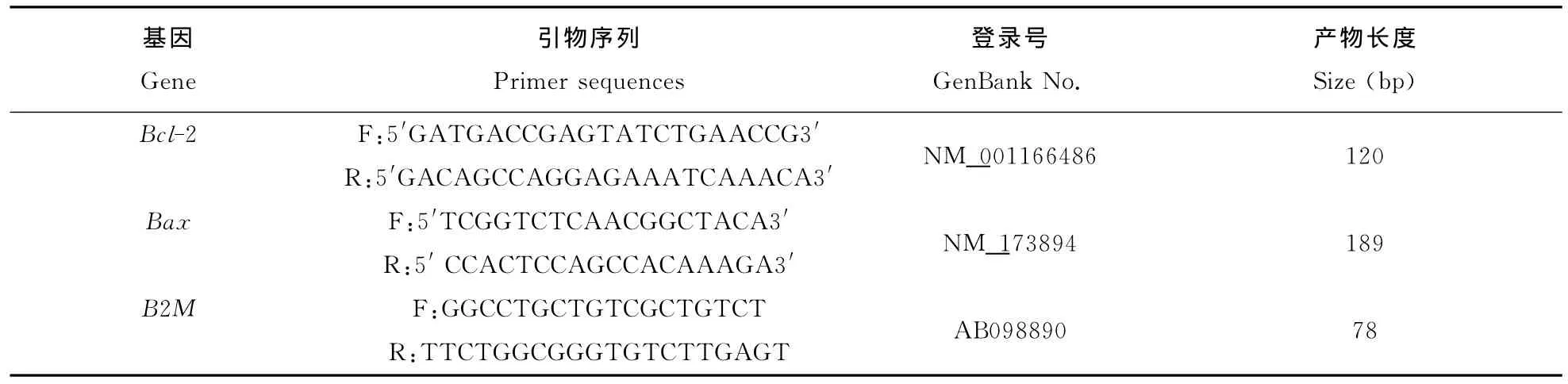
表3 Real-time PCR引物序列信息Table 3 Primer sequences for real-time PCR in this study
1.5.2 细胞凋亡检测
试验前玻片预先用多聚赖氨酸或APES进行处理,常规石蜡制片法制片,片厚5μm。用脱氧核糖核酸末端转移酶介导的缺口末端标记法(TUNEL)检测凋亡细胞。原位细胞凋亡检测试剂盒购于武汉博士德生物工程有限公司,过程按使用说明书,即切片常规脱蜡至水,用3%H2O2室温10min,蒸馏水洗5min×3次。标本片加0.01 mol·L-1TBS 1∶200新鲜稀释Proteinase K湿盒中37℃消化1~15min,0.01mol·L-1TBS洗涤2min×3次。标本片加标记缓冲液,以保证切片湿润。每张切片加缓冲液(TdT、DIG-d-UTP各1μL,标记缓冲液18μL),湿盒中37℃标记2h,TBS洗。滴加封闭液,室温放置30min,甩掉封闭液,不洗。加抗体稀释液1∶100稀释的生物素化抗地高辛抗体,湿盒中37℃反应30min,TBS洗。加抗体稀释液1∶100稀释的SABC,湿盒中37℃反应30min,TBS洗。DAB显色10~30min,水洗。苏木精轻度复染,洗涤后脱水、透明、封片。光学显微镜下观察,阳性染色定位于细胞核,呈棕黄色。每个个体在显微镜下取至少5个视野进行拍照,使用Image Pro Plus 6.0图像分析软件进行分析,得出每个视野中的阳性细胞数,对所得的数据用SPSS18.0软件进行统计分析和差异显著性检验。
2 试验结果
2.1 不同能量蛋白水平对公羔睾丸中Bcl-2 mR NA表达的影响
Bcl-2基因的荧光定量扩增曲线如图1所示。由图2可以看出,不同能量蛋白水平组的公羊睾丸中,Bcl-2mRNA在65%采食组的表达量最低,在35%采食组中的表达量最高。35%采食组中的Bcl-2mRNA 表达量显著高于65%采食组和100%自由采食组(P<0.05),虽然100%自由采食组的表达量高于65%采食组,但两者之间并无显著差异(P<0.05)。
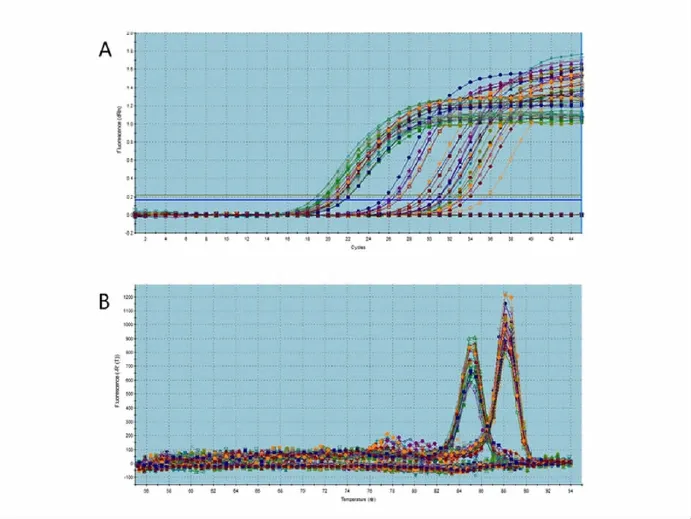
图1 Bcl-2和B2 M 的扩增动力学曲线(A)和溶解曲线(B)Fig.1 The PCR amplification plots(A)and dissociation curve(B)for Bcl-2and B2 M
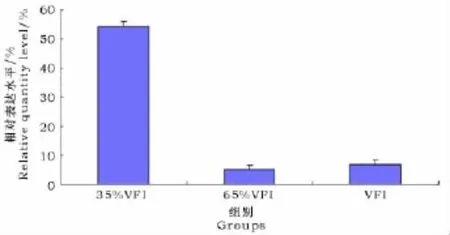
图2 各组羔羊睾丸中Bcl-2mRNA表达Fig.2 Bcl-2mRNA expressions in the lambs in different treatments
2.2 不同能量蛋白水平对公羔睾丸中Bax mR NA表达的影响
Bax基因的荧光定量扩增曲线如图3所示。各处理组中Bax mRNA的表达如图4所示,Bax mRNA在100%自由采食组表达量最低,在35%采食组中表达量最高。35%采食组中的Bax mRNA表达量显著高于65%采食组和100%自由采食组(P<0.05),虽然100%自由采食组的表达量低于65%采食组,但两者之间并无显著差异(P>0.05)。
图3 Bax和B2 M 的扩增动力学曲线(A)和溶解曲线(B)Fig.3 The PCR amplification plots(A)and dissociation curve(B)for Baxand B2 M
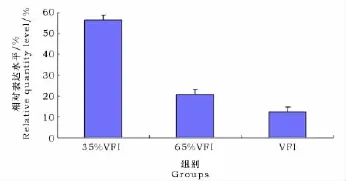
图4 各组羔羊睾丸中Bax mRNA表达Fig.4 Bax mRNA expressions in the lambs in different treatments
2.3 不同能量蛋白水平对公羔睾丸生精细胞凋的影响亡
由图5可以看出,35%采食组羔羊睾丸中的凋亡细胞数量最多,100%自由采食组中凋亡细胞数量最少。35%采食组中的凋亡细胞数量显著高于65%采食组和100%采食组(P<0.05)。虽然100%自由采食组的凋亡数量低于65%采食组,但两者之间并无显著差异(P>0.05)。
从TUNEL结果(图6)可以看出,35%采食组细胞凋亡发生在精子产生的各个阶段,曲细精管中未见成熟精子。而65%采食组和100%自由采食组凋亡的细胞主要发生在精原细胞和初级精母细胞中,曲细精管中能清晰看到成熟的精子,且随着能量蛋白增加,精子数量有增加趋势。
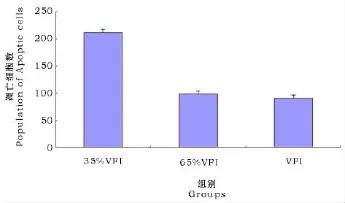
图5 各组羔羊睾丸中的细胞凋亡数量Fig.5 Apoptotic cells in testis of the kids in different treatments
3 结论与讨论
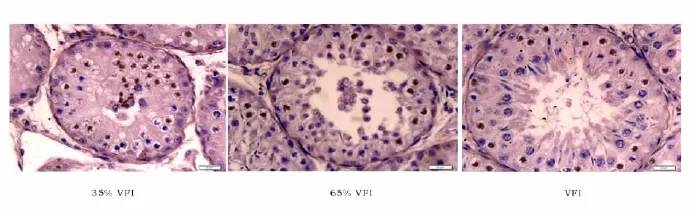
图6 各处理组绵羊睾丸TUNEL结果Fig.6 TUNEL in testis of the kids in different treatments
研究发现,环境中一些不利因素如营养缺乏可导致正常组织细胞凋亡。王全溪等[9]在饲料中添加不同含量的锌,得出锌含量过低或过高都能够诱导雏番鸭免疫器官细胞凋亡。Fraker[10]曾用缺锌饲料喂养小鼠,7周后发现胸腺萎缩殆尽。有证据证明不同日粮水平对动物的生长性能、繁殖性能和精 液 品 质 等 是 有 影 响 的[2~6]。景 炜 等[4]研 究 日 粮不同能量和蛋白水平对多浪羊繁殖性能及血液生化指标的影响,得出提高日粮能量水平对多浪羊春季发情率的提高有明显效果。李静[11]在研究日粮能量、蛋白水平对辽宁绒山羊种公羊精液品质和产绒性能的影响中得出日粮高蛋白水平可显著提高采精量和精液密度,极显著提高有效精子数和冷冻精液生产数量。刘洪波[12]研究日粮维生素E水平对羊精液品质的影响,得出日粮中添加适宜剂量的维生素E有助于提高绵、山羊采精量、精子密度和鲜精活率。根据以上证据推测日粮水平可以调控生精细胞的凋亡。本试验验证了这一推论。试验结果表明,不同能量蛋白水平饲喂下,35%采食组绵羊生精细胞凋亡数量最多,表现在精子形成的各个阶段,曲细精管中未见成熟精子。65%采食组和100%自由采食组绵羊生精细胞凋亡数量较少,凋亡主要发生在精原细胞和初级精母细胞中,曲细精管中成熟的精子清晰可见。因此不同能量蛋白水平是可以影响绵羊睾丸生精细胞的凋亡。
Kerr等[7]于1972年首先提出细胞凋亡,指有核细胞在特定条件下通过启动内部机制,经过一连串的细胞变性,最终发生死亡的过程。睾丸生殖细胞的凋亡与体细胞的增殖分化一样受多种基因调控[8]。Bcl-2基因家族是细胞凋亡的重要调控基因。根据基因在细胞生长发育中所起的作用不同将Bcl-2家族的基因分为两类:一类是细胞凋亡促进基因,一类是细胞凋亡抑制基因。1993年Oltvai等[13]首先发现Bax基因,它是Bcl-2家族的新成员,编码的Bax蛋白是重要的促细胞凋亡因子,能对抗Bcl-2的生物学活性,过量表达可诱导细胞凋亡。一般认为Bax主要诱导凋亡,而Bcl-2则抑制凋亡,二者是互为相关调节基因[14]。两者表达水平间的平衡决定着细胞的生死存亡[15]。近年来的研究提示,Bcl-2和Bax这两种基因均参与了生精细胞凋亡的过程。
为了探讨日粮不同能量蛋白水平对生精细胞凋亡的影响,本试验选取了Bcl-2,Bax作为凋亡的指标。Bax作为细胞凋亡的促进基因,其表达量随着日粮能量蛋白水平下调而增加,说明日粮能量蛋白水平越低细胞凋亡数量越多,这与TUNEL的结果是相吻合的。而Bcl-2作为细胞凋亡抑制基因,低能量蛋白水平下表达量增加,可能原因是日粮能量蛋白缺乏,导致精子发生过程中生精细胞大量凋亡,从而致使Bcl-2过量表达来抑制细胞凋亡。这样的结果验证了Vandaele等[16]得出的结论:Bcl-2的表达量并不能作为细胞凋亡的标志。因此,不同能量蛋白水平可以影响绵羊睾丸生精细胞凋亡,而Bcl-2和Bax参与了凋亡调控过程。
[1]Rosse T,Olivier R,Monney L,et al.Bcl-2prolongs cell survival after Bax-induced release of cytochrome c[J].Nature,1998,391(6666):496-499.
[2]李辉,刁其玉,张乃锋.不同蛋白水平对犊牛生长、营养代谢及氨基酸消化率的影响[J].畜牧兽医学报,2008,39(11):1510-1516.
[3]戈新,王建华,张宝珣,等.营养水平对崂山奶山羊羔羊生长性能的影响[J].反刍动物营养,2011(3):60-61.
[4]景炜,蒲雪松,卞欣欣,等.日粮不同能量和蛋白水平对多浪羊繁殖性能及血液生化指标的影响[J].中国草食动物,2010,30(5):21-25.
[5]刘鹤翔,欧阳叙向,邓灶福,等.不同营养水平补饲对湘东黑山羊肥育羔羊生产性能的影响[J].中国草食动物,2006,26(6):9-11.
[6]张拴林,岳文斌,黄应祥.不同能量水平对羊生产性能及激素水平的影响[J].中国畜牧杂志,2006,42(9):39-42.
[7]Kerr J F,Wyllie A H,Cuiile.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br J Cancer,1972,26(4):239-257.
[8]Shi lei,Yue Wenbin,Zhang Chunxiang,et al.Effects of maternal and dietary selenium(Se-enriched yeast),on oxidative status in testis and apoptosis of germ cells during spermatogenesis of their offspring in goats[J].Animal Reproduction Science,2010,119:212-218.
[9]王全溪,邵良平,林树根,等.日粮锌水平对雏番鸭免疫器官中细胞凋亡及Fas表达的影响[J].动物营养学报,2008,20(5):509-514.
[10]Pamela J Franker,Suzanne M Haas,Richard W Luecke.Effect of zine deficiency on the immune response of the young adult A/J mouse[J].Nutrition,1977,107:1889-1895.
[11]李静.日粮能量、蛋白水平对辽宁绒山羊种公羊精液品质和产绒性能的影响[D].沈阳:沈阳农业大学,2007.
[12]刘洪波.日粮维生素E水平对羊精液品质的影响[D].北京:中国农业大学,2005.
[13]Oltvai Z N,Milliman C L,Korsmeyer S J.Bcl-2heterodimerizes in vivo with a conserved homolog,Bax,that accelerates programmed cell death[J].cell,1993,74(4):609-619.
[14]成立新,梁杰,汤少明,等.细胞凋亡抑制基因Bcl-2在血管瘤发病中作用的研究[J].中华整形烧伤外科杂志,1999,15(1):35-36.
[15]Jiang Yuhua,Xu Linhao,Luo yiren,et al.Effects of trehalose on bcl-2and bax mRNA expression in the cryopreserved sternum[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(21):3975-3978.
[16]Vandaele L,Goossens K,Peelman L,et al.mRNA expression of Bcl-2,Bax,caspase-3and-7cannot be used as a marker for apoptosis in bovine blastocysts[J].Animal Reproduction Science,2008,106:168-173.
