青藏高原老芒麦和垂穗披碱草SSR分子标记鉴别
2012-04-25雷云霆窦全文
雷云霆,窦全文
(1.中国科学院西北高原生物研究所,青海 西宁 810001;2.中国科学院研究生院,北京 100049)
老芒麦(Elymussibiricus)和垂穗披碱草(E.nutans)是禾本科小麦族披碱草属多年生疏丛草本植物,是青藏高原高寒区具有广泛分布的野生资源。老芒麦和垂穗披碱草对该地区极端寒冷干旱的生态环境具有良好的适应性和广泛的生态可塑性[1-2],且高产优质,故已经成为该地区栽培利用的最为广泛的当家牧草草种[3-4]。目前生产中,主要栽培利用的老芒麦和垂穗披碱草品种都是在搜集当地野生种质资源的基础上,通过筛选、鉴定、选育而来的应用面积较广的品种有同德老芒麦、青牧1号、川草1号等[5-7]。青藏高原分布的老芒麦和垂穗披碱草野生种质资源,是对这两个草种进行进一步遗传改良的重要物质基础,该地区生长的这两个物种野生种质资源的采集、鉴定对于高寒牧草育种具有重要意义。
老芒麦和垂穗披碱草皆为花序下垂类披碱草属物种,在经典的分类学上,通过一些形态学特征可将这两个物种进行很好地区分。但是,在实际野外种质资源采集中,由于形态学特征受到生长环境的影响,对二者进行准确地区分比较困难。卢红双等[8]对于来源于不同地区的49份穗型下垂类披碱草进行形态学鉴定和聚类分析研究后认为,老芒麦和垂穗披碱草在长期适应进化过程中,两个种不同的生态型在形态性状上具有较多的性状交叉,使得分类学的鉴定很困难。在对从美国国家植物种质资源库(NPGS)引进的10多份垂穗披碱草种质利用细胞学进行鉴定时,发现其中有部分种质实际上是老芒麦。由此可见,在野外种质资源搜集中,将老芒麦和垂穗披碱草混淆是一个比较常见的问题。
在细胞学水平上,老芒麦是异源四倍体物种,染色体数为28,染色体组组成为StStHH[9];垂穗披碱草为异源六倍体物种,染色体数为42,染色体组组成为StStHHYY[10],其中St组来自拟鹅冠草属(Pseudoroegneria)[11],H组来自大麦属(Hordeum)[12],Y组的来源尚不清楚[13]。显然,通过细胞学观察,可以将这两个物种很清楚地区分开来。但实际工作中,染色体的准确鉴定一般需要具有一定细胞学研究经验的研究者,而且操作过程相对费时、费力。DNA分子标记具有多态性高,无组织、器官及发育时期的特异性,不受环境条件的影响等优点,分子标记技术已经应用于植物遗传育种的各个领域,尤其是基于PCR反应的分子标记技术,由于操作简便、快速,现已成为众多实验室的常规技术手段。在众多分子标记类型中,SSR(Simple Sequence Repeat)分子标记具有共显性、重复性好、稳定性高等优点,尤其受到遗传育种工作者的青睐。
本研究首先利用细胞学技术对老芒麦和垂穗披碱草种质进行鉴定,然后利用普通小麦(Triticumaestivum)中开发出的SSR分子标记对老芒麦和垂穗披碱草进行多态性筛选,并对筛选出的多态性标记进行广泛性验证,在此基础上,筛选出能够鉴别老芒麦和垂穗披碱草种质的SSR分子标记。
1 材料与方法
1.1材料 研究材料由两部分组成,一部分材料由美国国家植物种质库(NPGS)引进(表1),这部分材料被原始搜集者鉴定为垂穗披碱草,因此均被当作垂穗披碱草种质引进;另一部分材料在青海当地搜集(表2),其中多叶老芒麦(Qingmu No.1)和同德老芒麦(Tongde)是高寒牧区广泛种植的品种,其他为野外采集材料,这些材料种名鉴定由中国科学院西北高原生物研究所专门从事小麦族分类学研究的专家完成。青海当地材料和野外采集材料均为种子成熟期采集的种子,干燥环境保存备用。
1.2方法
1.2.1细胞学鉴定 经过低温破除休眠处理的披碱草种子在室温下发芽,剪取1~2 cm胚根,冰水预处理24 h,卡诺液室温固定2 h以上,切取根尖分生区用45%醋酸压片。制片首先在Leica显微系统相差装置下进行观察,选取中期分裂相良好的制片在-80 ℃冰箱冰冻处理1 h后揭片,然后利用DAPI进行套染,利用Leica显微系统荧光装置进行观察和照相。

表1 引进的垂穗披碱草材料

表2 在青海地区搜集的披碱草属野生材料和品种
1.2.2引物筛选与PCR扩增 从公布在国际小麦族协作网(www.wheat.pw.usda.gov/)的小麦基因组SSR和EST-SSR引物中挑选42对引物(引物由上海生工生物工程公司合成)。参考李景环等[14]的CTAB法提取所需披碱草属材料总DNA。PCR反应体系和程序参照Röder等[15]的方法,通过优化调整最终优化的25 μL PCR扩增体系:模板DNA 1.5 μL (50 ng·μL-1),10×PCR Buffer 2.5 μL (含Mg2+),dNTP 2 μL (2.5 mmol·μL-1),Taq DNA聚合酶0.2 μL(5 U·μL-1),上下游引物均为1.0 μL (10 μmol·μL-1);ddH2O补足体积。PCR扩增条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min,4 ℃保存。所有反应在Applied Biosystems PCR仪上进行。
1.2.3SSR引物PCR产物的检测 扩增产物在8%聚丙烯酰胺凝胶上用1×TBE缓冲液进行电泳分离,经溴化乙锭稀释液染色后,用Vilber Leurmat自动成像系统照相。
2 结果与分析
2.1细胞学鉴定 观察根尖细胞有丝分裂中期分裂相,可以很清楚地将四倍体(图1)和六倍体(图2)区分开来。
对引进的所有垂穗披碱草种质进行细胞学鉴定结果表明,14份材料中有5份材料染色体数为28,与预期染色体数42不符(表3)。因此,这5份材料,虽然当初被采集者据形态学鉴定为垂穗披碱草,并被归类为垂穗披碱草种质,但实际上为老芒麦。这些材料的采集地分布在四川、内蒙、青海、甘肃、新疆等不同地点,并由不同采集者鉴定。由此可见,由于老芒麦和垂穗披碱草形态上的相似性及在不同生态环境下的变异性,其种质在形态鉴定上很容易混淆。

图1 6号材料(PI 531644)有丝分裂中期

图2 1号材料(PI 499450)有丝分裂中期
表3 引进垂穗披碱草材料细胞学鉴定结果
对在青海采集的披碱草材料进行细胞学鉴定结果表明,所有材料染色体数与预期相符,即同德老芒麦、多叶老芒麦及其他3种野生老芒麦材料的染色体数为28;而垂穗类披碱草材料的染色体数为42。
2.2EST-SSR多态性初步筛选 考虑到六倍体垂穗披碱草(染色体组为StHY)比四倍体老芒麦(染色体组为StH)多一组染色体Y,因此对老芒麦和垂穗披碱草多态性引物筛选中,能稳定地在垂穗披碱草材料中扩增出可能来自Y染色体组的额外遗传位点的产物,以区别于老芒麦,有可能作为区别老芒麦和垂穗披碱草较理想的分子标记。以经过细胞学鉴定的15号材料同德老芒麦和16号材料多叶老芒麦为老芒麦代表,11号和12号材料为垂穗披碱草代表,利用已经过前期研究在披碱草中具有扩增产物的42对小麦的SSR引物对这两类材料进行多态性筛选,结果表明,42对SSR引物中,Xcwem38c可能稳定、重复地将这两类材料区分开,Xcwem38c在垂穗披碱草材料中扩增出的在130~180 bp的多态性条带在老芒麦材料中缺乏(图3),说明其能够较好地区分老芒麦和垂穗披碱草。
2.3EST-SSR多态性标记的进一步验证 在对多态性标记初步筛选中仅用了两对老芒麦和垂穗披碱草材料。对引进的垂穗披碱草种质的细胞学鉴定结果表明,这些材料中既有垂穗披碱草又有老芒麦,由于这些材料来自于四川、内蒙、新疆、西藏、青海、甘肃等地,在生态环境分布上跨距较大。为了进一步验证筛选出的标记的有效性,利用Xcwem38c对这些材料进行了扩增,结果表明,在15号同德老芒麦和16号多叶老芒麦以及4、6、7、8和10号材料中没有多态性条带的扩增产物出现,其余材料中(除12号外)均在150 bp左右有两条多态性条带,而12号材料在约110和160 bp有多态性条带,以区别于老芒麦(图4)。
对1~14号材料的细胞学鉴定表明,4、6、7、8和10号材料为四倍体28条染色体,在本研究中这5个材料中都没有多态性扩增产物,利用Xcwem38c引物对这些材料的鉴定结果与细胞学鉴定的结果非常一致。12号材料多态性条带分子量大小有别于其他六倍体垂穗披碱草材料,表明这个材料可能与其他种质具有较大的遗传分化。由于这些材料生境分布上距离比较远,而利用Xcwem38c扩增出的多态性分子标记能稳定地将这些材料辨别,表明筛选到的SSR引物Xcwem38c能够准确地在分子水平上将老芒麦和垂穗披碱草区分开来。

图3 部分SSR引物扩增结果

图4 引物Xcwem38c在14份引进材料上的扩增结果
2.4EST-SSR多态性标记在青藏高原野生材料中的广泛性验证 利用Xcwem38c对不同来源的老芒麦和垂穗披碱草材料进行扩增时,无论是老芒麦还是垂穗披碱草中都会在100 bp左右有一条带在两个物种中稳定扩增出现,而在其他试验材料中150 bp左右大多有两条多态性条带。为了进一步验证SSR引物Xcwem38c的稳定性、可靠性和广泛性,选取具有代表性的青藏高原野生老芒麦和垂穗披碱草材料,进行PCR扩增反应(图5)。17~20号和21~23号材料都是经过形态学和细胞学鉴定的野生垂穗披碱草和老芒麦材料,Xcwem38c在这些野生材料中的PCR扩增结果和细胞学鉴定结果相吻合。结果表明,SSR引物Xcwem38c可以在这些材料中进行稳定性扩增,进一步验证筛选到的EST-SSR引物Xcwem38c能够准确可靠地在分子水平上将老芒麦和垂穗披碱草区分开来。
3 讨论与结论
垂穗披碱草和老芒麦都是披碱草属的常见种,分类学家常常根据外部形态学性状进行区分,垂穗披碱草形态学性状主要表现为,穗状花序紧密、小穗排列多偏向于穗轴一侧等特征,而老芒麦则表现为穗状花序疏松、小穗排列不偏于穗轴一侧的特征[16-17]。对从美国引进的垂穗披碱草种质的鉴定以及有关研究[4]的结果来看,在不同生态环境中老芒麦和垂穗披碱草种质,由于对环境的适应性,形态学上的某些变异常会对这两种草种的鉴定造成干扰。DNA分子标记是一类不依赖于形态学的遗传标记,由于分子标记鉴定是对生物体遗传物质的直接鉴定,相对于形态学标记鉴定,分子标记鉴定更为直接、客观、准确。垂穗披碱草和老芒麦在细胞学上倍性不同,在本研究中,通过细胞学鉴定以及在广泛筛选出的小麦EST-SSR引物Xcwem38c扩增出的多态性标记可以对垂穗披碱草和老芒麦进行有效辨别。
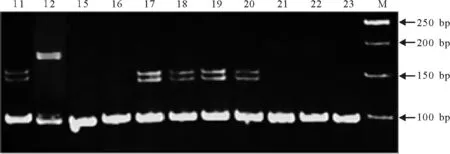
图5 引物Xcwem38c在野生材料上的扩增结果
本研究利用在小麦中开发出的SSR标记,进行了可区分老芒麦和垂穗披碱草的多态性标记筛选。结果表明,一些SSR标记尤其是EST-SSR标记在不同物种之间具有良好的通用性。对披碱草属SSR标记研究较早的Sun等[18],曾经成功地利用小麦SSR引物对披碱草属物种进行了种群遗传多样性分析;MacRitchie和Sun[19]也曾经利用来自小麦和大麦(Hordeumvulgare)的SSR引物对细茎披碱草(E.trachycaulus)的遗传多样性分析,并指出,麦类SSR引物在小麦族近缘物种中具有一定的通用性;严学兵等[20]通过对不同来源SSR标记在中国披碱草属植物的通用性和效率评价指出,亲缘关系较近的小麦以及披碱草属SSR引物遗传分析的效率更高,即亲缘关系越近SSR引物通用性越好。由于目前直接从老芒麦和垂穗披碱草中开发出来可供利用的SSR标记缺乏,因此利用亲缘关系较近物种中已经开发出来的SSR引物也不失为一条较好的捷径。
老芒麦和垂穗披碱草是青藏高原高寒区重要的禾本科类牧草,DNA分子标记的应用,将有效促进这两类牧草种质资源的搜集、鉴定以及育种引用。随着SSR分子标记开发技术的改进[21],开发老芒麦和垂穗披碱草自身的SSR引物显得更为经济、简便、可行。本研究从42对小麦的SSR引物中筛选到了一对可以区分老芒麦和垂穗披碱草的引物,在今后的研究中,在开发大量老芒麦和垂穗披碱草自身的SSR引物的基础上,可筛选出更多重复、稳定地进行物种区分的分子标记,并有望能在分子水平上对老芒麦和垂穗披碱草种质的不同生态型进行准确区别和鉴定。
[1]德英,赵来喜,穆怀彬.30份老芒麦种质材料抗寒性研究[J].草业科学,2011,28(1):90-93.
[2]陈功,贺兰芳.高寒地区两种老芒麦生态适应性和生产性能评价[J].草业科学,2004,21(9):39-41.
[3]鄢家俊,白史且,常丹,等.青藏高原老芒麦种质遗传多样性的SSR分析[J].中国农学通报,2010,26(9):26-33.
[4]陈智华,苗佳敏,钟金城,等.野生垂穗披碱草种质遗传多样性的SRAP研究[J].草业学报,2009,18(5):192-200.
[5]鄢家俊,白史且,马啸,等.老芒麦遗传多样性及育种研究进展[J].植物学通报,2007,24(2):226-231.
[6]鄢家俊,白史且,张新全,等.青藏高原老芒麦种质基于SRAP标记的遗传多样性研究[J].草业学报,2010,19(1):173-183.
[7]鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析[J].草业学报,2010,19(4):122-134.
[8]卢红双,徐柱,马玉宝,等.披碱草属垂穗型下垂类种质的形态学鉴定及其聚类分析[J].云南农业大学学报,2008(2):150-161.
[9]Dewey D R.The genomic system of classification as a guide to intergeneric hybridization with the perennial Triticeae[A].In:Gustafson P J.Gene Manipulation in Plant Improvement [M].New York:Plenum Press,1984:209-279.
[10]Lu B R.Meiotic studies ofElymusnutansandE.jacquemontii(Poaceae,Triticeae) and their hybrids with Pseudoroegneria spicata and seventeenElymusspecies[J].Plant Systematics and Evolution,1993,186:193-212.
[11]Dewey D R.Cytogenetics ofAgropyronugamicumand six of its interspecific hybrids [J].Botanical Gazette,1980,141:469-478.
[12]Love A.Conspectus of the Triticeae[J].Feddes Repert,1984,95:425-521.
[13]Wang RR-C,von Bothmer R,Dvorak J,etal.Genome symbols in the Triticeae[A].Proceedings of the 2nd international Triticeae Symposium,Logan,Utah[C].Logan:University Publication Design and Production,1994:29-34.
[14]李景环,云锦凤,邵丽华,等.老芒麦总DNA提取方法探讨[J].内蒙古师范大学学报(自然科学汉文版),2008,37(4):543-545.
[15]Röder M S,Plaschke J,König S U,etal.Abundance,variability and chromosomal location of microsatellites in wheat[J].Molecular and General Genetics,1995,246:327-333.
[16]郭本兆.中国植物志[M].北京:科学出版社,1987:6-10.
[17]刘尚武.青海植物志[M].西宁:青海人民出版社,1999:97-99.
[18]Sun G L,Salomon B,Bothmer R.Analysis of tetraploidElymusspecies using wheat microsatellite markers and RAPD markers[J].Genome,1997,40:806-814.
[19]MacRitchie D,Sun G.Evaluating the potential of barley and wheat microsatiellite markers or genetic analysis ofElymustrachycauluscomplex species[J].Theoretical and Applied Genetics,2004,108:720-724.
[20]严学兵,王堃,周禾,等.不同来源SSR标记在我国披碱草属植物的通用性和效率评价[J].草业学报,2008,17(6):112-120.
[21]Zang L,Bargelloni L,Patarnello T.Strategies for microsatellite isolation:a review[J].Molecular Ecology,2002,11:1-16.
