改良“二次枕大池注血法”构建Wistar大鼠蛛网膜下腔出血模型☆
2012-04-20马朝晖李贵福罗望池黄燕
马朝晖李贵福罗望池黄燕
李铁林*
改良“二次枕大池注血法”构建Wistar大鼠蛛网膜下腔出血模型☆
马朝晖*李贵福*罗望池*黄燕*
李铁林*
目的总结大鼠“二次枕大池注血法”构建蛛网膜下腔出血模型的经验体会。方法通过对“二次枕大池注血法”进行步骤简化及改良:①省去穿刺环枕膜、抽取脑脊液步骤;②不必完全显露环枕膜。通过断头取脑后直接观察判断建模是否成功。结果术中死亡大鼠14只,成功复制蛛网膜下腔出血模型大鼠120只(89.6%)。术后35只模型大鼠出现意识改变、肢体偏瘫等神经功能缺损症状(29%)。结论改良的“二次枕大池注血”法建蛛网膜下腔出血模型具有较高的成功率,控制穿刺进针角度及深度,控制注血量和注血速度,防止堵管是造模成功的关键。
大鼠 蛛网膜下腔出血 模型
自发性蛛网膜下腔出血是临床神经科常见的重症,有很高的致死率和致残率,故其是基础及临床研究的热点。“二次枕大池注血”构建蛛网膜下腔出血模型是目前最为认可的造模方式。因研究需要,我们采用Wistar大鼠进行 “二次枕大池注血”构建蛛网膜下腔出血模型134例,取得了一定的经验,并对造模步骤进行了简化,现汇报如下。
1 材料和方法
1.1 研究对象 SPF级Wistar大白鼠134只,雌雄各半,鼠龄10~12周,体质量250~320 g。由南方医科大学实验动物中心提供。主要器械:PSMB双目动物手术显微镜(物镜F200),显微手术器械1套(主要包括显微剪1把,直钳及弯钳各1把),眼科直剪和弯剪各1把,普通小弯钳2把,动物手术固定板1快,20cm长线绳4根。
1.2 “二次枕大池注血”建模方法 10%水合氯醛(3 mL/kg)腹腔注射麻醉后,大鼠头部及左侧股动脉区备皮。常规消毒,取俯卧位,以枕外隆凸为中点取约1.0 cm直切口,分离皮下筋膜,从前向后正中纵行剪开浅层肌肉约8 mm,暴露颈夹肌间隙,小弯钳牵开双侧夹肌,显微剪稍进行分离,并初步定位枕骨、环椎及环枕膜,随后大鼠改仰卧位,手术显微镜下暴露一侧股动脉,用1 mL注射器抽取股动脉血0.3~0.4 mL,棉签压迫股动脉止血良好后,改俯卧位,小弯钳牵开双侧夹肌,用注射器针头沿枕骨下滑至枕骨大孔处刺破环枕膜并稍稍推进到达枕大池,在2 min内将血液注入枕大池;注血后环枕膜穿刺处填塞明胶海绵一块,俯卧位头低30°约30 min。以利血液沉积在脑底血管周围,缝合头部及股部切口。48 h后同法抽取另一侧股动脉血0.2~0.3 mL(1 mL/kg)注入枕大池,制成大鼠SAH动物模型。
1.3 造模成功判定标准 在进行第2次注血时可发现大部分大鼠均存在少量血性脑脊液漏出,可证实穿刺位置在蛛网膜下腔;因实验需要造模动物均需进行心脏心脏生理盐水及4%多聚甲醛灌注后断头取脑,在取脑时可见脑底基底池均可见明显蛛网膜下腔出血。
2 结果
术中死亡大鼠14只,成功复制蛛网膜下腔出血模型大鼠120只(89.6%)。术后35只(29%)模型大鼠出现意识改变、肢体偏瘫等神经功能缺损症状。见图1。
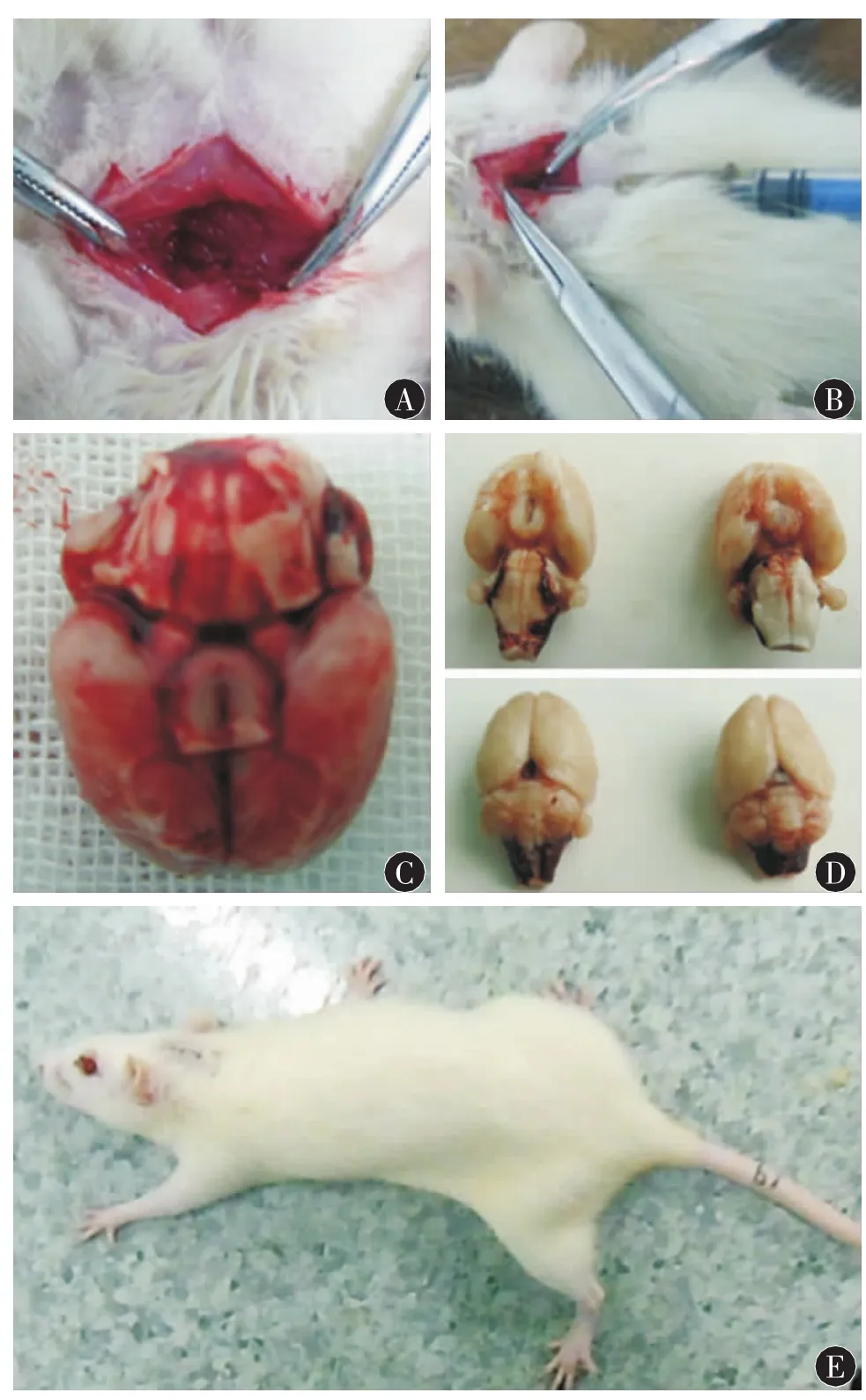
图1 A:由前向后正中纵行剪开浅层肌肉约8 mm,暴露颈夹肌间隙,小弯钳牵开双侧夹肌,显微剪稍进行分离。B:注射器首先保持与背部15°~30°,针尖顶住枕骨,将针头沿枕骨下滑到环枕联合处,然后穿刺环枕膜,有透空感后,进针深度保持在5 mm以内。C:2次注血成功后即时断头取脑见基底池及脑表面明显积血,脑组织肿胀。D:2次注血成功后心脏生理盐水及4%多聚甲醛灌注后断头取脑,脑干、基底池均可见明显蛛网膜下腔出血。E:2次注血造模1 d后大鼠右侧肢体偏瘫。
3 讨论
目前针对蛛网膜下腔出血后继发脑血管痉挛和脑缺血的实验研究较多,其动物实验的主要造模方法有“单次枕大池注血法”、“二次枕大池注血法”、颅内血管穿刺法或颅内动脉周围致痉挛物质或缩血管物质法[1,2]。“单次枕大池注血法”引起脑血管痉挛发生率低,在颅内动脉周围注入致痉挛物质或缩血管物质法又因为与蛛网膜下腔出血发病机制存在区别而较少人采用[1]。故目前多以“二次枕大池注血法”、颅内血管穿刺法为主,但后者由于损伤大,容易造成脑组织损伤以及出血量不容易控制,容易引起大鼠死亡,死亡率达到16%~44%[2-4]。“二次枕大池注血法”操作简单,效果明显,易施行血管造影,动物死亡率低,如操作熟练,甚至可到达零死亡[5],而且费用较低,被认为是较为理想的症状性CVS动物模型,故应用最为广泛[2,6-8]。本研究参考Pereira等的“二次枕大池注血法”造模方法[8],并进行了步骤的简化以及部分改良:①省去穿刺环枕膜、抽取脑脊液步骤。此步骤目的主要为确定穿刺针是否在蛛网膜下腔。此步骤可以考虑省略。在本组实验过程中,采取股动脉采血后直接穿刺环枕膜。在定位环枕膜时可将针头沿枕骨下滑到环枕联合处,然后穿刺环枕膜,有透空感后注射血液。②不必完全显露环枕膜。如果要完全显露环枕膜,则需充分分离颈部肌肉,而在分离枕部粗隆及环椎肌肉附着点时容易引起出血。可以以枕外隆凸为中点取约1.0 cm皮肤直切口,分离皮下筋膜,由前向后正中纵行剪开浅层肌肉约8 mm,暴露颈夹肌间隙,小弯钳牵开双侧夹肌,显微剪稍进行分离,并初步定位枕骨、环椎及环枕膜,然后在穿刺时将针头沿枕骨下滑到枕骨大孔边缘,然后穿刺环枕膜,有透空感后注射血液。同样可达到准确穿刺(图1)。此两个环节可节省时间5~10 min,减少了穿刺损伤致死或组织损伤的可能。吴氏报道[9]采用直接经皮穿刺,但在实际操作中,由于大鼠颈部皮肤非常松弛,穿刺时位置容易变动,而且皮下肌肉组织未进行分离,定位环枕膜比较困难,可能需要反复的穿刺,反而增加了损伤,故适当的分离有助于穿刺成功。建模的成功与否与术者的经验直接相关,本组大鼠的死亡主要发生在预实验阶段(6/20),实验阶段早期前30只大鼠建模术中死亡2只(6.7%),中期54只死亡6只(11.1%),而后30只大鼠无1只术中死亡。
在整个建模过程中,决定建模成功的主要还有以下几个环节:①穿刺进针角度及深度。在本实验中,大鼠采用俯卧位,为避免穿刺针扎伤脑干,注射器应保持与背部15°~30°,针尖顶住枕骨,将针头沿枕骨下滑到环枕联合处,然后穿刺环枕膜,有透空感后,进针深度保持在5 mm以内,注射血液时顺畅,无明显阻力,如果阻力较大,而且大鼠突然出现呼吸心率改变,可能损伤了脑干,如单纯阻力大,考虑血栓堵塞可能,应予以更换,或者清除血栓。②注血的量和速度。注血的量目前无统一标准,Takata第一次注射采用0.5 mL,第二次注射0.3 mL[5],吴氏报道采用 0.2mL[9],Germano采用0.4 mL[10]。注血的量与发生脑血管痉挛的有明显的相关性,但注血量多容易造成大鼠死亡导致造模失败。在本组实验中后期,我们采取1 mL/kg的注血量,明显比预实验降低了死亡率,而能达到同样效果。注血的速度至为关键,太快可引起大鼠立即死亡,太慢容易导致血栓形成以致堵管。建议以0.15 mL/min的速度(默数1~20后注射0.05 mL)。③防止血栓形成堵管。血栓形成既可以造成堵管,亦可浪费采集的血液,故采血及止血应尽快完成。在采完血后,由助手迅速用棉签压迫穿刺口止血,术者同时解开大鼠的绑缚,压迫2 min左右,穿刺口无渗血后,填塞明胶海绵一块。如为缩减时间,可在棉签压迫同时,以纱块制成棉垫覆盖在棉签上加压,迅速将大鼠改成俯卧位,然后再穿刺注血。即使如此,血栓形成仍难以避免,故在采血时,可适当比预定血量多采0.1~0.2 mL。堵管时,退出注射器及针头,检查血栓位置,并清除血栓,然后再进行穿刺,如反复堵管,可反复清除,必要时更换针头。切不可堵管时盲目加压注射,造成注射器的不可控制而刺伤脑干。
由于蛛网膜下腔出血的高致死率和致残率同样在实验动物身上也会出现,故从动物实验伦理而言,术者应尽可能的降低手术创伤,提高建模的成功率。
[1] 贾莉,孙保亮,张磊.蛛网膜下腔出血性脑血管痉挛动物模型的制作[J].中国组织工程研究与与临床康复,2009,13(41):8147-8150.
[2]Jeon H,Ai J,Sabri M,et al.Neurological and neurobehavioral assessment of experimental subarachnoid hemorrhage[J]. BMC Neurosci,2009,10(8):103.
[3]Sugawara T,Ayer R,Jadhav V,et al.A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model[J].J NeurosciMethods2008,167(2):327-334.
[4]Gao C,Liu X,Liu W,et al.Anti-apoptotic and neuroprotective effects of tetramethylpyrazine following subarachnoid hemorrhage in rats[J].Auton Neurosci,2008,141(1-2):22-30.
[5]Takata K,Sheng H,Borel CO,et al.Long-term cognitive dysfunction following experimental subarachnoid hemorrhage:new perspectives[J].Exp Neurol,2008,213(2):336-344.
[6] 孟雷,姜勇,李哲,等.大鼠SAH后的蛛网膜颗粒细胞凋亡及血清TNF-α表达[J].中国神经精神疾病杂志,2006,32(3):258-260.
[7] 高成,陈会荣,刘相轸.三种方法制作大鼠蛛网膜下腔出血模型[J].中国微侵袭神经外科杂志,2008,13(9):409-411.
[8]Pereira Filho Nde A,Pereira Filho Ade A,Soares FP,et al. Effect of N-acetylcysteine on vasospasm in subarachnoid hemorrhage[J].Arq Neuropsiquiatr,2010,68(6):918-922.
[9] 吴远水,洪涛,叶新运.一种简易大鼠蛛网膜下腔出血后迟发性脑血管痉挛模型的建立[J].江西医学院学报,2009,49(6):1-3.
[10]Germano A,Imperatore C,d′Avella D,et al.Antivasospastic and brain-protective effects of a hydroxyl radical scavenger(AVS)after experimental subarachnoid hemorrhage[J].J Neurosurg,1998,88(6):1075-1081.
R651
A
2011-08-28)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2012.03.012
☆ 广州中医药大学博士后科学研究资助项目 (编号:BBK429112K06);广东省财政厅专项经费(编号:粤财社2010-5)
* 广东省中医院脑病三科(广州 510120)
