银合欢种子多糖提取工艺优化
2012-04-13郭守军杨永利李浩龙叶文斌黄锦霞
郭守军,杨永利,李浩龙,叶文斌,黄锦霞
(1.韩山师范学院 生物系,广东 潮州 521041;2.陇南师范高等专科学校,甘肃 成县 742500)
银合欢[Leucaena leucocephala(Lam.)de Wit]是豆科含羞草亚科银合欢属多年生灌木,主要特性是抗逆、速生、高产、优质及其适应性强[1]。原产热带美洲,现广布于热带地区,中国台湾、福建、广东、海南、香港、广西、湖南、贵州、四川(西南部)和云南等地有栽培。银合欢种子多糖主要成分是半乳甘露聚糖,是植物的储备性多糖,主要存在于豆科植物种子的胚乳中,具有较强的吸水和保水能力,可作为增稠剂、凝胶剂、稳定剂和凝聚剂等广泛应用于食品、医药等许多工业领域[2-4]。近年来的研究表明,半乳甘露聚糖胶具有抗凝、纤维蛋白溶解、免疫调节、抗溃疡、抗病毒、降血糖、降胆固醇和减肥等作用[5-6]。所以半乳甘露聚糖型植物多糖的研究近年来倍受众多国外学者与制药厂商的关注。银合欢种子多糖的流变性研究表明,银合欢种子多糖具有良好的耐盐稳定性,在酸和碱性条件下也具有良好的稳定性,故银合欢种子多糖可添加在酱油、醋等高盐食品和酸性碱性食品中[7]。
本研究通过单因素和L9(33)正交试验对热水浸提法提取银合欢种子多糖的提取工艺进行优化,为银合欢种子多糖的进一步开发研究和利用提供科学依据。
1 材料和方法
1.1.1 主要材料和试剂
银合欢种子购于云南省林木种苗站,葡萄糖(纯度>99.99%)购于Sigma公司;苯酚、浓硫酸、95%vol乙醇均为分析纯。
1.1.2 主要仪器
SL320N电子天平(上海民桥精密科学仪器有限公司生产),TDL-5000B型低速冷冻大容量离心机(上海安亭科学仪器厂),RE-52D旋转蒸发器(上海青浦沪西仪器厂),HJ-6A六联恒温磁力搅拌器(金坛市宏华仪器厂),LGJ-18型冷冻干燥机(北京四环科学仪器厂),9101微型高速样品粉碎机(北京检测仪器有限公司);UV-2800型紫外可见光分光光度计(尤尼卡上海仪器有限公司)等。
1.2 实验方法
1.2.1 银合欢种子多糖的提取流程
银合欢种子在50℃烘干后将其粉碎,称取10g用无水乙醇回流脱脂,再在50℃时干燥,然后加入一定量的水,在一定温度条件下进行一定时间的提取,提取液经过减压浓缩得浓缩液,加乙醇醇析得粗多糖沉淀,抽滤,沉淀分别用甲醇、丙酮依次洗涤,冷冻干燥后得多糖产品。
1.2.2 银合欢种子多糖含量的测定方法
本实验采用苯酚—硫酸法测定总的多糖含量[8]。
1.2.3 单因素试验
料液比采用1:10、1:15、1:20、1:25、1:30、1:35、1:40 7个水平,浸提温度采用40℃、50℃、60℃、70℃、80℃、90℃6个水平,浸提时间采用1h、2h、3h、4h、5h、6h,乙醇浓度为70%vol、75%vol、80%vol、85%vol、90%vol、95%vol 6个水平分别进行单因素试验。
1.2.4 正交试验
在上述单因素试验的基础上,选定3因素3水平L9(33)作正交试验,确定提取银合欢种子中可溶性多糖的最佳提取工艺参数,用苯酚—硫酸法测定多糖含量,统计实验结果。
1.2.5 核酸、蛋白质的检测[8-9]
多糖水溶液在波长200nm~400nm处扫描,在260nm及280nm处检测有无吸收峰,茚三酮法颜色检测。
1.2.6 统计分析
试验结果用SPSS17.0统计软件进行统计分析,进行方差分析和SSR显著性检验。
2 结果与讨论
2.1 多糖含量的测定[10-11]
在试验条件下,以标准液浓度(mg/mL)为横坐标,为吸光度值为纵坐标,得标准曲线,见图1,计算回归方程:y=5.1086x+0.0061,相关系数R2=0.9999。多糖提取率=V×C×f×W2/(W3×W1)×100%。W1:称取干银合欢种子粉末的质量(g);W2:由W1提取的粗多糖的质量(g);W3:从W2中称取的用于分析测定的粗多糖质量(g);V:溶解W3定容后的体积(L);f:多糖的校正系数[16],f≈0.9;C:由回归方程计算所得多糖的浓度(g/L)。
2.2 影响银合欢种子多糖提取率的单因素试验
2.2.1 料液比对银合欢种子多糖提取率的影响
料液比影响着物料的溶解度,当料液比偏低时,物料得不到充分的浸泡,多糖在提取溶剂中容易饱和,导致提取不充分;料液比偏高时,虽然提取可能较为充分,但是过高料液比的会造成浓缩时能耗的增加和醇沉时乙醇的大量浪费。料液比单因素试验见图2,随着料液比的升高银合欢种子多糖的溶出量呈逐渐升高的趋势,多糖的得率也在增加,在料液比为1:35时,多糖的提取得率达到最大,为8.635%。
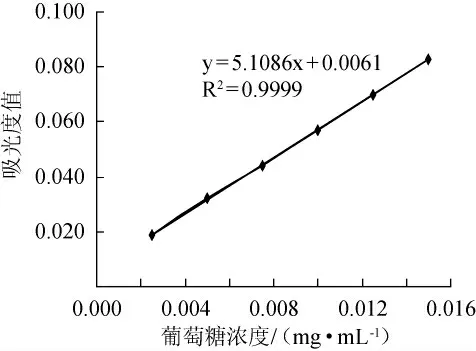
图1 葡萄糖标准曲线图
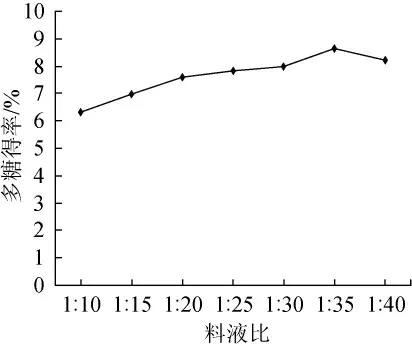
图2 料液比对银合欢种子多糖提取率的影响Fig.2 Effect of solid-liquid ratio on extraction yield of polysaccharide
2.2.2 温度对银合欢种子多糖提取率的影响
话音未落,将军右掌一拍几案,身形暴起。几案上的棋子受那一掌之力,立即飞起,未及落地,将军右手五指连弹,把飞起的棋子尽数弹出。
固定提取料液比为1:35、时间为1h、95%vol乙醇进行醇沉(3倍于提取液总体积),考察不同温度对多糖提取率的影响,见图3,随着提取温度的升高,多糖得率逐渐升高,升高至60℃时,多糖得率达到最大,之后逐渐下降。
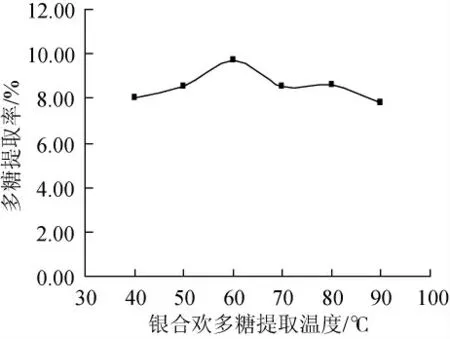
图3 温度对银合欢种子多糖提取率的影响Fig.3 Effect of temperature on extraction yield of polysaccharide
2.2.3 时间对银合欢种子多糖提取率的影响
处理时间对多糖的提取率的影响见图4,在相同的最佳料液比和最佳温度条件下,随着热浸提时间的增加,银合欢种子中多糖提取率也在逐渐增加,浸提4.0h时多糖得率最高,之后稍有下降。
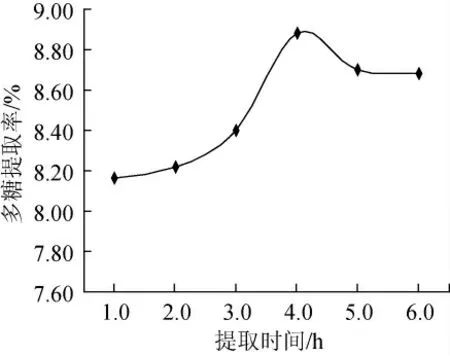
图4 时间对银合欢种子多糖提取率的影响Fig.4 Effect of time on extraction yield of polysaccharide
2.2.4 乙醇浓度对银合欢种子多糖提取率的影响
乙醇(3倍于提取液体积)浓度对多糖的提取率的影响见图5,随着醇沉浓度的增加,银合欢种子多糖提取率缓慢增加,但在95%vol的醇沉浓度下多糖提取率为最高,所以选取95%vol的乙醇为最优醇沉浓度。
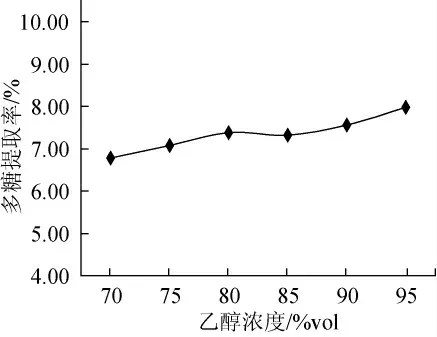
图5 乙醇浓度对银合欢种子多糖提取率的影响Fig.5 Effect of alcohol concentration on extraction yield of polysaccharide
2.3 银合欢种子多糖提取率的正交试验
2.3.1 正交试验设计和结果的直观分析
在上述单因素试验的基础上,选定3因素3水平作正交试验,因素水平、试验结果计算及分析见表1。
从表1可知,根据正交试验结果,比较各因素的极差结果R值,可以得知RC>RA>RB,说明提取时间是影响多糖提取率的最关键因素,其次是料液比,再次是提取温度,主次顺序为C>A>B。得出最优组合工艺为A2B2C3,即热水浸提料液比为1:35,温度为60℃,时间为5.0h,醇沉浓度为95%vol,多糖平均得率为12.155%。
2.3.2 正交试验的方差分析
正交试验的方差分析结果(表2)显示,时间因素对银合欢种子多糖提取率影响差异极显著,对银合欢种子多糖提取率的影响起最主要作用,温度和料液比在此试验范围内对银合欢种子多糖提取率影响差异显著,对银合欢种子多糖提取率的影响起次要作用,温度对测定结果的影响较小。这与直观分析结果是相一致的。
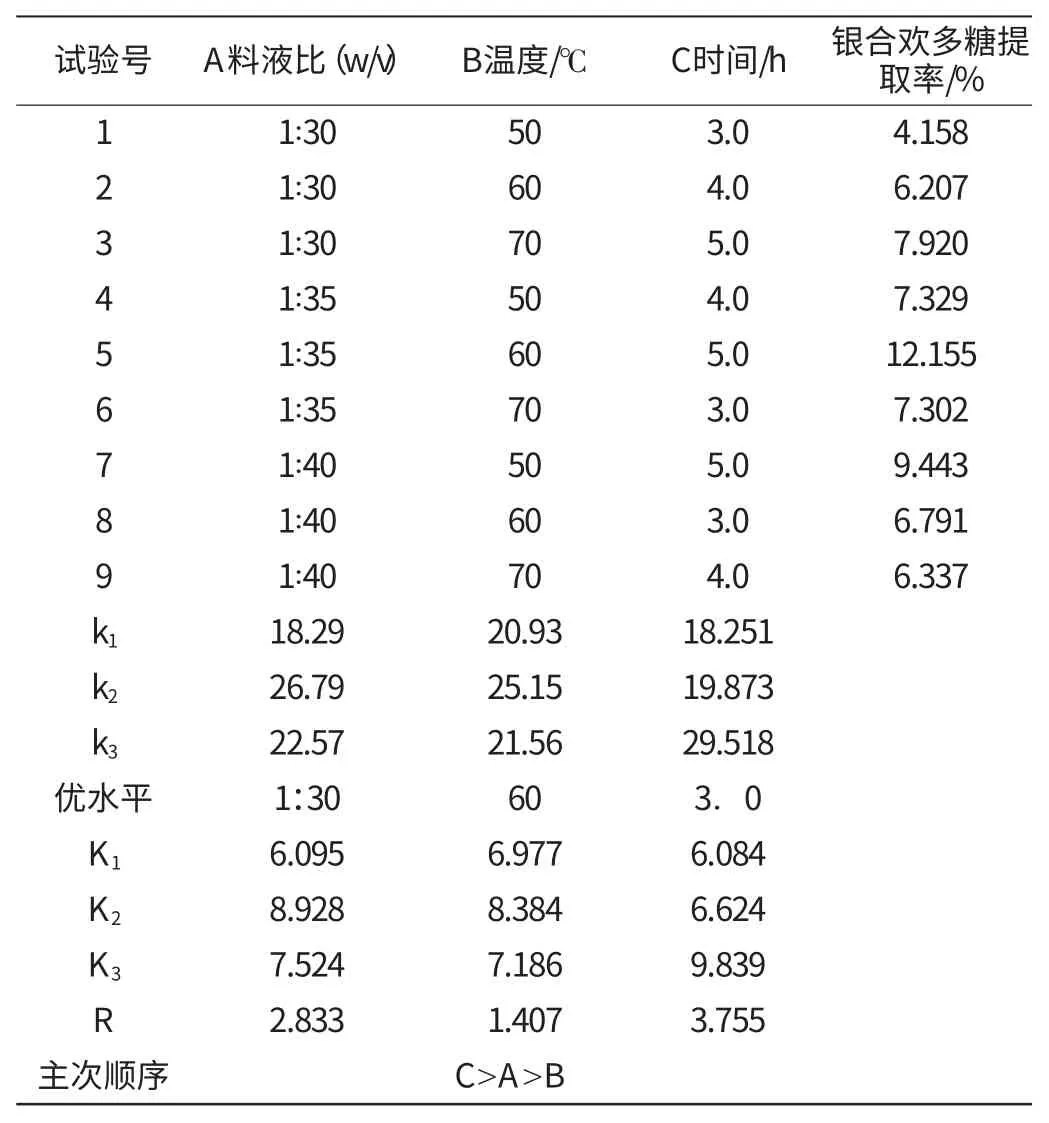
表1 银合欢种子多糖提取正交试验结果与分析Table 1 Result and analysis of orthogonal test for polysaccharide extraction
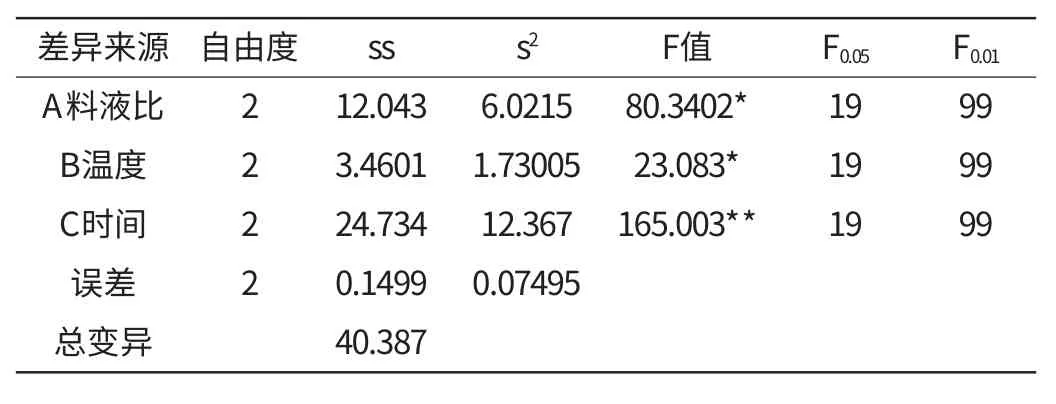
表2 正交试验结果的方差分析Table 2 ANOVA of orthogonal test result for polysaccharide extraction
2.3.3 正交试验多重性比较
表3的SSR检验显示,3个水平间都没有显著差异,故选平均值最大的,即料液比的最佳工艺参数是1:35。
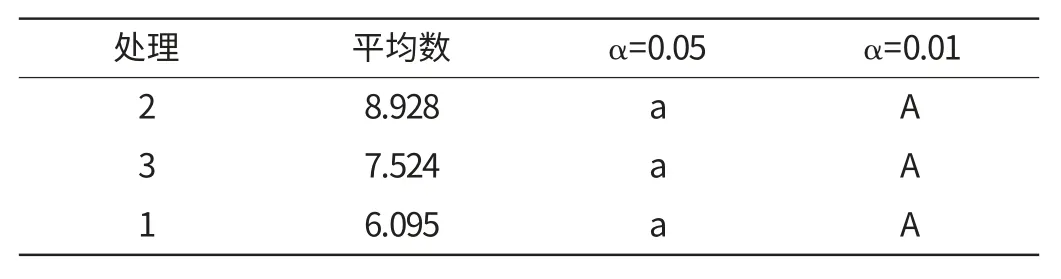
表3 提取料液比各水平间差异显著性SSR 检验Table 3 SSR differences significance of extract liquid ratio with various levels
表4的SSR检验显示,控制提取温度非常重要,3个水平都没有显著差异,故选平均值最大的,即温度的最佳工艺参数是60℃。

表4 提取温度各水平间差异显著性SSR 检验Table 4 SSR differences significance of temperature with various levels
表5的SSR检验显示,控制提取时间非常重要,3与1水平间有显著差异,故时间最佳工艺参数为5h。

表5 时间各水平间差异显著性SSR 检验Table 5 SSR differences significance of time with various levels
表6的SSR检验显示,控制乙醇浓度非常重要,3和2与1相比均有极显著差异,故应选择乙醇最佳工艺的浓度为95%vol。
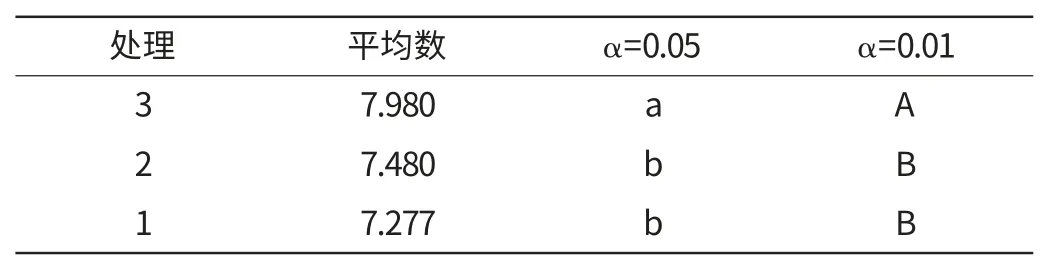
表6 乙醇各水平间差异显著性SSR 检验Table 6 SSR differences significance of ethanol with various levels
2.4 有关提取流程的其他讨论
因为是最佳优化工艺,所以样品粉碎后不易过筛,在试验过程中发现,经过筛后的残渣中大部分为种皮,而种皮内表面附着胚乳,胚乳中含有大部分的多糖,所以在这样条件下就能溶出胚乳中更多的多糖而不会浪费材料,如此可提高粗多糖的提取率,所以样品粉碎后不必过筛。再则多糖的醇析采用3倍量的95%vol乙醇,4℃静置1h,沉淀比较完全。试验结束后采用菲林试剂进行脱色,冷冻干燥后得到的多糖为白色粉末,质量高于不除杂脱色工艺提取的多糖。
3 结论
3.1 银合欢种子可溶性多糖不含蛋白、核酸。由于半乳甘露聚糖遇水溶胀,能产生很高的黏度,所以在多糖分散在水中之前,需要充分的溶胀。实际生产操作中,可以预先对种子在常温下用水进行浸泡,让胚乳中多糖充分溶胀后再进行加温提取,可大大缩短提取时间,降低能耗。
3.2 在应用中应注意,银合欢种子胶在冷水中的溶解度较低,约为50%,随着温度的升高,溶解度逐渐增加,并且加热时间对其黏度影响较小,故可应用于高温加热和较长时间加热的食品中。银合欢种子胶溶液pH值为6.15,pH 3~11的范围内。其黏度变化较小,可应用于陈醋等酸性食品及碱性食品加工中。盐离子(Na+)浓度(5%和11%的NaCl溶液)对银合欢种子胶溶液黏度的影响较小。加入食盐后,胶溶液体系稍有波动,48h后溶液的黏度保持稳定。因此,银合欢种子胶可以添加在番茄酱、甜面酱、午餐肉、蚝油和酱油等高盐食品中[7]。
我国食用胶的年需求量为30000t~40000t,目前,我国自产食用胶量约为10000t左右,食用胶的缺口很大,只能靠进口,因此,研发新型食用胶是当务之急。银合欢种子含有较多的水溶性多糖——半乳甘露聚糖,具有较好的增稠、稳定、凝胶作用。而银合欢又为多年生灌木,分布广泛,其种子资源较为丰富,为半乳甘露聚糖胶生产的良好原料之一[10-12]。
[1]刘利平,蔡义民,王之盛,等.四川省不同产地银合欢的营养价值评价[J].饲料博览.技术版,2009,21(1):13-15.
[2]VENDRUSCOLO CW,ANDREAZZA IF,GANTERJLMS,et al.Xanthan and galactomannan(fromM.scabrella)matrix tablets for oral controlled deliveryof theophylline[J].Int J Pharm,2005,296:1-11.
[3]MAISHRA A,YADAV A,AGARWAL M,et al.Fenugreek mucilagefor solid removal from tannery effluent[J].React Func Polym,2004,59:99-104.
[4]CAMACH M M,MARTINEZ-NAVARRETEN,CHIRALT A.Rheological characterization of experimental dairy creams formulated with locust bean gum(LBG)andλ-carrageenan combinations[J].Int Dairy J,2005,15:243-248.
[5]GUILHERMINA RN,CARMEN L P,ANA L R,et al.Two galactomannan preparations from seeds fromMimosa scabrella(bracatinga):Complexation with oxovanadium(IV/V)and cytotoxicity on HeLa cells[J].J Inorg Biochem,2009,103:749-757.
[6]BIN-HAFEEZ B,HAQUE R,PARVEZ S,et al.Inmunomodulatory effect of fenugreek extract in mice.International[J].Immunopharmacology,2003(3):257-263.
[7]郭守军,杨永利,黄云珠,等.银合欢种子胶的主要性能指标及流变性研究[J].食品科技,2009,34(5):254-259.
[8]游庆红尹秀莲.响应面法优化桑黄多糖提取工艺研究[J].中国酿造,2010(5):67-69.
[9]郭守军,杨永利,姚慕贞,等.蜈蚣藻多糖提取工艺优化[J].食品科技,2010 35(6):227-230.
[10]张广伦,张卫明.胡芦巴及其综合利用[J].中国林副特产,2011(4):96-98.
[11]叶 林,蒲云峰,黄 强.苦豆子胶热水提取工艺研究[J].塔里木大学学报,2011,23(1):25-28.
[12]赵 英,陈小斌,蒋昌顺.我国银合欢研究进展[J].热带农业科学,2006,26(4):55-63.
