羊草DREB转录因子的系统发育和功能研究
2012-04-12马兴勇彭献军苏蔓张乐新周庆源陈双燕程丽琴刘公社
马兴勇,彭献军,苏蔓,张乐新,周庆源,陈双燕,程丽琴*,刘公社*
(1.中国科学院植物研究所资源植物研发重点实验室,北京100093;2.中国科学院研究生院,北京100049)
*干旱、高盐和低温等非生物胁迫影响植物的生长发育,植物中相应发生一系列分子水平的变化来适应胁迫[1]。转录因子调控逆境相关基因在特异时空内表达,是植物响应逆境的一个重要组成部分[2]。DREB(dehydration responsive element binding proteins)是植物中已知的与非生物胁迫相关的最重要的转录因子基因之一[1]。DREB转录因子分为DREB1和DREB2两类,分别在植物响应低温胁迫和渗透胁迫的过程中起作用[3]。DREB转录因子通过与启动子上的DRE/CRT元件结合,激活下游一系列与非生物胁迫相关基因的表达[1]。基因芯片分析表明,两类DREB转录因子的下游基因有重叠的部分但并不完全相同[4]。DREB2类转录因子除了响应渗透胁迫外,也响应高温胁迫。另外,有些DREB转录因子基因的表达受放牧[5]或创伤的诱导[6]。拟南芥(Arabidopsisthaliana)[3]、水稻(Oryzasativa)[7]和玉米(Zeamays)[8]等植物中克隆到的 DREB转录因子,已被证明可以用来提高植物的抗逆能力。许多研究者已经将该类基因转化到各种草坪草及牧草之中,并成功获得了综合抗性增强的转基因植株[9]。
羊草(Leymuschinensis)隶属禾本科(Gramineae)赖草属,在我国东北和内蒙古有广泛分布[10]。羊草兼具重要的经济价值和生态价值,是一种非常重要的乡土草。羊草具有发达的根茎,可以通过根茎进行无性繁殖[11]。羊草具有耐寒和耐盐碱的特点,对NaCl、Na2CO3处理的最高耐受浓度可分别达到600和175 mmol/L[12]。虽然羊草具有很好的抗逆能力,但是关于其抗逆分子机理的研究较少。目前,羊草中仅有几丁质酶ClassⅡ、乙醛脱氢酶、光系统Ⅱ外周蛋白和V-ATPase等少数基因被克隆[13-17]。作者所在的实验室也成功地克隆并鉴定了羊草中的1个DREB转录因子基因[5]。目前羊草的基因组信息相对较少,这限制了羊草抗逆分子机理的研究和相关基因的克隆。通过构建c DNA文库并对部分cDNA克隆测序来获得ESTs,是获得基因组信息的有效方法[18]。Jin等[19]构建了碱性环境胁迫下羊草叶和根的cDNA文库,并测序得到了1 228条ESTs。王丽娟等[20]通过构建羊草叶片c DNA文库并测序得到了285条ESTs。然而,通过这种方法获得的ESTs数量仍然是有限的。目前,GenBank的核酸数据库(nucleotide database)中仅有羊草序列72条,EST数据库(dbEST)中仅有羊草序列1 692条,2个数据库共有2条DREB序列。DREB转录因子属于ERF家族中的DREB亚家族,在拟南芥基因组中该亚家族有57个成员。据此,羊草DREB亚家族基因序列尚有潜力可挖。作者所在实验室对羊草转录组进行了高通量测序,获得了大量EST。本研究通过构建系统发育树,对EST数据中的DREB转录因子基因进行系统挖掘,并选择其中的Lc DREB21基因进行功能验证。
1 材料与方法
1.1 材料
羊草和拟南芥,2010年种植于中国科学院植物研究所培养室,恒温23℃,16 h光照,8 h黑暗。
1.2 方法
1.2.1 高通量测序 羊草种植在塑料钵中,8周大的幼苗(4叶期)用于实验。幼苗经低温和干旱处理,取样,混合后提取RNA。经反转录,建库,使用454 GS FLX进行测序(测序工作由中国科学院国家基因研究中心完成)。测序数据通过GoPipe进行GO(gene ontology)分析,通过NCBI的blast进行核酸和蛋白的同源性分析,通过与CDD数据库比对进行KOG(clusters of eukaryotic orthologous groups)分析。
1.2.2 RACE 羊草幼苗经400 mmol/L NaCl处理,提取总RNA,经反转录的cDNA第一链为模板。采用Clontech公司的RACE试剂盒。Lc DREB21基因引物和UPM引物序列分别为:5′-TGAAGTTATCCCTATTGCTCCGCATGAC-3′;5′-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3′。
1.2.3 荧光定量PCR 对于盐胁迫,将羊草幼苗根部浸入400 mmol/L NaCl溶液,干旱胁迫用20%PEG6000模拟,ABA处理使用浓度为100μmol/L,低温处理将羊草苗放进4℃冰箱。4种处理后,分别在0,1,3,8,12和24 h时取材,提取RNA。经DNase I消化的RNA反转录成cDNA,使用两步法进行荧光定量PCR。基因特异引物:5′-TAAACCCGTCATCGCCATCT-3′,5′-CCTGGAAGTATCCCAACCAAA-3′;内参(actin)引物:5′-CTGTTCTTGGCAGTCTCCAGCTC-3′,5′-GTGCTTTCCCTCTATGCAAGTGGT-3′。
1.2.4 酵母单杂交Lc DREB21基因经Sal I和Pst I酶切后,连接到酵母表达载体p Bridge的Sal I和Pst I酶切位点间,得到重组载体pBridge-BD-Lc DREB21。重组载体pBridge-BD-Lc DREB21转化含有His3和LacZ报道基因的酵母AH109株系。用pBridge空载体转化酵母AH109株系作为负对照,用转有BD-Lc DREB3a的AH109株系作为阳性对照。转化方法参照Clontech试剂盒的酵母转化方法。将上述3个转化酵母菌株在不含His和Trp的SD培养基上进行划线培养。培养3 d的酵母用于含有X-gal的Z-buffer显色。
1.2.5 拟南芥转化及筛选 利用pCAMBIA1302的NcoI和SpeI位点,构建了pCAMBIA1302-35S::LcDREB21-GFP。将构建的载体转化农杆菌EHA105,用花序侵染法转化拟南芥[21]。使用含25 mg/L潮霉素的MS培养基,筛选得到35S::Lc DREB21-GFP阳性拟南芥株系。
1.2.6 荧光观察 取在筛选培养基上生长4 d的35S::Lc DREB21-GFP T1代阳性植株,压片,使用ZEISS LSM 510 META激光共聚焦显微镜观察。
1.2.7 系统发育树构建 通过blast分析,筛选羊草转录组测序数据中的ERF家族基因,结合拟南芥ERF家族基因的蛋白序列构建了邻接树(neighbor-joining tree)。参考已有的研究,鉴定了羊草DREB转录因子基因所在的分支。利用羊草和拟南芥中DREB转录因子蛋白序列再次构建邻接树。序列比对使用MUSCLE[22],比对后的序列用Bio Edit进行编辑[23]。使用MEGA5构建邻接树,设置bootstrap重复次数为1 000[24]。
2 结果与分析
2.1 羊草DREB转录因子的系统发育研究
通过Roche 454测序技术,作者所在实验室对羊草转录组进行了测序。经过对测序数据分析,得到属于羊草DREB转录因子亚家族的EST 26条。采用邻接法,利用羊草EST和拟南芥基因组中的DREB亚家族基因的蛋白序列,构建了系统发育树。参照已有的研究,将羊草DREB亚家族EST分为4个类群[25](图1)。羊草DREB转录因子在4个类群有较均匀地分布,这说明DREB转录因子亚家族在羊草和拟南芥基因组中是保守的。同时也表明,本测序数据覆盖度好,拼接准确。在构建的系统发育树中,DREB1/CBF类转录因子位于第3类群,DREB2类转录因子位于第4类群。DREB1/CBF类转录因子和DREB2类转录因子分别在植物耐低温和耐渗透胁迫中起作用。目前,对位于第1类群基因功能的研究较少,第2类群基因的功能还不清楚。
在拟南芥中,DREB2A(At5g05410)基因受干旱和高盐胁迫诱导,过表达后可以提高拟南芥耐干旱和高盐胁迫的能力[26]。在构建的系统发育树中,与At5g50410同源性最高的是Lc DREB21,它们都位于第4类群。通过RACE得到了Lc DREB21的编码区全长,并对其功能进行了深入研究。

图1 羊草和拟南芥DREB转录因子系统发育树Fig.1 Phylogenetic tree of DREB transcription factors in L.chinensis ESTs and A.thaliana genome
2.2 Lc DREB21编码区全长的获得
通过转录组测序,得到的Lc DREB21 EST长度为486 bp。通过NCBI中的blast分析,其与大麦(Hordeum vulgare)和小麦(Triticumaestivum)的DREB基因具有很高同源性,可能包括CDS 3′末端。根据Lc DREB21 3′端序列,设计了5′引物进行RACE,得到了900 bp左右的特异性扩增片段(图2)。PCR产物回收并测序,得到的5′序列与原序列拼接得到总长为949 bp的序列。用DNAMAN软件对得到的序列进行ORF预测,并与大麦同源基因比较,结果表明其具有完整的CDS(GenBank登入号为:JN860437)。LcDREB21编码1个由278个氨基酸残基组成的蛋白。利用NCBI的CDD数据库工具对其进行保守结构域预测,结果显示其第76~139位氨基酸残基构成一个典型的AP2保守结构域。
2.3 Lc DREB21在胁迫条件下的表达模式
对羊草幼苗分别进行PEG、ABA、NaCl和低温处理,在0,1,3,8,12和24 h等6个时间点分别取材,用于荧光定量PCR分析(图3)。结果表明,Lc DREB21表达受PEG、ABA和NaCl的诱导,3种处理下,mRNA的积累量分别在24,12和3 h达到高峰。另外,Lc DREB21的表达基本不受低温诱导。
2.4 Lc DREB21的转录激活功能
一个转录因子起作用需要结合特定的启动子,并激活或抑制下游基因的表达。使用酵母单杂交系统,证明了Lc DREB21具有激活功能。首先,将Lc DREB21克隆到pBridge载体上,并转化酵母AH109。得到的阳性酵母菌株能够在不含His和Trp的SD培养基上生长。而且,阳性菌株在划线培养后,经含有X-gal的Z-buffer显色后变蓝。转BD-Lc DREB3aAH109株系作为阳性对照得到了类似结果[5]。而转有p Bridge空载体的AH109作为阴性对照,不能在缺少His和Trp的SD培养基上生长。以上结果说明,Lc DREB21具有转录激活能力(图4)。然而与对照相比,Lc DREB21的激活能力明显较弱。
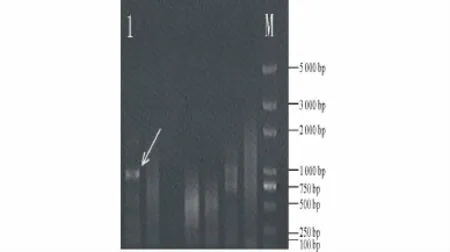
图2 LcDREB21的5′RACE扩增结果Fig.2 Amplified results of LcDREB21 by 5′RACE.

图3 胁迫和ABA处理下LcDREB21的表达模式Fig.3 Expression patterns of LcDREB21 in response to various treatments
2.5 Lc DREB21的亚细胞定位
通过潮霉素筛选,得到了T1代转35S::Lc DREB21-GFP和35S::GFP的拟南芥阳性苗。转基因拟南芥苗经压片后,在激光共聚焦显微镜下观察。在转35S::GFP的拟南芥中,绿色荧光在细胞质和细胞核中均有分布。在转35S::Lc DREB21-GFP的拟南芥中,绿色荧光只分布在细胞核中。以上结果表明,Lc DREB21专一性定位在细胞核中(图5)。
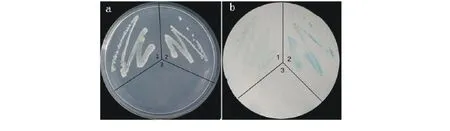
图4 酵母单杂交Fig.4 One hybrid system of yeast
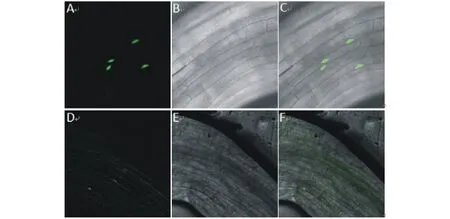
图5 LcDREB21亚细胞定位Fig.5 Subcellular location of LcDREB21
3 讨论
对拟南芥和水稻基因组中DREB的系统发育研究表明,DREB转录因子亚家族的多数类群在2种植物中同时存在,在进化上是保守的[25]。所以新测序物种DREB转录因子的分析,可以参照拟南芥和水稻中的研究,如在小麦[27]和玉米[28]研究中的应用。本研究共得到26条DREB转录因子EST,参照拟南芥中DREB转录因子的系统发育研究,将羊草DREB亚家族EST分为4个类群[25]。其中位于第一和第二类群的共有11条,在拟南芥和水稻中,对DREB亚家族这2个类群中基因的研究较少,它们的功能还不清楚[25]。DREB1类转录因子和DREB2类转录因子分别位于第3和第4类群,Lc DREB21位于第四类群,属于DREB2类转录因子。多数DREB2类转录因子的表达受干旱和高盐胁迫诱导,如AtDREB2A、AtDREB2B和OsDREB2A等[3,7,29]。然而,OsDREB2B和ZmDREB2A的表达响应干旱和高盐胁迫诱导的同时,也受低温胁迫的诱导[8,29]。与多数DREB转录因子类似,Lc DREB21的表达受干旱和高盐胁迫的诱导,基本不受冷诱导。另外,LcDREB21具有转录激活功能和核定位能力。因此,LcDREB21很可能在植物应对干旱和高盐胁迫的过程中起作用。
在拟南芥、水稻和玉米等植物中已克隆得到了多个DREB转录因子基因,然而牧草中的研究还比较少[9]。基因组信息的匮乏,限制了羊草DREB转录因子基因的克隆和功能研究。本研究发掘的26条DREB转录因子EST,丰富了羊草原来仅有2条DREB的核酸和EST数据库,为进一步研究DREB转录因子在植物耐低温和渗透胁迫过程中的作用奠定了基础。另外,有些DREB转录因子的表达受刈割或创伤的诱导,如Peng等[5]报道了Lc DREB3a的表达受刈割的诱导,Hong和Kim[6]报道了Ca DREBLP1的表达受创伤的诱导。对Lc DREB21在刈割下的表达进行了半定量PCR分析,发现其表达量没有明显变化(结果未列出)。因此,羊草DREB家族亚家族基因中有的与创伤或刈割有关,有的未必有关,这方面的研究有助于理解羊草耐牧的分子机理。
基因工程在最近20年取得了迅猛发展,具有在分子水平上定向改造遗传性状的优势,在牧草新品种培育研究中的应用也越来越广[30]。一些基因已被用于基因工程改良羊草,如 Wang等[31]通过组成型表达Ta LEA3基因,提高了羊草的耐旱能力。与单个功能基因相比,通过转化DREB转录因子基因,可以激活下游一系列抗逆相关基因的表达,从而能提高植物的综合抗性。因此,羊草DREB转录因子用于基因工程改良是非常好的选择。
[1] Yamaguchi-Shinozaki K,Shinozaki K.Transcriptinonal regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J].Annual Review of Plant Biology,2006,57(1):781-803.
[2] Rushton P J,Somssich I E.Transcriptional control of plant genes responsive to pathogens[J].Current Opinion in Plant Biology,1998,1(4):311-315.
[3] Liu Q,Kasuga M,Sakuma Y,etal.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,inArabidopsis[J].The Plant Cell,1998,10(8):1391-1406.
[4] Sakuma Y,Maruyama K,Osakabe Y,etal.Functional analysis of an arabidopsis transcription factor,DREB2A,involved in drought-responsive gene expression[J].The Plant Cell Online,2006,18(5):1292-1309.
[5] Peng X J,Ma X Y,Fan W H,etal.Improved drought and salt tolerance ofArabidopsisthalianaby transgenic expression of a novel DREB gene fromLeymuschinensis[J].Plant Cell Reports,2011,30(8):1-10.
[6] Hong J-P,Kim W T.Isolation and functional characterization of theCa-DREBLP1 gene encoding a dehydration-responsive element binding-factor-like protein 1 in hot pepper(CapsicumannuumL.cv.Pukang)[J].Planta,2005,220(6):875-888.
[7] Dubouzet J G,Sakuma Y,Ito Y,etal.OsDREBgenes in rice,OryzasativaL.,encode transcription activators that function in drought-,high-salt-and cold-responsive gene expression[J].The Plant Journal,2003,33(4):751-763.
[8] Qin F,Kakimoto M,Sakuma Y,etal.Regulation and functional analysis ofZm DREB2Ain response to drought and heat stresses inZeamaysL[J].The Plant Journal,2007,50(1):54-69.
[9] 王舟,刘建秀.DREB/CBF类转录因子研究进展及其在草坪草和牧草抗逆基因工程中的应用[J].草业学报,2011,20(1):222-236.
[10] 刘公社,齐冬梅.羊草生物学研究进展[J].草业学报,2004,13(5):6-11.
[11] 李海燕,李建东,徐振国,等.内蒙古图牧吉自然保护区羊草种群营养繁殖特性的比较[J].草业学报,2011,20(5):19-25.
[12] 颜宏,赵伟,尹尚军,等.羊草对不同盐碱胁迫的生理响应[J].草业学报,2006,15(6):49-55.
[13] 金华,安晓雯,姜国斌.羊草ClassⅡ几丁质酶基因的克隆及序列分析[J].农业科学与技术,2009,10(4):96-100.
[14] 金华,王璐,朴永哲,等.羊草OEE1基因的克隆及盐胁迫下的表达[J].西北植物学报,2011,31(5):881-885.
[15] 李蕊沁,冯树丹,于莹,等.羊草几丁质酶ClassⅡ基因的克隆、生物信息学分析及原核表达[J].中国农业科技导报,2010,12(2):103-110.
[16] 李新玲,吴姝菊,王全伟.羊草乙醛脱氢酶基因Lc ALDH的克隆与表达分析[J].草业学报,2011,20(4):187-193.
[17] 吕召志,冯树丹,于莹,等.羊草LVAP1基因的克隆及生物信息学分析[J].哈尔滨商业大学学报(自然科学版),2010,26(6):651-656.
[18] Adams M,Kelley J,Gocayne J,etal.Complementary DNA sequencing:expressed sequence tags and human genome project[J].Science,1991,252:1651-1656.
[19] Jin H,Plaha P,Park J Y,etal.Comparative EST profiles of leaf and root ofLeymuschinensis,a xerophilous grass adapted to high p H sodic soil[J].Plant Science,2006,170(6):1081-1086.
[20] 王丽娟,金治平,王能飞,等.羊草叶片cDNA文库的构建及部分表达序列标签的分析[J].草业学报,2009,18(1):65-71.
[21] Clough S J,Bent A F.Floral dip:a simplified method forAgrobacteriummediated transformation ofArabidopsisthaliana[J].The Plant Journal,1998,16(6):735-743.
[22] Edgar R C.MUSCLE:multiple sequence alignment with high accuracy and high throughput[J].Nucleic Acids Research,2004,32(5):1792-1797.
[23] Hall T A.BioEdit:a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[C].Nucleic Acids Symposium Series,1999,41:95-98.
[24] Tamura K,Peterson D,Peterson N,etal.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[25] Nakano T,Suzuki K,Fujimura T,etal.Genome-wide analysis of the ERF gene family inArabidopsisand rice[J].Plant Physiology,2006,140(2):411-432.
[26] Sakuma Y,Maruyama K,Osakabe Y,etal.Functional analysis of anArabidopsistranscription factor,DREB2A,involved in drought-responsive gene expression[J].The Plant Cell,2006,18(5):1292-1309.
[27] Zhuang J,Chen J M,Yao Q H,etal.Discovery and expression profile analysis of AP2/ERF family genes fromTriticum aestivum[J].Molecular Biology Reports,2011,38(2):745-753.
[28] Zhuang J,Deng D X,Yao Q H,etal.Discovery,phylogeny and expression patterns of AP2-like genes in maize[J].Plant Growth Regulation,2010,62(1):51-58.
[29] Matsukura S,Mizoi J,Yoshida T,etal.Comprehensive analysis of rice DREB2-type genes that encode transcription factors involved in the expression of abiotic stress-responsive genes[J].Molecular Genetics and Genomics,2010,283(2):185-196.
[30] 马江涛,王宗礼,黄东光,等.基因工程在牧草培育中的应用[J].草业学报,2010,19(6):248-262.
[31] Wang L,Li X,Chen S,etal.Enhanced drought tolerance in transgenicLeymuschinensisplants with constitutively expressed wheatTa LEA3[J].Biotechnology Letters,2009,31(2):313-319.
