岷山红三叶异黄酮对去卵巢大鼠生长和免疫及抗氧化指标的影响
2012-04-12俞联平郝正里李发弟孟祥君陈兴荣李新媛
俞联平,郝正里,李发弟,3*,孟祥君,陈兴荣,李新媛
(1.甘肃农业大学草业生态系统教育部重点实验室 甘肃农业大学动物科学技术学院,甘肃 兰州730070;2.甘肃省动物营养研究所,甘肃 兰州730010;3.甘肃省饲料工程技术研究中心,甘肃 兰州730070)
*岷山红三叶 (Trifoliumpratense)作为甘肃省具有地域特点的地方选育品种,不仅抗寒耐湿,产草量高、质优,且富含异黄酮(isoflavone,ISO),是集草药为一体的优良豆科牧草。经检测岷山红三叶牧草中异黄酮含量为1.0%~2.6%[1,2],为大豆籽实中异黄酮含量(0.1%~0.3%)[3]的近10倍,其异黄酮以鹰嘴豆芽素 A(biochanin A)和芒柄花素(formonetin)含量最高,占牧草干重的0.1%~0.9%,而大豆籽粒以染料木素(genistin)和大豆黄素(daidzin)为主,仅占籽粒干重的0.04%~0.19%[4],且豆科作物中异黄酮含量随环境因素如生态气候条件、季节和土壤条件等变化[5]。研究表明,异黄酮类物质具有与雌二醇(estradiol,E2)相似的结构,不仅有微弱的雌激素活性和抗雌激素作用,还具有抗氧化、降低胆固醇、抗肿瘤、改善心血管机能等一系列重要的生物学功能[6-8]。同时,其作为一种生理调节剂,能改变动物血液中催乳素(prolactin,PRL)、生长激素(growth hormone,GH)、睾酮(testosterone)等内源性激素的水平,家畜日粮中添加适量的异黄酮,可提高其生产性能、繁殖性能,增强机体免疫力等[9-14],但采食过量时,则会引起家畜,特别是反刍家畜的繁殖机能紊乱[15]。目前国内外对大豆异黄酮的研究比较深入,但对红三叶异黄酮提高畜禽机体免疫力、调节动物钙磷代谢以及促进其生长,改善其生产性能和繁殖性能等方面的作用及作用机理的研究还有待进一步深入和系统化,针对岷山红三叶异黄酮药理作用、对畜禽生产的有益作用及作用机理等方面的研究尚未见报道。
岷山红三叶异黄酮由于其来源的天然性,以及原始无污染的自然生产环境,作为畜禽饲料添加剂应用,不存在抗生素和化学药品所具有的畜产品残留和环境污染等安全隐患[16]。进行本试验是为探讨岷山红三叶异黄酮在促进动物生长,提高机体抗氧化能力和免疫机能等方面的作用,以便确定其作为无公害绿色饲料添加剂开发的价值,及提高畜禽抗疾病、抗应激能力,改善动物生产性能的潜力。
1 材料与方法
1.1 试验时间与地点
试验于2008年12月13日-2009年2月11日在甘肃省中医学院动物实验中心进行[动物实验设施合格证SYXK(甘)2004-0006]。
1.2 试验设计、动物与分组及试验期
采用单因素完全随机分组试验设计。选择80只50~60日龄、体重接近200 g、CL级(clean grade)的SD雌性大鼠[兰州中医学院动物试验中心提供,实验动物合格证号:SCXK(甘)2004-0006]作为试验动物,随机分为8组,每组10只;其中1~7组去卵巢(ovariectomized,OVX),分别施予不同剂量的红三叶异黄酮,第8组为假手术组(sham)(表1)。试验前5日实施去卵巢手术,12月18日空腹称重、开始试验,正试期60 d。

表1 试验处理方案Table 1 Trial grouping and treatment program
1.3 试验材料
试验用岷山红三叶异黄酮(以下简称红三叶异黄酮)由岷州集团岷海制药有限公司提取,总异黄酮含量10%,其中芒柄花素5.10%,鹰嘴豆芽素A 4.10%,大豆黄素0.05%,染料木素0.03%;经急性毒性试验,未见红三叶异黄酮有明显的急性毒性反应。
1.4 试验方法
1.4.1 大鼠去卵巢方法 用3%戊巴比妥钠腹腔注射麻醉大鼠(剂量按45 mg/kg BW计)后,沿腹中线切口(长约1 cm),切除两侧卵巢。
1.4.2 饲养方法 各组均饲以CL级大鼠专用颗粒饲料,日投料量按每100 g体重5 g计(5 g/100 g BW);将各组大鼠分别置一笼中饲喂(群饲),日饲喂2次,自由采食和饮水。
1.4.3 投喂红三叶异黄酮的途径与方法 用0.5%羧甲基纤维素钠配制成浓度为32,16,8,4,2,和1 g/100 m L的红三叶异黄酮悬液,分别给1~6组试验大鼠灌胃,每日1次,灌服量为1 m L/100 g BW;7和8组每日1次灌服生理盐水1 m L/100 g BW。
1.4.4 屠宰与取样 试验结束时,早晨空腹称大鼠个体体重;腹腔注射3%戊巴比妥钠麻醉大鼠,股动脉采血,其中1 m L加甘素抗凝,收集其余血液以3 000 r/min离心30 min,分离出血清置-20℃冰箱备用;分离子宫(双侧)、脾脏及胸腺,分别称其重。
1.4.5 测定指标及测定方法 1)脏器指数

2)T-淋巴细胞转化率采用形态学方法测定[17]。
3)血清抗氧化指标:总超氧化物歧化酶(T-SOD)采用黄嘌呤氧化酶法[18];丙二醛(MDA)采用TBA法[19];总胆固醇(CHO)采用酶比色法[20];高密度脂蛋白胆固醇(HDL)采用磷钨酸-Mg2+沉淀法[20];低密度脂蛋白胆固醇(LDL)采用聚乙烯硫酸盐(PVS)沉淀法[21]。
T-SOD和MDA测定利用南京建成生物工程研究所生产的试剂盒,CHO、HDL和LDL测定均采用中生北控生物科技股份有限公司生产的试剂盒,按说明书进行操作。
4)血清雌二醇(E2):采用美国Adlitteram Diagnostic Laboratories,Inc生产的大鼠雌二醇酶联免疫试剂盒,按说明书进行操作[22]。
1.5 统计分析
结果均以平均数±标准差示出。采用SPSS 13.0软件的One-way过程对多数指标的数据进行单因素方差分析,差异显著时用Duncan氏法进行多重比较;对大鼠的体重变化用GLM Univeriate过程进行协方差分析,差异显著时多重比较采用LSD法。
2 结果与分析
2.1 对大鼠体重的影响
采用协方差分析,对大鼠试验末平均体重及平均体增重进行校正(表2),结果显示,假手术组(8)试验末平均体重及平均体增重校正值均极显著低于其他各处理(P<0.01),去卵巢组(7)极显著高于处理8及添加红三叶异黄酮10~320 mg/(kg BW·d)的所有处理 (P<0.01),此范围内红三叶异黄酮添加量间无显著差异(P>0.05)。显然,去卵巢明显提高了试验末体重与体增重,而按试验方案添加不同剂量红三叶异黄酮均使去卵巢大鼠两指标提高的幅度减低,且剂量间无明显差异。似乎可看出,机体自身的雌激素能明显地控制体增重;添加红三叶异黄酮10 mg/(kg BW·d)使去卵巢大鼠的体增重下降,提高添加量并未使该指标产生变化,但红三叶异黄酮影响体增重的作用低于大鼠卵巢雌激素。
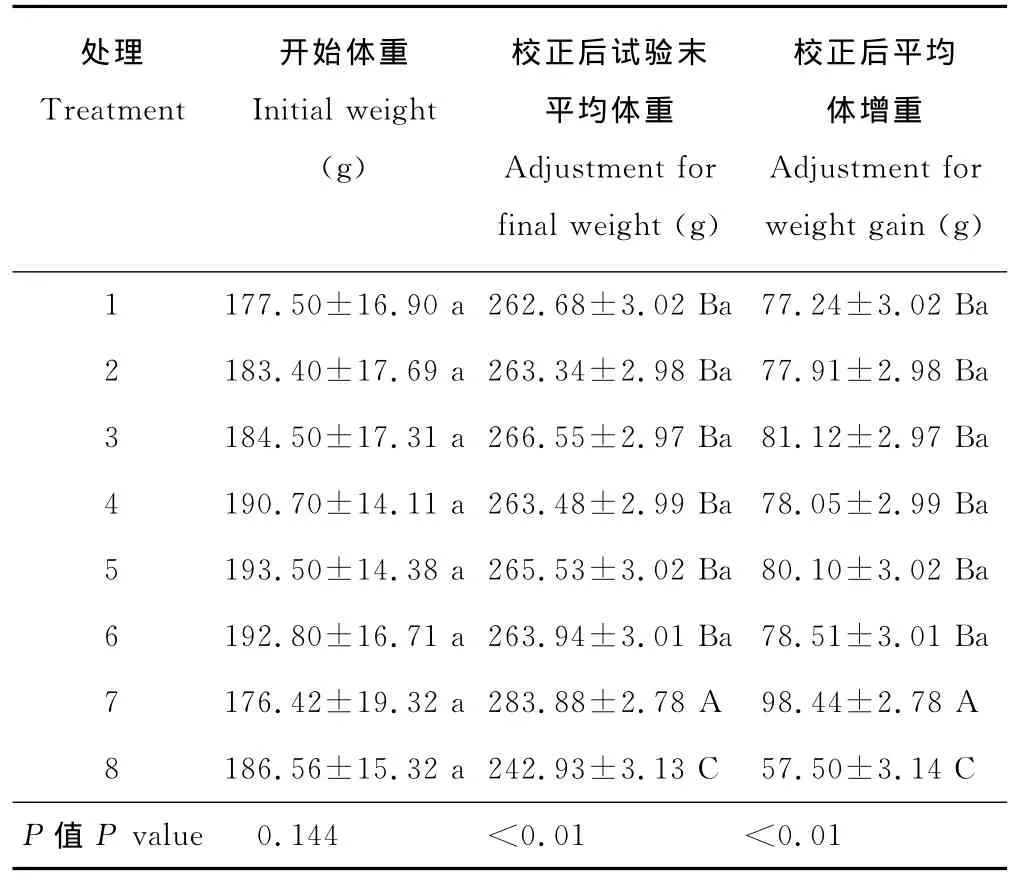
表2 各处理大鼠试验期平均体增重Table 2 Average weight gain of rats in the trial period for different treatment
2.2 对大鼠脏器指数及免疫功能的影响
处理8胸腺指数最低(表3),去卵巢处理(7)使该指标显著提高(P<0.05),给去卵巢大鼠添加10与80 mg/(kg BW·d)(P<0.01)和20,40 mg/(kg BW·d)(P<0.05)处理也显著高于处理8,但均与处理7间无显著差异(P>0.05);添加160与320 mg/(kg BW·d)(1,2)与处理8无显著提高(P>0.05),且较处理6显著降低(P<0.05),处理1显著低于处理3(P<0.05)。脾脏指数以假手术组最高,显著高于处理2和6(P<0.05),并有高于处理3,4和7的趋势(P=0.109 5,0.193 4和0.111 2),各添加组间及其与去卵巢组之间差异均不显著(P<0.05),说明红三叶异黄酮对脾脏指数的影响不明显。处理8子宫指数极显著高于其他各组(P<0.01),去卵巢与去卵巢添加不同量红三叶异黄酮组间差异均不显著(P>0.05);结果表明红三叶异黄酮无提高子宫指数的作用,与卵巢雌激素截然不同。
处理7 T淋巴细胞转化率显著低于假手术组(8),处理4(P<0.01)和1,2,3,5,6(P<0.05);各添加组之间及其与假手术组之间差异均不显著(P>0.05)。结果表明,大鼠自身的雌激素在维持机体免疫功能方面有重要作用,添加红三叶异黄酮10 mg/(kg BW·d)使T淋巴细胞转化率提高到假手术组的相近水平,而提高添加剂量并不能使该指标进一步提高。

表3 不同处理大鼠脏器指数及T淋巴细胞转化率Table 3 Change of internal organ indexes and T lymphocyte transformation rate of rats for different treatment
2.3 对血清抗氧化指标的影响
处理7血清CHO含量有高于处理8的趋势(P=0.088),表明去卵巢一定程度上使CHO提高;红三叶异黄酮有降低CHO的作用,且有剂量反应(处理6不太规律);与去卵巢组(7)相比,处理1(P<0.01),2和3的CHO较低 (P=0.058和0.094);处理5高于1(P<0.05)和2(P=0.085);处理4和6也呈高于1的趋势(P=0.065和0.063)。处理7血清 HDL含量显著高于8,1,2(P<0.01)及3(P<0.05);处理5 HDL含量高于处理1和2(P<0.01)及8和3(P=0.051和0.063);处理6和4均具有高于1和2的趋势(P=0.053,0.057)和(P=0.072,0.079),各添加组及去卵巢大鼠血清 HDL含量存在线性关系(y=-0.002 5x+1.781;R2=0.684,P=0.022)。血清LDL变化与HDL相似,去卵巢组(7)极显著高于8(P<0.01),去卵巢后添加红三叶异黄酮80(P<0.01)与160,320 mg/(kg BW·d)(P<0.05)才使LDL水平显著低于7。血清CHO、HDL和LDL含量均以添加中、高剂量添加组的处理1,2和3较低。从绝对值看,似乎去卵巢组和10 mg/(kg BW·d)组血清MDA含量较高,但统计分析表明各处理间该指标差异均不显著(P>0.05),是否该指标较大的个体差异掩盖了处理间差异,还有待进一步验证。去卵巢使血清SOD含量下降,添加红三叶异黄酮与去卵巢大鼠血清SOD含量存在曲线关系(y=-1.8E-5x3+0.008 5x2-0.792x+164.67;R2=0.810 5,P=0.013):在10~40 mg/(kg BW·d)范围内随添加量增加逐渐下降,处理4和5(P<0.05)显著低于8;但在80~320 mg/(kg BW·d)范围内又渐次上升,最大添加量组显著高于处理4和5(P<0.05),且达到了假手术组的相近水平,处理2也显示高于4的趋势(P=0.087)。

表4 不同处理血清抗氧化指标及E2含量变化Table 4 The serum antioxidation parameters and E2 level for different treatment
去卵巢组血清E2含量具有低于处理8的趋势(P=0.069)。从绝对值看各添加组血清E2含量介于二者之间,随红三叶异黄酮添加量的增加而上升,且存在线性关系(y=0.010 6x+12.704;R2=0.896 9,P=0.001),320 mg/(kg BW·d)组的测定值最接近假手术组,但无统计学意义(P>0.05),是否也与该指标个体测定值差异较大有关,有待进一步验证。
3 讨论
3.1 对大鼠体增重的影响
去卵巢能显著提高雌性大鼠体重和全期平均体增重,添加10 mg/(kg BW·d)的红三叶异黄酮即可使去卵巢大鼠两项指标增幅下降,而进一步提高添加量并未使这两项指标产生变化,未见明显的量效关系,且红三叶异黄酮影响体增重的作用仅达到大鼠卵巢雌激素的42.31%~51.78%。本试验结果与前人研究揭示的异黄酮抑制雌性动物生长的规律相符合。张勇等[23]研究表明,红三叶异黄酮对小鼠生长性能的影响与性别和剂量有关,对雌性小鼠的增重作用不显著,且随剂量增大有抑制作用,但可显著提高雄性小鼠的生长性能,但随剂量增大作用效果下降;任慧玲[24]的试验也取得了类似结果;郭晓红等[25,26]在肉仔鸡上的试验表明,大豆异黄酮的促生长作用对雄性动物较明显而对雌性动物不明显,试验组仔母鸡血清生长激素、胰岛素样生长因子(insulin-like growth factors,IGF-1)水平与对照组差异不明显,而仔公鸡血清GH、IGF-1及睾酮水平显著升高;郭慧君等[27]的研究也表明,大豆异黄酮使去势仔公猪的血清睾酮、IGF-I和血钙水平显著升高,但对去势仔母猪却表现为抑制作用,其血清睾酮和IGF-I含量下降。一般研究认为,异黄酮对雌性动物生长的抑制作用,可能与异黄酮的雌激素作用有关,雌激素使雌性动物促黄体激素(luteinizing hormone,LH)分泌下降,导致睾酮水平降低,使垂体GH的生成和释放减少[26,28-30]。本试验未呈现岷山红三叶异黄酮抑制雌性大鼠生长的剂量效应,与张勇等[23]的试验报道不一致,可能与该异黄酮具有弱的雌激素活性有关,且其作用远低于大鼠内源雌激素。而对雄性动物的作用机理不同,红三叶异黄酮等能与下丘脑、垂体等E2受体不同程度结合,影响动物神经内分泌系统的性轴,促进雄性动物睾酮的生成和释放;同时,也影响生长轴,使垂体的GH生成和释放增加,刺激肝脏GH受体发育和IGF-1生成加强,促进雄性动物生长[26,28-30]。
3.2 对大鼠免疫功能的影响
胸腺和脾脏是动物的重要免疫器官,胸腺系数和脾脏系数的大小直接反映机体免疫水平的高低。一般认为,免疫器官重量降低为免疫抑制所致,而免疫器官重量增加则为免疫增强的表现[24,25,31]。结果显示去卵巢能显著提高大鼠胸腺指数,添加红三叶异黄酮使其胸腺指数降低,当添加量≥160 mg/(kg BW·d)时,胸腺指数降低到与假手术组相近的水平,显示高剂量外源植物雌激素与内源雌激素一样具有抑制胸腺细胞增殖的作用。去卵巢使大鼠脾脏指数降低,添加红三叶异黄酮对其脾脏指数无明显影响。去卵巢也使大鼠T淋巴细胞转化率降低,但添加红三叶异黄酮10 mg/(kg BW·d)即可使T淋巴细胞转化率提高到与假手术组相近的水平,而提高添加剂量并不能使该指标进一步提高。这说明,低剂量红三叶异黄酮即可提高大鼠的细胞免疫功能。朱宇旌等[32]在肉鸡上的试验表明,低剂量(基础日粮中添加5 mg/kg)红三叶异黄酮能提高肉鸡免疫器官指数,当红三叶异黄酮添加量进一步提高时,肉鸡免疫器官相对重也表现出逐渐降低趋势。朱宇旌等[31]对苜蓿异黄酮的研究认为,其对小鼠特异性和非特异性免疫功能都有一定的提高和改善,适宜添加量为120 mg/(kg BW·d)。任慧玲[24]研究认为,中、高剂量的苜蓿及红三叶异黄酮能促进小鼠免疫器官的发育。刘德义[33]用奶牛试验也表明,大豆黄酮60和70 mg/kg添加组淋巴细胞转化率和T细胞数显著高于对照组。有研究认为,植物雌激素具有免疫抑制和免疫刺激的双重作用,低剂量雌激素可刺激淋巴细胞的增殖,而超生理剂量的雌激素抑制淋巴细胞增殖[34]。由此可见,不同来源的异黄酮对肉鸡、小鼠、奶牛和大鼠等不同动物的免疫调节作用及有效剂量各不相同,可能与异黄酮来源及试验动物种别有关,有待进一步研究和验证。本试验从红三叶异黄酮提高大鼠免疫力和降低生产成本的角度来看,10 mg/(kg BW·d)添加量比较适宜。
3.3 对血清抗氧化指标及E2含量的影响
研究表明,异黄酮的酚羟基作为供氢体能与自由基反应,使之形成相应的离子或分子,熄灭自由基,终止自由基的链式反应。异黄酮的抗氧化作用还表现在它们可减少活性氧自由基对DNA的损伤[33,35,36]。刘宝剑等[37]的体外试验证明了红三叶总黄酮清除自由基的作用,并且随着异黄酮浓度的增加,对羟自由基的清除作用增强。SOD和谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)是生物机体内重要的抗氧化酶,是重要的活性氧自由基清除剂[38],有研究表明,大豆异黄酮能提高体内抗氧化酶活性,用含300 mg/kg的染料木黄酮糖苷的高脂饲料喂养小鼠49 d,小鼠肝脏和心脏SOD和GSH-Px活性有不同程度地提高[39],并可减少体内MDA含量[40],刘德义等[33]对奶牛的试验中也得到了相似的结论。本试验结果表明,红三叶异黄酮具有降低血清CHO、LDL和HDL浓度,提高SOD活性,预防动脉粥样硬化,抵抗自由基引起氧化损伤的作用。大鼠灌服一定剂量(>80 mg/kg BW·d)的岷山红三叶异黄酮,可降低血清CHO、LDL和HDL浓度;随添加量增加,红三叶异黄酮对血清SOD含量的影响存在先下降,后上升的曲线关系,最大添加量组血清SOD含量达到了假手术组的相近水平;血清MDA含量因较大的个体差异,各组间未呈现统计学意义,但去卵巢组和10 mg/(kg BW·d)添加组血清MDA含量绝对值较高。同时还可看出,红三叶异黄酮在降低血清CHO和LDL含量的同时,也使血清HDL含量降低,与相关试验报道的大豆异黄酮上调血清HDL的作用[41]不一致,但与大豆黄酮在产蛋鸡[42],改构异黄酮在大鼠[43]上的研究结果相符,是否也与试验动物种别及异黄酮来源不同有关,需进一步验证。
各添加组血清E2含量介于去卵巢组和假手术组之间,随红三叶异黄酮添加量的增加而上升,且存在线性关系(y=0.010 6x+12.704;R2=0.896 9,P=0.001),320 mg/(kg BW·d)添加组血清E2含量达到了假手术组相近的水平,显示红三叶异黄酮具有弱的雌激素样作用,高剂量添加组也未出现血清E2含量高于假手术组的情况,说明其具有较好的使用安全性。李颖等[44]和陈琦等[45]试验表明,红三叶异黄酮在一定程度上具有提高去卵巢大鼠和围绝经期大鼠血清雌激素水平的作用。
4 结论
添加岷山红三叶异黄酮对去卵巢雌性大鼠生长具有一定的抑制作用,但不存在量效关系;低剂量的红三叶异黄酮具有提高大鼠 T淋巴细胞转化率的作用,以10 mg/(kg BW·d)的添加量比较适宜;适量(>80 mg/kg BW·d)的红三叶异黄酮可降低血清CHO、HDL和LDL浓度,升高血清SOD含量,具有明显的抗氧化作用。本试验未呈现红三叶异黄酮上调血清HDL的作用;岷山红三叶异黄酮具有弱的雌激素样作用和较好的使用安全性;综合各指标,岷山红三叶异黄酮的适宜添加量为80 mg/(kg BW·d)。
[1] 孟祥君,俞联平,程文定,等.接种根瘤菌与施肥对岷山红三叶异黄酮含量的影响[J].草业科学,2010,27(5):97-100.
[2] 王元生,李发弟,郝正里,等.岷山红三叶异黄酮对产蛋后期母鸡生产性能、骨矿化及血液指标的影响[J].草业学报,2010,19(2):133-139.
[3] 袁金斌,卢建中.紫外分光光度法测定大豆总异黄酮的含量[J].大豆科学,2004,23(2):147-149.
[4] 张大勇,宋豫红,宁海龙.不同纬度地点大豆籽粒异黄酮含量差异[J].中国油料作物学报,2007,29(3):277-280.
[5] 李小坤,鲁剑巍,陈防.牧草施肥研究进展[J].草业学报,2008,17(2):136-142.
[6] 杨澍,朱国旗,李庆林.植物雌激素类化合物药理学功效及作用机制研究概况[J].安徽中医学院学报,2010,29(2):76-78.
[7] Sarkar F H,Li Y.Mechanisms of cancer chemoprevention by soy isoflavone genistein[J].Cancer and Metastasis Reviews,2002,21(3-4):265-280.
[8] Vande Weijer P H,Barentsen R.Isoflavones from red clover(Promensil)significantly reduce menopausal hot flush symptoms compared with placebo[J].Maturitas,2002,42(3):187-193.
[9] Jiang Z Y,Jiang S Q,Lin Y C,etal.Effects of soybean isoflavone on growth performance,meat quality,and antioxidation in male broilers[J].Poultry Science,2007,86:1356-1362.
[10] Payne R L,Bidner T D,Southern L L,etal.Effects of dietary soy isoflavones on growth,carcass traits,and meat quality in growing-finishing pigs[J].Journal of Animal Science,2001,79:1230-1239.
[11] 周玉传,赵茹茜,卢立志,等.大豆黄酮对产蛋初期和后期绍兴鸭产蛋性能及血清激素水平的影响[J].动物营养学报,2002,14(2):14-18.
[12] 柯叶艳,王国杰,韩正康.日粮中添加大豆黄酮对鹌鹑生产性能和血中激素水平的影响[J].畜牧兽医学报,2002,33(3):243-246.
[13] 刘根桃.异黄酮植物雌激素-大豆黄酮对动物生长和泌乳的影响及神经内分泌机理的研究[D].南京:南京农业大学,1996.
[14] 张荣庆,韩正康,陈杰,等.大豆黄酮对母猪免疫功能和血清及初乳中GH、PRL、SS水平的影响[J].动物学报,1995,41(2):201-206.
[15] Bennets H W,Underwood E J,Hhier F L.A specific breeding problem of sheep on subterranean clover pastures in western Australia[J].Australian Veterinary Journal,1946,22(1):2-12.
[16] 俞联平,李发弟,程文定,等.钼、播种量和行距对岷山红三叶产量及异黄酮含量的影响[J].中国草地学报,2009,31(1):52-57.
[17] 崔治中.兽医免疫学实验指导(第一版)[M].北京:中国农业出版社,2006.
[18] 张凤翔.黄嘌呤氧化酶法测定血清中超氧化物歧化酶活力的影响因素[J].云南医药,2001,22(6):473-474.
[19] 赵世杰,许长成,邹琦.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1991,30(3):207-210.
[20] 叶应妩,王毓三,申子瑜.全国临床检验操作规程(第二版)[M].南京:东南大学出版社,1997.
[21] 王琰,钱士匀.临床化学和临床化学检验实验教程[M].北京:清华大学出版社,2005.
[22] 李金明.临床酶免疫测定技术[M].北京:人民军医出版社,2005.
[23] 张勇,朱宇旌,任慧玲.红三叶草异黄酮提取物对小鼠生长性能和免疫功能的影响[J].沈阳农业大学学报,2008,39(1):104-110.
[24] 任慧玲.紫花苜蓿及红三叶异黄酮对小鼠生长性能、免疫功能及抗氧化能力的影响[D].沈阳:沈阳农业大学,2007.
[25] 郭晓红,阎芳,赵恒寿.大豆黄酮对肉仔鸡生长相关激素水平与免疫机能的影响[J].中国兽医学报,2005,25(4):394-396.
[26] 郭晓红,赵恒寿.大豆黄酮对肉仔鸡生产性能及其有关内分泌的影响[J].动物营养学报,2005,17(2):63-64.
[27] 郭慧君,韩正康,王国杰.日粮添加大豆黄酮对去势仔猪生长性能及有关内分泌的影响[J].中国畜牧杂志,2002,38(2):17-18.
[28] 高峰,同光宏.大豆黄酮对雏公鸡生产性能和机体免疫的影响[J].中国家禽,2000,22(10):8-9.
[29] 赵志辉,金邦荃,陆天水.大豆黄酮对二花脸青年去势公猪生长的影响[J].上海农业学报,2002,18(3):78-81.
[30] 程忠刚,林映才,余德谦.大豆黄酮对肥育猪生产性能的影响及其作用机制探讨[J].动物营养学报,2005,17(1):30-34.
[31] 朱宇旌,张勇,宁自利,等.苜蓿异黄酮提取物对小鼠生长和免疫功能的影响[J].营养学报,2008,30(6):615-618.
[32] 朱宇旌,田书音,张勇.红三叶异黄酮对肉鸡免疫功能和抗氧化性能的影响[J].沈阳农业大学学报,2008,39(6):699-703.
[33] 刘德义,顾有方,王永鑫.大豆黄酮对奶牛血清抗氧化能力和免疫功能的影响[J].中国兽医学报,2008,28(11):1306-1309.
[34] 马得莹,单安山,杜娟.大豆黄酮对动物生产性能、免疫功能与抗氧化作用的影响[J].东北农业大学学报,2004,35(4):505-508.
[35] 郑高利,朱寿民,刘子贻.大豆异黄酮的抗氧化作用[J].浙江医科大学学报,1997,26(5):196-199.
[36] 朱宇旌,任慧玲,张勇.红三叶异黄酮提取物对小鼠抗氧化功能的影响[J].沈阳农业大学学报,2010,41(1):102-105.
[37] 刘宝剑,郭延生,刁鹏飞,等.红车轴草总黄酮体外清除自由基作用的研究[J].天然产物研究与开发,2009,(21):44-47.
[38] 张彬,谭琼,李丽立,等.金属硫蛋白对奶牛血液抗氧化酶GSH-Px和CAT基因表达的影响[J].草业学报,2010,19(3):132-138.
[39] 闰祥华,顾景范,孙存普,等.大豆异黄酮对大鼠血脂和过氧化状态的影响[J].营养学报,2000,22(1):31-34.
[40] 叶艳彬,卓淑雨,苏宜香.大豆异黄酮类对去卵巢大鼠内分泌和抗氧化系统的影响[J].中国老年医学杂志,2005,25(1):75-77.
[41] Mc Veigh B L,Dillingham B L,Lampe J W,etal.Effect of soy protein varying in isoflavone content on serum lipids in healthy young men[J].The American Journal of Clinical Nutrition,2006,83:244-251.
[42] 赵凤岐,黄毅,曹谨玲.大豆黄酮对产蛋鸡生产性能、血液指标及激素分泌的影响[J].核农学报,2008,22(6):892-897.
[43] 陈秀明,艾国平,粟永萍.新型异黄酮类化合物对去势大鼠血脂胆固醇的影响[J].第三军医大学学报,2007,29(16):1559-1561.
[44] 李颖,薛存宽,何学兵.红车轴草异黄酮对去卵巢大鼠骨质疏松防治作用的实验研究[J].中国骨质疏松杂志,2005,11(4):509-511.
[45] 陈琦,薛存宽,沈凯.红车轴草异黄酮对去势大鼠骨质疏松影响的实验研究[J].中国药师,2005,8(7):538-540.
