不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响
2012-04-12崔秀妹刘信宝李志华孙凯燕李卉张婷婷
崔秀妹,刘信宝,李志华,孙凯燕,李卉,张婷婷
(南京农业大学动物科技学院,江苏 南京210095)
*扁蓿豆(Melilotoidesruthenica)是豆科苜蓿属植物,又名花苜蓿、野苜蓿、扁豆子、扁豆草、网果葫芦巴等[1],广泛分布于我国北方的高山草原、典型草原和荒漠化草原,具有抗旱、耐寒、耐贫瘠、耐践踏等优点[2],并且蛋白质含量高,家畜适口性好,不含皂素,家畜过量采食不会发生鼓胀病,是一种优质的蛋白质饲料[3]。
水杨酸(salicylic acid,SA),即邻羟基苯甲酸,是一种植物体内产生的简单酚类化合物,在植物抵抗生物和非生物胁迫反应中,作为重要的信号分子[4]。研究发现,水杨酸可以影响植物体内多种与逆境代谢相关的生理活动,如诱导逆境相关蛋白的表达、激活植物超敏反应和系统获得性抗性,以及调节细胞抗氧化机制等,从而提高植物对逆境胁迫的耐受能力[5,6]。水杨酸具有使用方便、高效、无毒、无残留、低成本等特点,在农业生产中具有广阔的应用前景。目前,国内外学者对利用水杨酸提高植物抗旱性进行了大量的研究,发现水杨酸可提高干旱胁迫下小麦(Triticumaestivum)、毛豆(Glycinemax)、黑麦草(Loliumperenne)等植物细胞抗氧化酶的活性、降低质膜透性,进而增强了这些植物的耐旱性[7-9],但对扁蓿豆的研究尚未见详细报道。
本研究采用盆栽实验的方法,以扁蓿豆为材料,研究不同水分条件下、不同浓度的水杨酸处理对分枝期扁蓿豆生长和光合生理特性的影响,以期筛选出有效提高扁蓿豆抗旱性的适宜水杨酸浓度,初步探讨水杨酸对扁蓿豆光合生理的影响,为深入研究水杨酸对扁蓿豆抗旱性调控的机制提供基础数据,亦为水杨酸应用于扁蓿豆的生产实践提供理论参考。
1 材料与方法
1.1 试验地点
盆栽实验于2011年4-8月在江苏省南京市(118°22′~119°14′E,31°14′~32°02′N,长江流域下游棉区)南京农业大学牌楼教学科研基地(118°51′E,32°01′N)进行。该地区属北亚热带季风气候区,四季分明,年平均气温15.4℃,年平均相对湿度76%,年平均降水量1 106 mm,海拔18 m,全年无霜期达200~300 d。春季风和日丽,梅雨时节,阴雨绵绵;夏季受欧亚大陆低压区影响,天气炎热,雨水充沛;秋天干燥、凉爽;冬季寒冷、干燥。
1.2 供试材料
扁蓿豆品种为‘土默特扁蓿豆’,种子由中国农业科学院草原研究所提供,2010年10月采收。扁蓿豆硬实率高,播前采用砂纸(型号P36,规格:230 mm×93 mm)打磨,处理后扁蓿豆发芽率为92.33%。水杨酸,国药集团化学试剂有限公司生产。盆钵规格为34 cm×21 cm×27 cm(上径×下径×高)。所用基质为土壤∶河沙=2∶1(质量比),混合均匀,过筛去杂。土壤有机质含量为5.70 g/kg,铵态氮9.75 mg/kg,硝态氮28.34 mg/kg,速效磷14.45 mg/kg,速效钾125.24 mg/kg,p H 8.12,田间持水量(field capacity,FC)29.37%。
1.3 实验设计与方法
实验采用裂区设计,主因素为水分处理,分别为:正常供水(80%田间持水量,80%FC),轻度水分胁迫(60%田间持水量,60%FC)、中度水分胁迫(40%田间持水量,40%FC)、重度水分胁迫(20%田间持水量,20%FC),分别用 W80、W60、W40和 W20表示。副因素为水杨酸浓度处理,分别为S0(0 mmg/L)、S0.02(0.02 mmol/L)、S0.1(0.10 mmol/L)、S0.5(0.50 mmol/L)和S2.5(2.50 mmol/L),共20个处理,每个处理4次重复,共80盆。每盆装绝干基质15.5 kg,盆底垫2层滤纸,以防基质流出,每盆施80 g有机肥作为基肥,其总养分(N+P2O5+K2O)>6%。2011年4月20日播种,每盆播100粒,幼苗长出3片真叶时间苗,每盆定苗45株。开始时,每盆统一正常浇水量,待植株生长至5片真叶时进行水杨酸叶片喷施,喷施时间为早晨,连续3 d(2011年6月10-12日)。药液用量为每盆40 m L(用清水预试时,喷施量为40 m L时,叶片即可湿润),对照(S0)喷等量去离子水,同时进行水分控制,不浇水待土壤水分自然消耗至设定标准后,每日傍晚18:00开始用电子秤称重法将各盆进行称重,补充当天失去的水分,使各处理保持设定的相对含水量,于扁蓿豆分枝期测定各指标。
1.4 测定指标和方法
1.4.1 形态指标的测定 株高、茎粗、一级分枝数:每盆随机取6株,用直尺测定地面至主茎叶尖的拉直长度,为株高;用游标卡尺测定植株主茎基部的茎粗,为茎粗;计数植株主茎长出的分枝数,为一级分枝数。
叶面积:采集完全伸展、无病虫害的15片叶片,用LI-3100C(LI-COR,USA)叶面积仪测定叶面积,计算出单片叶面积,每盆重复3次。
1.4.2 生理指标的测定 选取扁蓿豆顶端第3~5片完全展开的叶片,立即放入冰盒中,带回实验室后于-80℃冰箱内保存,用于生理指标的测定,各指标测量时重复3次,比色时所用分光光度计均为2800 UV/Vis(UNICO,USA)紫外-可见分光光度计。
参照Xue等[10]的方法,提取的酶液于4℃冰箱内保存,用于酶活性的测定。生理指标测定方法:叶绿素含量采用95%乙醇浸提法[13]测定;叶片相对含水量采用饱和称重法[11]测定;相对电导率采用电导仪法[12]测定;丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸显色法[11]测定;超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法[12]测定;过氧化物酶(peroxidase,POD)活性采用愈创木酚比色法[12]测定;过氧化氢酶(catalase,CAT)活性采用过氧化氢法[12]测定;游离脯氨酸含量采用酸性茚三酮比色法[11]测定;可溶性糖含量采用蒽酮比色法[11]测定;可溶性蛋白质含量采用考马斯亮蓝G-250染色法[11]测定。
1.4.3 光合指标的测定 于2011年7月1-3日(晴朗无云)上午8:30-11:30,每盆选东西南北4个方向自顶端向下第2片完全展开的功能叶片各1片,用Li-6400(Li-COR,USA)便携式光合仪测定叶片光合速率(photosynthetic rate,Pn,μmol CO2/m2·s)、蒸腾速率(transpiration rate,Tr,mmol H2O/m2·s)、气孔导度(stomatal conductance,Gs,mol H2O/m2·s)、胞间 CO2浓度(intercellular CO2concentration,Ci,μmol CO2/mol)、大气CO2浓度(atmospheric CO2concentration,Ca,μmol CO2/mol)。当Pn参数稳定在小数点之后一位,0<Gs<1、Ci>0、Tr>0,stable=1时开始计数。气孔限制值(stomatal limitation values,Ls)和叶片瞬时水分利用效率(water use efficiency,WUE,μmol CO2/mmol)由公式计算,即Ls=1-Ci/Ca,WUE=Pn/Tr。
1.5 数据处理与统计分析
利用Microsoft Excel和SAS 8.0软件进行实验数据的统计,ANOVA进行方差分析,采用新复极差法(Duncan)对数据进行差异显著性分析,差异显著水平为0.05。
2 结果与分析
2.1 水分胁迫下水杨酸对扁蓿豆生长的影响
2.1.1 株高 同一水杨酸水平下,扁蓿豆株高随着水分胁迫强度的增加有逐渐降低趋势(表1),S0、S0.1水平,W80、W60、W40处理株高差异不显著,但均显著高于 W20处理;S0.02水平,W20处理株高显著低于 W80、W60处理,其他水分处理间差异不显著;S0.5水平,W60、W40、W20处理株高差异不显著,但均显著低于 W80处理;S2.5水平,W80、W40、W20处理株高依次显著降低,W60处理显著高于W20处理。同一水分水平下,比较不同水杨酸处理下扁蓿豆株高,W80、W40水平,对照S0及各水杨酸处理差异不显著;W60水平,S0.1处理比对照S0显著提高了23.01%;W20水平,S0.1、S0.5处理分别比对照S0显著提高了37.29%和38.32%。可见,在水分胁迫条件下,喷施水杨酸可减小扁蓿豆株高的降低幅度。
2.1.2 茎粗 同一水杨酸水平下,扁蓿豆茎粗随着水分胁迫强度的增加呈逐渐降低趋势(表1),S2.5水平,W20处理茎粗显著低于W80处理,与其他2种水分处理差异不显著;S0及其他3种水杨酸水平,各水分处理茎粗差异均不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆茎粗,W40水平,S0.1处理比对照S0显著提高了25.77%,与其他处理差异不显著;其他3种水分水平,对照S0及各水杨酸处理无显著差异。
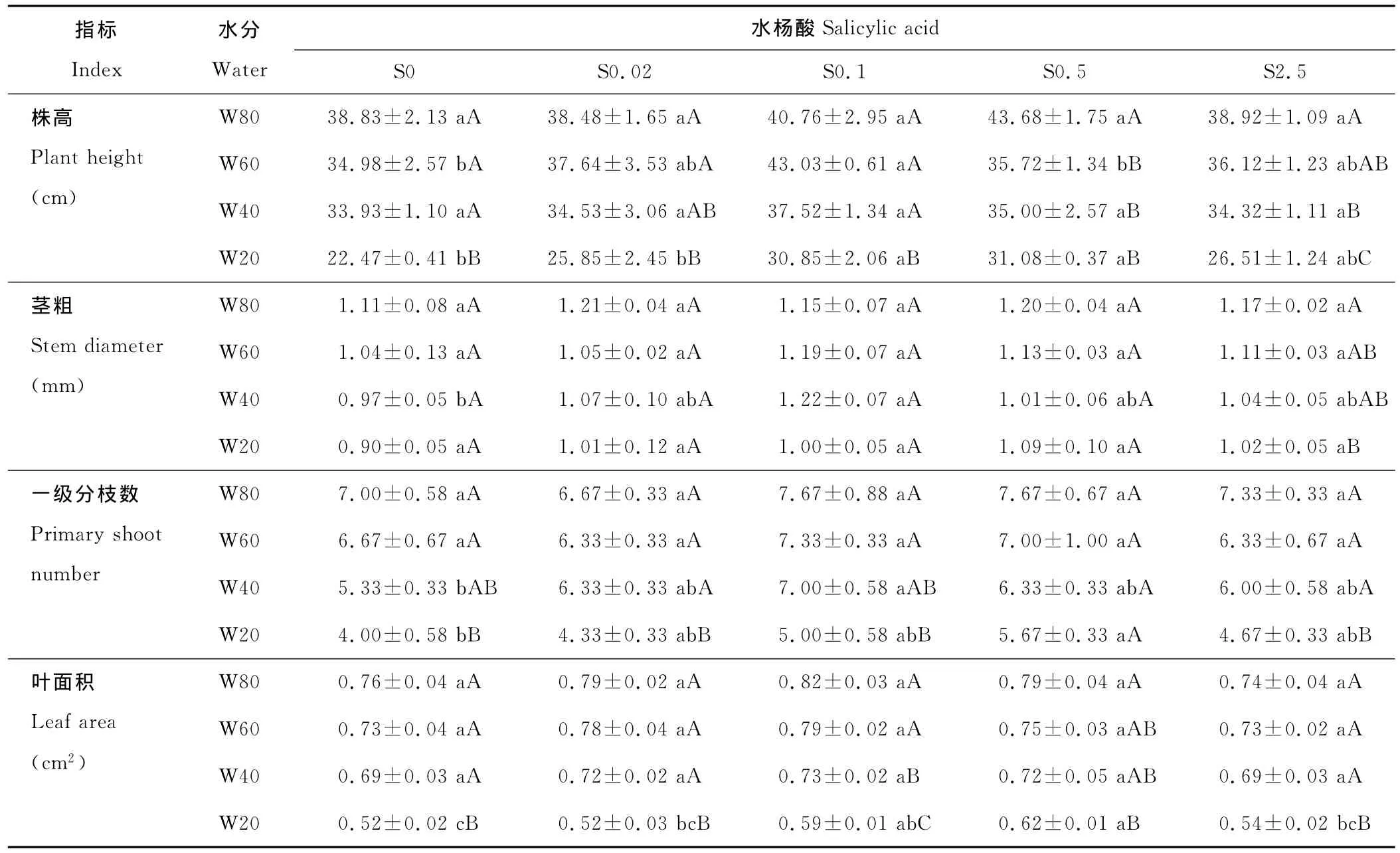
表1 水分胁迫下水杨酸对分枝期扁蓿豆生长的影响Table 1 Effects of SA on growth of M.ruthenica in branching under water stress
2.1.3 一级分枝数 同一水杨酸水平下,扁蓿豆一级分枝数随着水分胁迫强度的增加逐渐降低(表1),各水杨酸水平下,W80、W60、W40处理的扁蓿豆一级分枝数差异均不显著。S0.5水平,各水分处理一级分枝数无显著差异;其他水杨酸水平,W20处理一级分枝数均比W80、W60处理显著降低。同一水分水平下,比较不同水杨酸处理下扁蓿豆一级分枝数,W80、W60水平,对照S0及各水杨酸处理差异不显著;W40水平,S0.1处理一级分枝数最多,比对照S0显著提高了31.33%,与其他处理差异不显著;W20水平,S0.5处理比对照S0显著提高了41.75%,与其他处理差异不显著。
2.1.4 叶面积 同一水杨酸水平下,扁蓿豆叶面积随着水分胁迫强度的增加逐渐降低(表1)。S0.1水平,W40处理叶面积显著低于 W80、W60处理,显著高于 W20处理;S0、S0.02、S2.5水平,W20处理叶面积比其他3种水分处理显著降低,而这3种水分处理之间差异不显著;S0.5水平,W80处理叶面积显著高于W20处理,而其他水分处理间差异不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶面积,W20水平,S0.1、S0.5处理叶面积分别比对照S0显著提高了13.46%和19.23%;其他3种水分水平,对照S0及各水杨酸处理差异不显著。
2.2 水分胁迫下水杨酸对扁蓿豆叶片叶绿素含量、叶片相对含水量和细胞膜稳定性的影响
2.2.1 叶绿素含量 同一水杨酸水平下,扁蓿豆叶片叶绿素含量随着水分胁迫强度的增加而逐渐增加(表2)。S0水平,W20处理使叶绿素含量较其他3种水分处理显著提高;S0.02、S0.1、S0.5水平,W60、W40处理显著高于W80处理,显著低于W20处理;S2.5水平,W40处理显著高于 W80处理,显著低于 W20处理,W80、W60处理之间差异不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片叶绿素含量,W80水平,对照S0及各水杨酸处理差异不显著;W60水平下S0.1处理,W40水平下S0.1、S0.5处理,W20水平下S0.5处理均显著高于对应水分水平下对照S0,其中,W40水平下,S0.1处理提高幅度最大,比对照S0提高了17.32%。
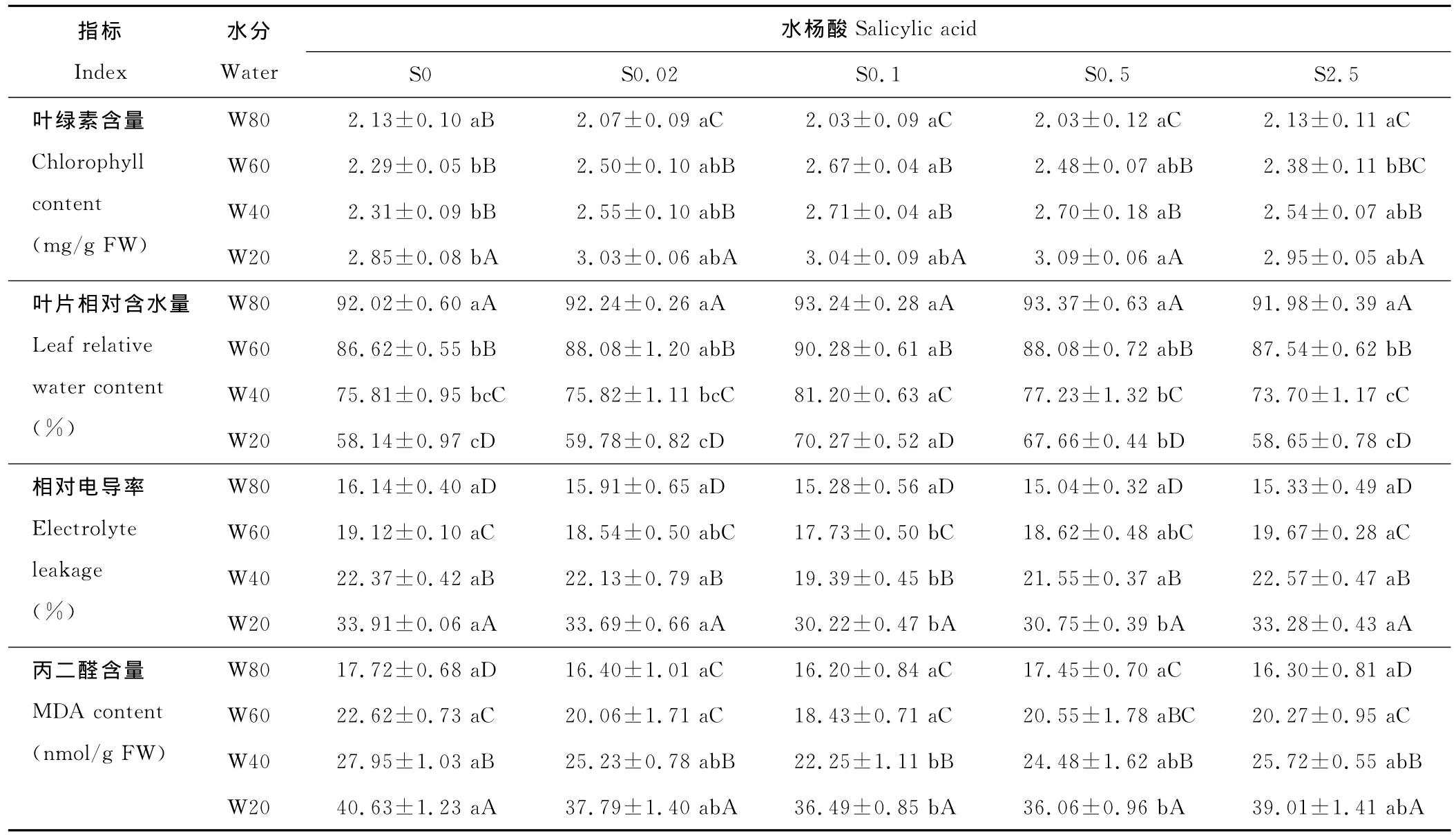
表2 水分胁迫下外源水杨酸对分枝期扁蓿豆叶绿素含量、叶片相对含水量、相对电导率及丙二醛含量的影响Table 2 Effects of SA on chlorophyll content,leaf relative water content,electrolyte leakage and MDA content of M.ruthenica in branching stage under water stress
2.2.2 叶片相对含水量 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片相对含水量显著降低(表2)。喷施水杨酸均减小了叶片相对含水量降幅,S0水平,W20较W80下降了36.82%,S0.1水平,W20较W80降幅最低,仅降低了24.64%。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片相对含水量,W80水平,对照S0及各水杨酸处理间差异不显著;W60、W40水平,S0.1处理分别比对照S0显著提高了4.25%和7.11%;W20水平,S0.1、S0.5处理分别比对照S0显著提高了20.86%和16.37%。
2.2.3 相对电导率 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片相对电导率显著升高(表2),W20处理为W80处理的2倍左右。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片相对电导率,W80水平,对照S0及各水杨酸处理差异不显著;W60、W40水平,S0.1处理分别比对照S0显著降低了7.27%和13.32%;W20水平,S0.1、S0.5处理分别比对照S0显著降低了10.88%和9.32%。可见,适宜浓度的水杨酸具有降低扁蓿豆叶片相对电导率的作用。
2.2.4 MDA含量 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片MDA含量的变化与相对电导率变化趋势相似(表2)。S0、S2.5水平,随着水分胁迫强度的增加,MDA含量显著升高;S0.02、S0.1水平,W40处理MDA含量显著高于 W80、W60处理,低于 W20处理,W80、W60处理间差异不显著;S0.5水平,W40处理MDA含量显著高于W80处理,低于W20处理,W80、W60处理间差异不显著。同一水分水平下,喷施水杨酸的各处理MDA含量均低于对照S0。W80、W60水平,对照S0及各水杨酸处理差异不显著;W40水平,S0.1比对照S0显著降低了20.39%;W20水平,S0.1、S0.5分别比对照S0显著降低了10.19%和11.25%。
2.3 水分胁迫下水杨酸对扁蓿豆分枝期抗氧化酶活性及有机渗透调节物质含量的影响
2.3.1 SOD活性 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片SOD活性呈先增加后降低的趋势(表3),均在W40处理下达到最大值,且除S0.02水平外,W40处理均显著高于其他处理。同一水分水平下,不同水杨酸处理对扁蓿豆叶片SOD活性影响不同,W80水平,S0.1处理SOD活性最高,显著高于S0.02、S2.5处理;W60、W40水平,S0.1处理均显著高于对照S0;W20水平,S0.1、S0.5处理显著高于对照S0,所有处理中,W60水平下S0.1处理最高,比对照S0提高了28.67%。
2.3.2 POD活性 同一水杨酸水平下,扁蓿豆叶片POD活性随着水分胁迫强度的增加逐渐增加(表3),W20处理显著高于W80、W60处理。同一水分水平下,不同水杨酸处理对扁蓿豆POD活性影响不同,W80水平,对照S0及各水杨酸处理差异不显著;W60水平,S0.1、S0.5处理均显著高于对照S0;W40水平,S0.1处理显著高于对照S0和其他水杨酸处理;W20水平,S0.5处理比对照S0显著提高了12.41%。
2.3.3 CAT活性 同一水杨酸水平下,扁蓿豆叶片CAT活性随着水分胁迫强度的增加呈逐渐增加的趋势(表3)。S0水平,随着水分胁迫强度的增加,CAT活性依次显著增加;S0.02、S0.1水平,W60、W40、W20处理均显著高于W80处理,且这3种水分处理之间差异不显著;S0.5和S2.5水平,W60、W40处理均显著高于 W80处理,显著低于W20处理。同一水分水平下,不同水杨酸处理对扁蓿豆CAT活性影响不同,W80水平,S0.1处理使CAT活性显著提高了13.79%;W60水平,各水杨酸处理均显著提高了CAT活性,其中S0.1处理最高,比对照S0提高了46.27%;W40水平,S0.1、S0.5处理分别比对照S0显著提高28.00%和21.33%;W20水平,S0.5处理比对照S0显著提高了16.48%。
2.3.4 游离脯氨酸含量 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片游离脯氨酸含量先缓慢增加后迅速增加(表3),W20处理下游离脯氨酸含量均分别是W80处理的26倍以上。W40、W20处理均显著高于W80、W60处理,且W80和W60处理,W40和W20处理间差异均不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片游离脯氨酸含量,W80水平,对照S0及各水杨酸处理无显著差异;W60、W40水平,S0.1处理分别比对照S0显著提高了19.59%和24.82%;W20水平,S0.1、S0.5处理分别比对照S0显著提高了6.56%和8.64%。
2.3.5 可溶性糖含量 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片可溶性糖含量先降低后升高(表3)。所有水杨酸水平下,W40处理最低,显著低于W80、W20处理。同一水分水平下,比较不同水杨酸处理下扁蓿豆可溶性糖含量,W80、W60水平,对照S0及各水杨酸处理差异不显著;W40、W20水平,S0.1处理分别比对照S0显著提高31.96%和24.77%。
2.3.6 可溶性蛋白含量 同一水杨酸水平下,扁蓿豆叶片可溶性蛋白含量随着水分胁迫强度的增加逐渐增加(表3)。S0、S0.1、S0.5水平,随着水分胁迫强度,可溶性蛋白含量显著增加;S0.02水平,W20处理显著高于其他3种水分处理,且这3种水分处理间差异不显著;S2.5水平,W60、W40处理显著高于W80处理,低于 W20处理,且W60、W40处理间无显著差异。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片可溶性蛋白含量,W80水平,对照S0及各水杨酸处理无显著差异;W60水平,S0.1处理显著高于S0和S0.02处理,与其他2种水杨酸处理差异不显著;W40、W20水平,S0.1、S0.5处理均显著高于对照S0,其中,W40水平下S0.1处理提高幅度最大,比对照S0提高了20.07%。
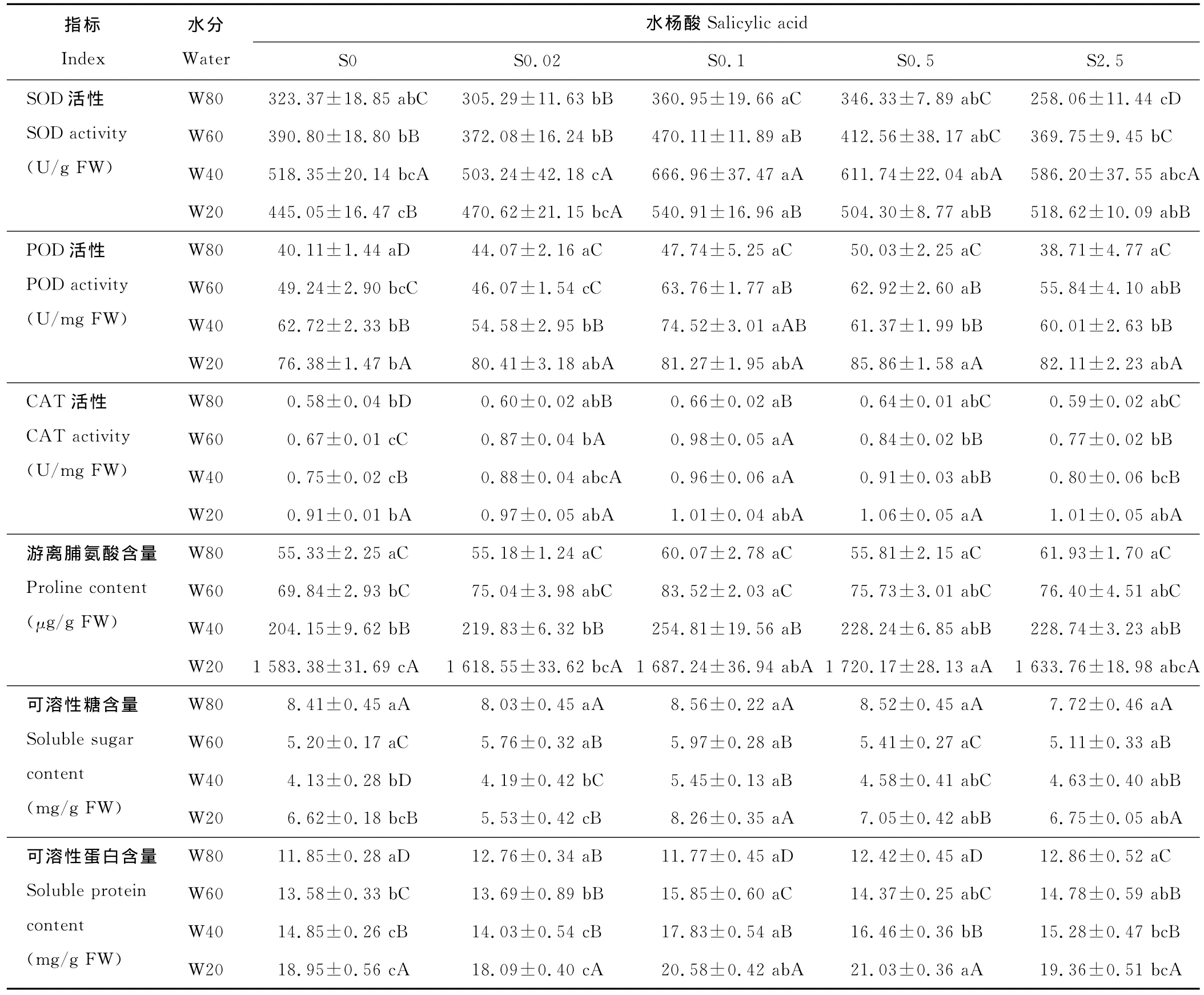
表3 水分胁迫下水杨酸对分枝期扁蓿豆抗氧化酶活性及有机渗透调节物质含量的影响Table 3 Effects of SA on antioxidant enzymes activities and organic matter content of osmotic adjustment of M.ruthenica in branching stage under water stress
2.4 水分胁迫下水杨酸对扁蓿豆分枝期光合特性的影响
2.4.1 光合速率(Pn) 同一水杨酸水平下,扁蓿豆Pn随着水分胁迫强度的增加呈逐渐降低的趋势(表4),S0水平,随着水分胁迫强度的增加,Pn显著降低;S0.02水平,W80、W60处理Pn显著高于W40、W20处理,但W80与W60处理、W40与W20处理之间差异不显著;S0.1水平,W20处理Pn显著低于其他3种水分处理,且这3种水分处理间差异不显著;S0.5水平,W80处理Pn显著高于W40、W20处理,与W60处理差异不显著;S2.5水平,W80、W40、W20处理,Pn依次显著降低,且 W80与W60,W60与 W40之间差异不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆Pn,W80水平,对照S0及各水杨酸处理差异不显著;W60、W40水平,S0.1处理均最高,并分别比对照S0显著提高21.32%和49.33%;W20水平,S0.5处理最高,显著高于除S0.1处理外的其他2种水杨酸处理和对照,比对照S0显著提高了35.80%。
2.4.2 蒸腾速率(Tr) 同一水杨酸水平下,扁蓿豆叶片Tr随着水分胁迫强度的增加先缓慢降低后迅速降低(表4),W20处理均仅为W80处理的10%左右。S0水平,W60、W40处理Tr均显著低于 W80处理,高于 W20处理;S0.02、S0.1水平,W60、W80处理 Tr差异不显著,均显著高于 W20处理;S0.5、S2.5水平,W80、W60、W40处理Tr差异不显著,但均显著高于W20处理。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片Tr,W60水平,S0.1处理显著高于对照S0和S2.5处理,与其他2种水杨酸处理之间差异不显著;W80、W40、W20水平,各水杨酸处理及对照S0差异不显著。

表4 水分胁迫下水杨酸对扁蓿豆分枝期光合特性的影响Table 4 Effects of SA on photosynthetic characteristics of M.ruthenica in branching stage under water stress
2.4.3 气孔导度(Gs) 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片Gs呈逐渐下降的趋势(表4)。S0及各水杨酸水平,Gs变化相似,均表现为W40处理显著低于W80、W60处理,显著高于W20处理,W80、W60处理之间差异不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片Gs,W80水平,S0.5处理显著高于对照S0和S0.02处理;W60水平,除S0.02处理对Gs影响不大外,其他水杨酸处理均显著高于对照S0,其中S0.1处理最高,比对照S0提高26.56%;W40水平,S0.1处理显著高于对照S0和S0.02处理;W20水平,S0.5处理显著高于对照S0。
2.4.4 胞间CO2浓度(Ci) 同一水杨酸水平下,随着水分胁迫强度的增加,扁蓿豆叶片Ci先缓慢降低,在W20处理时迅速降低,W20处理Ci仅为W80处理的1/6左右(表4)。S0水平,随着水分胁迫强度的增加,Ci显著降低;S0.02、S0.1水平,W40处理Ci显著低于W80和W60处理,显著高于W20处理,W80和W60处理无显著差异;S0.5水平,W60和W40处理Ci差异不显著,均显著低于W80处理,显著高于 W20处理;S2.5水平,W20处理Ci显著低于其他3种水分处理。同一水分水平下,除W20水平下S2.5处理Ci比对照S0低外,其他各水杨酸处理Ci均比对照S0高。W80、W20水平,对照S0及各水杨酸处理Ci差异不显著;在W60水平,S0.02、S0.1处理均显著高于对照S0及其他水杨酸处理;W40水平,S0.1、S0.5、S2.5处理均比对照S0显著提高,其中S0.1处理最高,比对照S0提高了19.38%。
2.4.5 气孔限制值(Ls) 同一水杨酸水平下,扁蓿豆叶片Ls随着水分胁迫强度的增加呈增加趋势(表4),S0、S0.02、S0.1水平,W40处理Ls显著高于W80和W60处理,显著低于W20处理,W80和W60处理差异不显著;S0.5水平,随着水分胁迫强度的增加,Ls显著增加;S2.5水平,W20处理显著高于其他3种水分处理,W40显著低于W80处理,与W60差异不显著。同一水分水平下,比较不同水杨酸处理下扁蓿豆叶片Ls,W80水平,S0.1、S0.5处理均显著低于对照S0;W60水平,S0.02、S0.1处理分别比对照S0显著降低了35.48%,38.71%;W40水平,S0.1、S0.5、S2.5处理分别比对照S0显著降低了34.15%,21.95%,19.51%;W20水平,对照S0及各水杨酸处理差异不显著。
2.4.6 水分利用效率(WUE) 同一水杨酸水平下,不同水分处理对扁蓿豆叶片 WUE的影响不同(表4),W20处理WUE均分别比其他3种水分处理显著提高,而其他3种水分处理间差异不显著。同一水分水平下,比较不同水杨酸处理下WUE,W80、W60水平,对照S0及各水杨酸处理差异不显著;W40水平,S0.1处理比对照S0显著提高了86.05%;W20水平,S0.5处理显著高于对照S0和S0.02处理,比对照S0提高了45.75%。
3 讨论
3.1 水分胁迫下水杨酸对扁蓿豆分枝期生长的影响
水分胁迫引起植物的生理变化,对植物的器官造成不同影响,生长会受到抑制[14]。本研究中,扁蓿豆分枝期株高、茎粗、分枝数、叶面积随水分胁迫强度的增加而呈逐渐下降的趋势,与Zhang等[15]研究发现干旱胁迫下的山杨(Populusdavidiana)幼苗株高和叶面积显著降低及Ohash等[16]发现干旱胁迫显著降低大豆(Glycine max)茎粗及叶面积的研究结果相一致。本研究中,轻度和中度水分胁迫下施入0.10 mmol/L水杨酸,重度水分胁迫下施入0.50 mmol/L水杨酸,均可显著改善扁蓿豆分枝期的生长,与Bidabadi等[17]发现1 mmol/L水杨酸显著提高了香蕉(Musaacuminata)外植体再生枝条数及Patel和Hemantaranjian[18]用1.5 mmol/L水杨酸提高了花期鹰嘴豆(Cicerarietinum)叶面积的研究结果相一致,可见,适宜浓度的水杨酸对干旱胁迫条件下扁蓿豆的株高、茎粗、分枝数和叶面积具有调控作用,改善其生长状况。
3.2 水分胁迫下水杨酸对扁蓿豆分枝期叶绿素含量、叶片相对含水量、细胞膜稳定性的影响
植物叶片叶绿素含量既可以直接反映植物光合能力,又可以衡量植物抗逆性[19]。大多数植物叶片叶绿素含量随水分胁迫的加剧不断降低。但董明等[20]对阿诺红鞑靼忍冬(Loniceratatarica)的研究发现水分胁迫增加了叶片叶绿素含量,原因可能是水分胁迫下叶片相对含水量降低,叶绿素呈相对浓缩状态,单位鲜重中含量相对升高,也可能与植物对环境因子的补偿和超补偿效应有关。本研究中,随着水分胁迫强度的增加,扁蓿豆叶片叶绿素含量也不断升高,但具体原因还需更深入研究。本研究中,轻度和中度水分胁迫下施入0.10 mmol/L水杨酸,重度水分胁迫下施入0.50 mmol/L水杨酸,均可显著提高扁蓿豆叶片叶绿素含量,与姜中珠和陈祥伟[21]用0.11 mmol/L的水杨酸极显著地提高了干旱胁迫下丁香(Syzygiumaromaticum)的叶绿素含量的研究结果一致,可见,逆境中叶绿素含量的增加,可以保证植物叶片对光能的充分利用,增强了植株在逆境中的生存能力。
植物组织相对含水量反映了植物体内水分亏缺程度[22]。当植物受到水分胁迫时,叶片相对含水量会迅速降低,活性氧自由基迅速积累,攻击膜系统,膜脂中的不饱和键被过氧化,最终形成损害膜系统的MDA[23]。本研究发现,扁蓿豆叶片相对含水量随水分胁迫强度的增加显著下降,MDA含量和相对电导率有所增加,但增幅不大,而重度胁迫时MDA显著增加,与Valentoviˇc等[24]发现干旱胁迫降低了玉米(Zeamays)叶片相对含水量,提高了叶片MDA含量和电导率的研究结果相一致。本研究中,在轻度、中度和重度3种水分胁迫下,施入0.10 mmol/L的水杨酸可以显著提高叶片相对含水量,与Loutfy等[25]用0.5 mmol/L水杨酸显著提高了干旱胁迫下小麦叶片相对含水量的研究结果一致。本研究中,在轻度和中度水分胁迫下施入0.10 mmol/L水杨酸,在重度水分胁迫条件下施入0.50 mmol/L水杨酸均可显著降低扁蓿豆叶片 MDA含量、相对电导率,与陆小明和谷超[8]用0.1,0.5 mmol/L水杨酸均显著降低了毛豆叶片相对电导率和 MDA含量的结果相一致,可见,适宜浓度的水杨酸处理,可提高扁蓿豆叶片相对含水量,降低水分胁迫条件下扁蓿豆叶片MDA含量、相对电导率,从而降低膜脂过氧化对细胞造成的伤害。
3.3 水分胁迫下水杨酸对扁蓿豆分枝期抗氧化酶活性的影响
在正常条件下,植物细胞活性氧处于低水平的动态平衡之中,当植物受到逆境胁迫时,体内活性氧产生与清除机制失衡,造成细胞中活性氧迅速积累,对植物膜脂、蛋白质和其他细胞组分造成伤害,乃至细胞死亡[26]。通常,当植物受到水分胁迫时,体内以SOD、POD、CAT为主的保护酶活性会增加,清除活性氧,增加其抗逆性,且抗旱性强的品种增加幅度大。孔德政等[27]对不同品种菊花(Chrysanthemummorifolium)的研究发现,随着水分胁迫强度的增加,叶片SOD、POD、CAT活性均迅速增加。WU等[28]对柑橘(Citrustangerine)研究得到同样的结果。本研究发现,未加水杨酸的情况下,轻度、中度和重度水分胁迫下,扁蓿豆叶片SOD活性明显高于正常供水处理,这与王贺正等[29]的研究结果一致,表明适度水分胁迫能增强SOD活性,这是植物细胞对外界胁迫条件的一种适应性反应,但当水分胁迫程度过大,自由基产生与清除平衡失调时,就会导致SOD活性的降低。POD、CAT活性随着水分胁迫的增加不断升高,不断将SOD转化的H2O2清除,减少活性氧对扁蓿豆的伤害。本研究中,在轻度、中度和重度水分胁迫条件下,施入0.10 mmol/L水杨酸分别使SOD活性比未施水杨酸的对照提高了20.29%,28.67%和21.54%。在轻度、中度水分胁迫下施入0.10 mmol/L水杨酸,在重度水分胁迫下施入0.50 mmol/L水杨酸均显著地提高了POD、CAT活性,与孙歆等[30]用0.3~0.5 mmol/L水杨酸明显提高了水分胁迫下大麦(Hordeumvulgare)幼苗叶片SOD活性及Ahmad等[31]用0.2和0.4 mmol/L水杨酸均显著提高了玉米叶片POD、CAT活性的研究结果相一致。Agarwal等[32]认为水杨酸通过激活抗氧化酶共同的转录因子诱导抗氧化酶的表达,但更深入的联系有待进一步研究。
3.4 水分胁迫下水杨酸对扁蓿豆分枝期有机渗透调节物质含量的影响
在水分胁迫下,大多数植物会通过主动积累游离脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质来降低植物体内渗透势,以利于植物在干旱逆境下维持正常生长所需水分,进而提高植物的抗逆性[33]。本研究中,随着水分胁迫强度的增加,叶片游离脯氨酸、可溶性蛋白含量均不断增加,表明扁蓿豆可通过增加体内游离脯氨酸和可溶性蛋白含量来维持渗透平衡,具有很强的耐旱性。杨鑫光等[34]、李树华等[35]分别发现幼苗霸王(Zygophyllum xanthoxylum)、牛心朴子(Cynanchumkomarovii)随着土壤水分胁迫强度的增加,叶中的可溶性糖呈下降趋势,牛心朴子根、茎中的可溶性糖呈明显增加趋势,说明干旱胁迫促进了牛心朴子同化产物在根系中积累,加大根系渗透调节能力,促进根系水分吸收。本研究中,扁蓿豆叶片可溶性糖含量在轻度和中度水分胁迫强度下不断降低,是否也是由于叶片同化产物过多在根系中积累而导致的,有待于进一步研究。本研究中,在轻度和中度水分胁迫下施入0.10 mmol/L水杨酸,重度水分胁迫下施入0.50 mmol/L水杨酸均可显著提高扁蓿豆游离脯氨酸和可溶性糖含量,与Patel和Hemantaranjian[18]用1.0和1.5 mmol/L水杨酸均提高了干旱胁迫下鹰嘴豆叶片游离脯氨酸含量及王利军等[37]用0.1 mmol/L的水杨酸显著提高了葡萄(Vitisvinifera)幼苗可溶性蛋白含量的研究结果相一致。外源水杨酸可能通过促进不溶性糖和蛋白的水解,增加细胞可溶性糖、可溶性蛋白及游离氨基酸含量,进而发挥重要的渗透调节作用[36]。
3.5 水分胁迫下水杨酸对扁蓿豆分枝期光合特性的影响
光合作用是物质生产的基本过程,植物95%以上的干物质是光合作用提供的[38]。水分胁迫对植物生长和代谢的影响是多方面的,其中对光合作用的影响尤为突出[39]。水分胁迫对植物光合作用的抑制包括气孔限制和非气孔限制2个方面,气孔限制是指干旱胁迫使气孔导度下降,CO2进入叶片受阻,从而直接影响植物的光合作用,非气孔限制是由于干旱使叶绿体结构发生变化,光合色素降解,光合电子传递系统遭到破坏,合成酶活性下降、水解酶活性上升,从而导致光合速率下降[40]。Delfine等[41]发现随着干旱胁迫强度的增加,迷迭香(Rosmarinus officinalis)、留兰香(Menthaspicata)的叶片Pn、Tr、Gs、Ci均显著降低。本研究中,随着水分胁迫强度的增加,扁蓿豆叶片Pn、Tr、Gs、Ci均显著降低,Ls显著升高,并且叶绿素含量显著增加,说明水分胁迫对扁蓿豆光合作用的抑制是气孔限制引起的。水杨酸提高逆境下植物叶片光合速率的原因有不同报道,Arfan等[42]研究发现水杨酸提高小麦叶片光合速率,是由于水杨酸提高了除叶绿素、类胡萝卜素以外的物质代谢,而非提高气孔导度。姜中珠和陈祥伟[21]发现水杨酸通过提高小叶锦鸡儿(Caraganamicrophylla)的气孔导度和蒸腾速率,进而提高了光合速率。易小林等[43]报道,0.5 mmol/L水杨酸可以保护渗透胁迫下紫御谷(Pennisetumglaucum)叶绿体膜结构,增加叶片的气孔导度,从而提高了叶片的光合速率。本研究中,在轻度和中度水分胁迫下,0.10 mmol/L水杨酸显著提高了扁蓿豆的Gs,降低了Ls,0.50 mmol/L水杨酸显著提高了重度水分胁迫下扁蓿豆的Gs,从而提高了Pn和WUE,说明水杨酸通过提高扁蓿豆的气孔导度来提高光合效率和水分利用效率。
综上可见,采用一定浓度的水杨酸对扁蓿豆进行叶面喷施,可以提高扁蓿豆的抗旱性,其原因可能是适宜浓度的水杨酸处理可以使扁蓿豆体内保持了较高的酶活性,使体内活性氧的生成量降低,抑制膜脂氧化,同时水杨酸处理促进了有机渗透调节物质的积累,维持细胞渗透压,这两方面均降低了细胞的膜透性,相应地减少了膜脂过氧化分解的产物MDA的积累,减轻了对膜结构和功能的破坏,保持了较高的叶绿素含量,从而减轻了干旱胁迫对扁蓿豆的危害。另一方面,可能是适宜浓度的水杨酸处理通过促进有机渗透调节物质的积累,增强干旱胁迫下扁蓿豆细胞渗透调节作用,从而可以维持部分气孔开放和一定的光合作用强度,从而避免或减轻光合器官受到的光抑制作用,保持扁蓿豆的继续生长。由此可见,适宜浓度的水杨酸具有维持扁蓿豆体内活性氧等代谢平衡和增强光合作用的效果,从而减轻了干旱对扁蓿豆生长的危害。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第42卷第二分册)[M].北京:科学出版社,1998:318-320.
[2] 石凤翎,王明玖,王建光.豆科牧草栽培[M].北京:中国林业出版社,2003.
[3] 韩海波,师文贵,李志勇,等.扁蓿豆的抗性研究进展[J].草业科学,2011,28(4):631-635.
[4] Fragnière C,Serrano M,Abou-Mansour E,etal.Salicylic acid and its location in response to biotic and abiotic stress[J].Febs Letters,2011,585(12):1847-1852.
[5] Yuan S,Lin H H.Role of salicylic acid in plant abiotic stress[J].Journal of Biosciences,2008,63(5-6):313-320.
[6] Vlot A C,Dempsey D M A,Clessig D F.Salicylic acid,a multifaceted hormone to combat disease[J].Annual Review Phytopathology,2009,47:177-206.
[7] Agarwal S,Sairam R K,Srivastava G C,etal.Changes in antioxidant enzymes activity and oxidative stress by abscisic acid and salicylic acid in wheat genotypes[J].Biologia Plantarum,2005,49(4):541-550.
[8] 陆晓明,谷超.水分胁迫下外源水杨酸对毛豆某些生理指标及抗旱性的影响(简报)[J].热带作物学报,2008,29(4):468-471.
[9] 刘杰,杨絮茹,周蕴薇.水杨酸浸种处理对黑麦草种子萌发及幼苗抗旱性的影响[J].草业科学,2011,28(4):582-585.
[10] Xue Y F,Liu L,Liu Z P,etal.Protective role of Ca against NaCl to xicity in Jerusalem artichoke by up regulation of antioxidant enzymes[J].Pedosphere,2008,18(6):766-774.
[11] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13] Arnon D I.Copper enzymes in isolated chloroplasts:Polyphenoloxidase inBetavulgaris[J].Plant Phsiology,1949,24(1):1-15.
[14] Kocheva K,Lambrev P,Georgiev G,etal.Evaluation of chlorophyll fluorescence and membrane injury in the leaves of barley cultivars under osmotic stress[J].Bioelectronics Chemistry,2004,63(1):121-124.
[15] Zhang X L,Zang R G,Li C Y.Population differences in physiological and morphological adaptations ofPopulusdavidianaseedlings in responseto progressive drought stress[J].Plant Science,2004,166(3):791-797.
[16] Ohashi Y,Nakayama N,Saneoka H,etal.Effects of drought stress on photosynthetic gas exchange,chlorophyll fluorescence and stem diameter of soybean plants[J].Biologia Plantarum,2006,50(1):138-141.
[17] Bidabadi S S,Mahmood M,Bahram B,etal.Influence of salicylic acid on morphological and physiological responses of banana(Musaacuminatacv.‘Berangan’,AAA)shoot tips toinvitrowater stress induced by polyethylene glycol[J].Plant Omics Journal,2012,5(1):33-39.
[18] Patel P K,Hemantaranjian A.Salicylic acid induced alteration in dry matter partiong antioxidant defence system and yield in Chickpea(CicerarietinumL.)under drought stress[J].Asian Journal of Crop Science,2012,4(3):86-102.
[19] 王旭明,张铮,史刚荣.磷营养和土壤含水量对大豆光合特性的交互影响[J].干旱地区农业研究,2010,28(5):143-148.
[20] 董明,苏德荣,刘泽良,等.干旱胁迫对阿诺红鞑靼忍冬生理指标的影响[J].西北林学院学报,2008,23(4):8-13.
[21] 姜中珠,陈祥伟.水杨酸对灌木幼苗抗旱性的影响[J].水土保持学报,2004,18(2):166-185.
[22] 高暝,李毅,种培芳,等.渗透胁迫下不同地理种源白刺的生理响应[J].草业学报,2011,20(3):99-107.
[23] 王齐,孙吉雄,安渊.水分胁迫对结缕草种群特征和生理特性的影响[J].草业学报,2009,18(2):33-38.
[24] Valentoviˇc P,LuxováM,Kolaroviˇc L,etal.Effect of osmotic stress on compatible solutes content,membrane stability and water relations in two maize cultivars[J].Plant Soil and Environment,2006,52(4):186-191.
[25] Loutfy N,El-Tayeb M A,Hassanen A M,etal.Changes in the water status and osmotic solute contents in response to drought and salicylic acid treatments in four different cultivars of wheat(Triticumaestivum)[J].Journal of Plant Research,2012,125(1):173-184.
[26] 蔡建一,马清,周向睿,等.Na+在霸王适应渗透胁迫中的生理作用[J].草业学报,2011,22(1):89-95.
[27] 孔德政,于红芳,李永华,等.干旱胁迫对不同品种菊花叶片光合生理特性的影响[J].西北农林科技大学学报(自然科学版),2010,38(11):103-108.
[28] Wu Q S,Zou Y N,Xia R X.Effects of water stress and arbuscular mycorrhizal fungion reactive oxygen metabolism and antioxidant production by citrus(Citrustangerine)roots[J].European Journal of Soil Biology,2006,42(3):166-172.
[29] 王贺正,马均,李旭毅,等.水分胁迫对水稻结实期活性氧产生和保护系统的影响[J].中国农业科学,2007,40(7):1379-1387.
[30] 孙歆,曾富春,胡攀.水分胁迫下水杨酸对大麦幼苗抗氧化能力的影响[J].四川农业大学学报,2011,29(2):160-163.
[31] Ahmad I,Khaliq T,Ahmad A,etal.Effect of seed priming with ascorbic acid salicylic acid and hydrogen peroxide on emergence,vigor and antioxidant activities of maize[J].African Journal of Biotechnology,2012,11(5):1127-1132.
[32] Agarwal S,Sairam R K,Srivastava G C,etal.Role of ABA,salicylic acid,Calcium and hydrogen peroxide on antioxidant enzymes induction in wheat seedlings[J].Plant Science,2005,169(3):559-570.
[33] 邱真静,李毅,种培芳.PEG胁迫对不同地理种源沙拐枣生理特性的影响[J].草业学报,2011,20(3):233-238.
[34] 杨鑫光,傅华,牛得草.干旱胁迫下幼苗霸王的生理响应[J].草业学报,2007,16(5):107-112.
[35] 李树华,许兴,米海莉,等.水分胁迫对牛心朴子植物生长及渗透调节物质积累的影响[J].西北植物学报,2003,23(4):592-596.
[36] Shakirova F M,Sakhabutdinova A R,Bezrukova M V,etal.Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity[J].Plant Science,2003,164(3):317-322.
[37] 王利军,战吉成,黄卫东.水杨酸与植物抗逆性[J].植物生理学通讯,2002,38(6):619-624.
[38] 闫艳红,杨文钰,张新全,等.施氮量对套作大豆花后光合特性、干物质积累及产量的影响[J].草业学报,2011,20(3):108-114.
[39] 付秋实,李红岭,崔健,等.水分胁迫对辣椒光合作用及相关生理特性的影响[J].中国农业科学,2009,42(5):1859-1866.
[40] 刘世秋,张振文,惠竹梅,等.干旱胁迫对酿酒葡萄赤霞珠光合特性的影响[J].干旱地区农业研究,2008,26(5):169-172.
[41] Delfine S,Loreto F,Pinelli P,etal.Isoprenoids content and photosynthetic limitations in rosemary and spearmint plants under water stress[J].Agriculture Ecosystems & Environment,2005,106(2):243-252.
[42] Arfan M,Athar H R,Ashraf M.Does exogenous application of salicylic acid through the rooting medium modulate growth and photosynthetic capacity in two differently adapted spring wheat cultivars under salt stress[J].Journal of Plant Physiology,2007,164(6):685-694.
[43] 易小林,杨丙贤,宗学凤,等.信号分子水杨酸减缓干旱胁迫对紫御谷光合和膜脂过氧化的副效应[J].生态学报,2011,31(1):67-74.
