基于普鲁士蓝修饰二氧化硅球腔阵列的葡萄糖传感器制备及应用
2012-03-27孙磊狄俊伟尹凡姚甜沈菁宗水珍
孙磊,狄俊伟,尹凡,姚甜,沈菁,宗水珍
(1.苏州大学材料与化学化工学部,江苏苏州 215123;2.江苏省新型功能材料重点建设实验室,江苏常熟 215500;3.常熟理工学院化学与材料工程学院,江苏常熟 215500)
基于普鲁士蓝修饰二氧化硅球腔阵列的葡萄糖传感器制备及应用
孙磊1,3,狄俊伟1,尹凡2,姚甜3,沈菁3,宗水珍3
(1.苏州大学材料与化学化工学部,江苏苏州 215123;2.江苏省新型功能材料重点建设实验室,江苏常熟 215500;3.常熟理工学院化学与材料工程学院,江苏常熟 215500)
利用Langmuir-Blodgett技术和sol-gel法在氧化铟锡(ITO)电极上构建二氧化硅(SiO2)球腔微电极阵列.在此球腔微电极阵列上电沉积普鲁士蓝膜(PB),用于过氧化氢检测,并采用滴涂法将葡萄糖氧化酶(GOD)直接固定于PB/SiO2球腔微电极阵列上制得葡萄糖传感器(酶电极),酶电极对葡萄糖电流响应结果表明:葡萄糖浓度在4.7×10-6mol/L~3.8×10-3mol/L范围内呈线性关系,其检出限为1.35×10-6mol/L,该酶电极不受抗坏血酸、尿酸等电活性物质的干扰,稳定性较好.
二氧化硅球腔;微电极阵列;普鲁士蓝;过氧化氢;葡萄糖传感器
1 引言
糖尿病是全世界的三大高发病之一,目前患病人数已接近5000万.是否患有糖尿病主要是根据病人血液中葡萄糖含量的水平来判断的,如何快速、准确、稳定地测试血液中葡萄糖浓度是研究的焦点.相对于其他测试血糖的方法,葡萄糖酶电极传感器具有选择性和灵敏度高,仪器装置简单、使用方便等优点.酶传感器是生物传感器领域中研究最多、且最灵敏的一种类型.最早的生物传感器就是葡萄糖酶生物传感器[1].
由于微电极具有高传质速率、高电流密度、高信噪比、极小时间常数等优点,可有效降低电化学检测下限,已成为电化学研究的热点.微电极阵列不仅保持了微电极的电化学特性,而且可有效放大响应电流,可以在常规仪器上获得满意的电化学信号,因而受到越来越多的研究者关注.其中微/纳米有序多孔球腔阵列不仅具有微电极的特点、良好的热稳定性和化学稳定性,其特有的网状“蜂窝”结构还具有显著的量子尺寸效应和表面效应[2],被广泛应用在生物传感器上.
普鲁士蓝是一种常见的六氰合铁酸盐,由于其对H2O2的高灵敏的电催化作用而在生物电化学领域受到关注,被称为“人工过氧化物酶”.与天然酶相比较,其化学可逆性优良、价格便宜、容易制备、稳定性好、保存时间长、抗干扰与耐热能力强.利用PB对H2O2独特的电催化还原作用,与各种氧化酶结合,可以制成高灵敏度和高选择性的生物传感器.本文在氧化铟锡(ITO)电极上采用溶胶-凝胶法制备二氧化硅(SiO2)球腔微电极阵列,利用电沉积法制备普鲁士蓝二氧化硅膜(PB/SiO2)球腔阵列/ITO电极,并研究其对双氧水(H2O2)的电催化性能,再固定葡萄糖氧化酶(GOD)来制备葡萄糖酶电极,研究其对葡萄糖的电催化性能.实验结果表明,此修饰电极能够很好地保持酶的电化学活性,并且对葡萄糖具有快速灵敏的电催化响应.
2 实验部分
2.1 仪器与试剂
Langmuir槽(612D型,英国NIMA),CHI660c电化学工作站(上海辰华仪器有限公司),2xz-2型旋片式真空泵(上海仪表集团供销公司);饱和甘汞电极为参比电极,铂片(2×7 mm)电极为辅助电极,修饰的ITO电极阵列为工作电极;AL204电子天平(上海梅特勒-托利多仪器有限公司);PHS-3C精密pH计(上海精密科学有限公司);KQ-100B型超声波清洗器(昆山市超声仪器有限公司);DF-101S集热式恒温磁力搅拌器(巩义市英峪予华仪器厂).
将葡萄糖氧化酶(上海国药集团化学试剂有限公司)溶于pH7.0的PBS溶液中,配成3 mg/mL溶液.
0.06mol/L磷酸盐缓冲液(PBS)由KH2PO4和K2HPO4按不同比例配制,磷酸二氢钾(A.R.天津市大茂化学试剂厂),磷酸氢二钾(A.R.天津市大茂化学试剂厂).
0.2 mmol/L抗坏血酸、0.6 mmol/L尿酸、0.10 mol/L的葡萄糖、无水乙醇、丙酮、正硅酸乙酯(TEOS)、30% H2O2、NaOH、乙酸乙酯、氯化钾、三氯化铁、铁氰化钾均为分析纯(A.R.),购于上海国药集团化学试剂有限公司.
ITO玻璃(100 Ω)购于苏州板硝子电子有限公司;N2为钢瓶装普氮.实验中所用水均为二次蒸馏水.
2.2 实验方法
2.2.1 PS小球模板(PS/ITO)的制备
PS小球模板制备方法同文献[3].
2.2.2 二氧化硅球腔阵列(SiO2/ITO)的制备
二氧化硅球腔阵列制备同文献[4].
2.2.3 修饰电极的制备
2.2.3.1 PB修饰SiO2球腔微电极(PB/SiO2/ITO)的制备
将SiO2球腔阵列/ITO电极置于2.5 mmol/L FeCl3+2.5 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.01 mol/L HCl的混合溶液中,于0.4 V(SCE)恒电位电沉积120 s,晾干得到PB/SiO2/ITO电极,未覆盖球腔阵列的ITO电极表面涂覆石蜡,以避免裸露ITO电极对阵列电极电化学测试的影响.
2.2.3.2 酶电极(GOD/PB/SiO2/ITO)的制备
将3 mg GOD(葡萄糖氧化酶)溶于1 ml PBS(0.06 mol/L,pH7.0)溶液中,配成3 mg/mL GOD溶液,取20 μL GOD溶液直接滴加在PB/SiO2/ITO球腔阵列表面,密封保存,于4℃过夜,使其牢固吸附在电极表面.
2.2.4 电化学测试方法
在CHI660c电化学工作站上进行测定.采用三电极电化学体系,以饱和甘汞电极(SCE)为参比电极,铂片(2×7 mm)电极为辅助电极,PB/SiO2/ITO和GOD/PB/SiO2/ITO修饰电极分别为工作电极(0.5×0.4 cm).运用控制电位电解库仑法、循环伏安法、电流-时间曲线等方法进行电化学测试.
3 结果与讨论
3.1 PB/SiO2球腔阵列/ITO电极的电化学特性
从图1可看出,SiO2球腔阵列/ITO电极在0.06 mol/L的PBS(pH7.0)溶液中没有电化学响应,PB/SiO2球腔阵列/ITO电极在此溶液中具有一对准可逆的氧化-还原峰,氧化峰电位为0.086 V,还原峰电位为0.168 V,峰间距为82 mV,式量电位为0.127 V,这与文献报道[5]的PB膜式量电位相似,表明其电化学响应来自PB中的[Fe(CN)6]3-和[Fe(CN)6]4-,PB修饰在SiO2球腔阵列/ITO电极表面,且保持有较好的电化学响应.插图是PB/ SiO2球腔阵列/ITO电极在0.06 mol/L PBS中不同扫描速率下的CV图,说明随着扫描速率的增大,氧化还原峰电流也随之增加,峰电位略有移动,在40 mV/s~400 mV/s范围内,峰电流与扫速成正比,这表明电化学反应为表面控制,证明PB膜已经成功固定在球腔内部[6].
3.2 PB/SiO2球腔阵列/ITO电极对H2O2的电催化
图2是PB/SiO2球腔阵列/ITO电极在0.06 mol/L PBS(pH7.0)溶液中对H2O2的电催化效应,当在溶液中加入H2O2后,还原峰峰电流明显增加,氧化峰峰电流略有减小,表明修饰在SiO2球腔微电极阵列表面的PB对H2O2的还原具有明显的电催化响应,可以作为H2O2的电化学传感器.
3.3 GOD/PB/SiO2球腔阵列/ITO电极(葡萄糖传感器)电化学特性
如图3所示,GOD/PB/SiO2球腔阵列/ITO电极在0.06 mol/L的PBS(pH7.0)溶液中加入葡萄糖后的电催化效应.当在溶液中加入葡萄糖后,还原峰峰电流明显增加,氧化峰峰电流略有减小,表现出明显的电催化行为.这表明GOD/PB/SiO2球腔阵列/ITO修饰电极在加入葡萄糖后发生化学反应产生的H2O2与PB发生了电化学响应,因此可以作为检测葡萄糖浓度的电化学传感器[7].
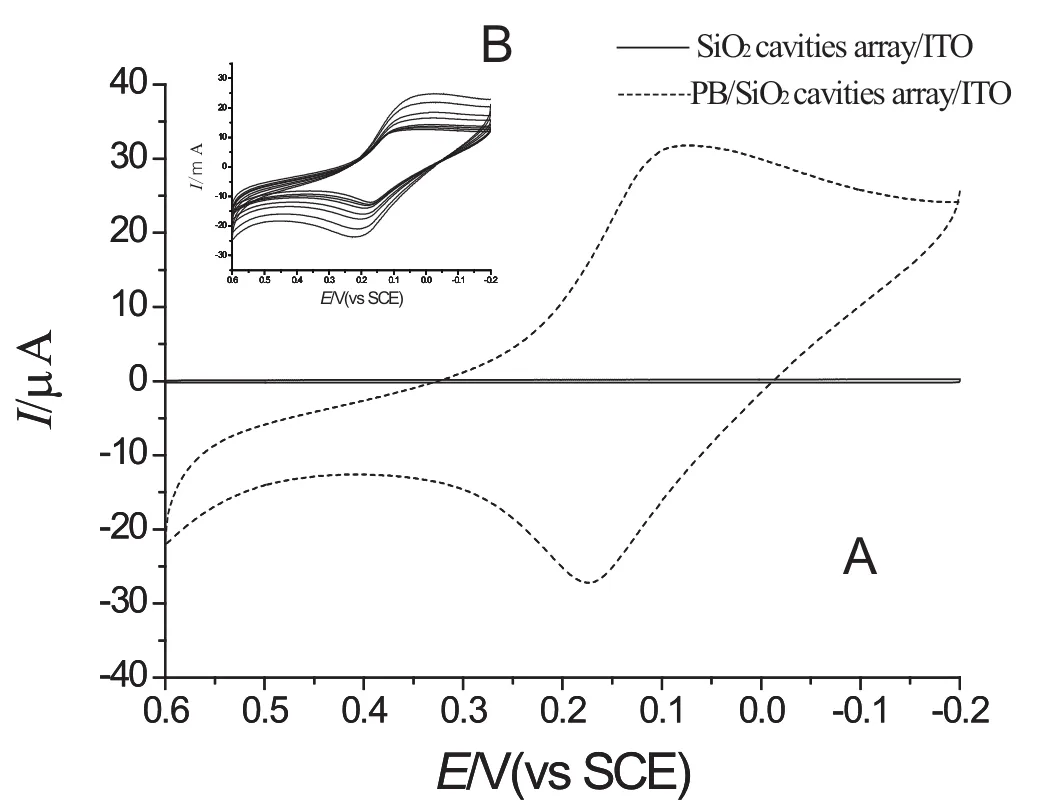
图1 PB/SiO2球腔阵列/ITO、SiO2球腔阵列/ITO电极在0.06 mol/L PBS(pH7.0扫描速率为100 mV/s)的CV曲线
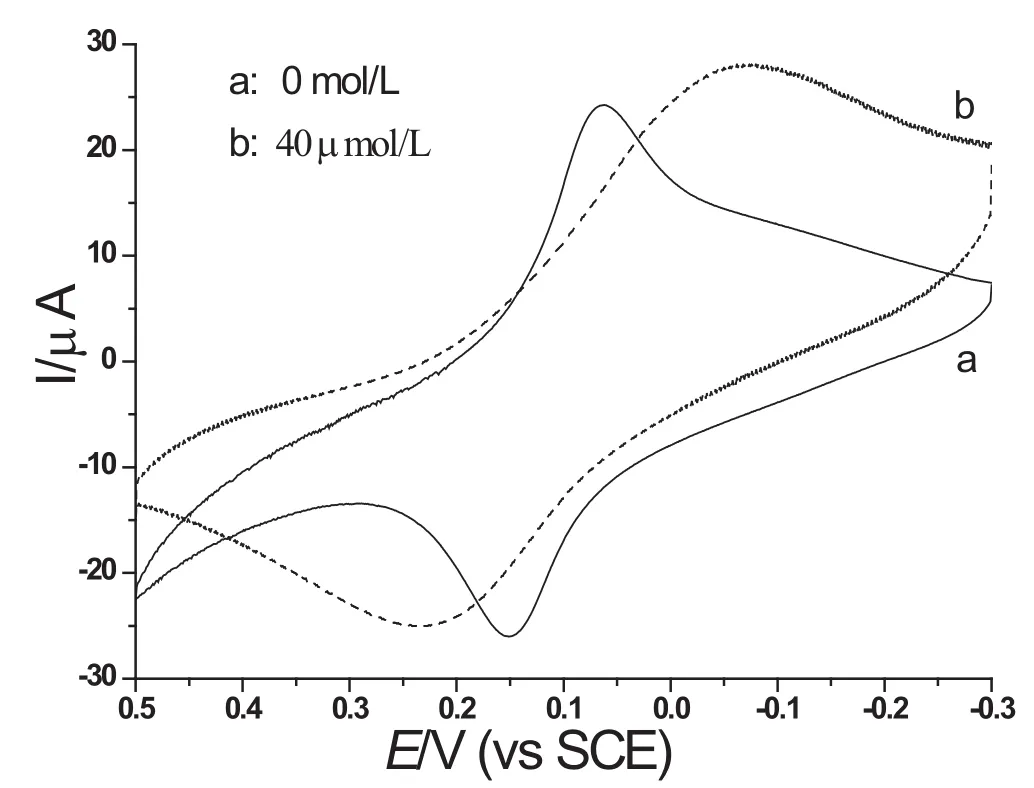
图2 PB/SiO2球腔阵列/ITO电极在0.06 mol/L PBS(pH7.0)溶液中加入不同浓度H2O2的CV图(扫描速率100 mV/s)

图3 GOD/PB/SiO2球腔阵列/ITO电极在0.06 mol/L PBS(pH7.0)溶液中连续加入0.2 mmol/L的葡萄糖的CV图(扫描速率100 mV/s)
3.4 葡萄糖传感器工作条件的优化
从图4可以看出在不同的pH值下GOD/PB/SiO2球腔阵列/ITO修饰电极电化学活性强弱的变化.GOD/ PB/SiO2球腔阵列/ITO修饰电极在pH值为5.0时,峰电流降至pH值6.0时的92%;当pH值为7.0时,峰电流降低至pH值6.0时的95%;当pH值为8.0时,峰电流降低至pH值6.0时的65%,pH值为9.0时,峰电流逐渐减小,直到消失最小.PB膜通常在酸性条件下比较稳定,在中性和弱碱性条件下会发生溶解.在这个实验中,PB膜固定在SiO2球腔内部,SiO2球腔表面存在的一些羟基对PB膜存在保护作用,酶覆盖在PB膜的表面,进一步保护了PB膜,所以电极在中性条件下稳定性仍然较高,而随着pH值的增大,进入碱性环境,PB膜逐渐溶解,电流响应有所改小,电化学活性相应有所减弱.
3.5 葡萄糖传感器的响应性能
图5是连续加入等浓度的葡萄糖时GOD/PB/SiO2球腔阵列/ITO电极电流响应曲线.插图是浓度与电流的线性校正曲线.由图知,加入葡萄糖后响应电流随即增大,约在6 s内达到平衡,说明该电极对加入的葡萄糖响应快速.从图5中分析得到葡萄糖浓度在4.7×10-6mol/L~3.8× 10-3mol/L内呈线性关系,线性回归方程为:Ipa(μA)=-0.00839+0.5856C(mmol/L),R=0.998,其检出限为1.35×10-6mol/L(S/N=3).以此方法制备的GOD/PB/SiO2球腔阵列/ITO电极对葡萄糖响应迅速,反应灵敏,具有较低的检测下限.这说明由于二氧化硅特有的球腔结构,使双氧水不容易向远处扩散,电极附近双氧水浓度较高;另外二氧化硅的蜂窝状结构,使反应的比表面积增大,增加了葡萄糖氧化酶的吸附量,从而降低了检测下限.
3.6 GOD/PB/SiO2球腔阵列/ITO电极的稳定性和重现性
将GOD/PB/SiO2球腔阵列/ITO电极置于0.06 mol/L PBS(pH7.0)缓冲溶液中,选择扫描速率为100 mV/s,连续100圈CV扫描,考察该电极的稳定性.结果表明:经过100次扫描后的CV图中峰电位、峰间距几乎没有变化,峰电流下降12.3%,表明该电极稳定性较好.对所制备的5支电极对1 mmol/L的葡萄糖响应的RSD 为3.8%,表明重现性实验结果也较好.将该电极置于常温中放置7天后使用,响应电流为初始的95.0%,说明该电极稳定性较好,具有较长的使用寿命.由于溶胶-凝胶的化学过程在温和条件下进行,pH值近于中性,处理温度低,因此既提高了电极中酶被固定化的效果,又维持了酶的活性,此外,溶胶-凝胶技术的修饰使传感器中酶不易渗漏流失,提高了长期储存的稳定性.
3.7 GOD/PB/SiO2球腔阵列/ITO电极选择性能试验
由于本实验选用低的测定电位,因此大大提高了酶电极的选择性.当在1 mmol/L的葡萄糖溶液中测得稳定的响应电流后,再加入0.6 mmol/L尿酸,200 s后再加0.2 mmol/L抗坏血酸,响应电流几乎不变.这一实验结果表明:该酶电极能很好地消除这些活性物质的干扰,选择性能较好.
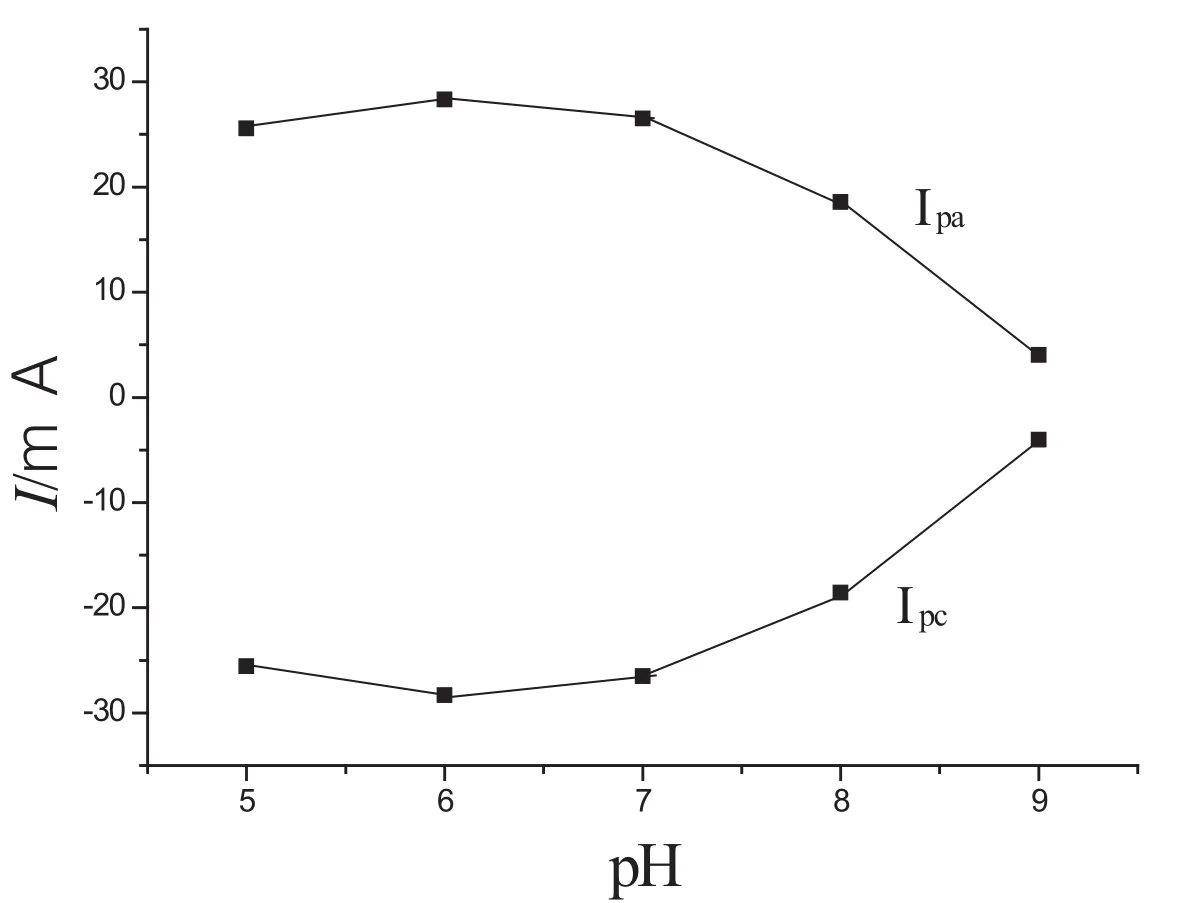
图4 pH值对传感器响应的影响
4 结论
本文采用简单易行的方法制备了一种葡萄糖传感器,由于普鲁士蓝具有稳定性高、电化学可逆性好、价格低廉、容易制备等特点,而SiO2球腔的半包含性和其特殊的“蜂窝”结构使普鲁士蓝能够更多的负载在电极上并保持较好的生物活性.实验证明,该传感器对葡萄糖检测具有检测下限低、选择性高和稳定性好的特点,同时还具备响应速度快、制作简单等优点,因此,该传感器具有较好的实用性,是一种很有应用前景的葡萄糖电化学传感器.
[1]Sha Xian-zheng,Gough DA.Simulation of an implantable enzyme-based glucose sensor[J].Chinese Journal of Biom edical Engineering,2004,23(3):236-242,258.
[2]Holland T B,Blanford C F,Do T.Syntesis of highly ordered,three-dimensional,macroporous structures of amorps or crystalline inorganic oxides,phosphates,and hybrid composites[J].Chem Mater,1999,11(2):795-805.
[3]池晓雷,陆婷,汪学英,等.微电极的制备及电化学性质研究[J].常熟理工学院学报,2010,24(2):52-55.
[4]周丽娟,尹凡,周宇.基于二氧化硅球腔微电极阵列的过氧化氢生物传感器制备[J].分析化学,2011,39(9):1313-1317.
[5]付萍,袁若,柴雅琴.基于壳聚糖-纳米金/纳米普鲁士蓝/L-半胱氨酸修饰的葡萄糖传感器的研究[J].化学学报,2008,66 (15):1796-1802.
[6]李彤,姚子华.普鲁士蓝修饰电极结合硅溶胶-凝胶技术制备高灵敏葡萄糖传感器[J].分析化学,2004,32(2):230-237.
[7]陈昌国,董海峰,卢惠婷.普鲁士蓝修饰碳糊电极测定过氧化氢的研究[J].分析科学学报,2009,25(2):232-234.
Fabrication and Application of Glucose Sensor Based on Prussian Blue Modified Silicon Dioxide Cavities Array
SUN Lei1,3,DI Jun-Wei1,YIN Fan2,YAO Tian3,SHEN Qing3,ZONG Shui-Zhen3
(1.Colllege of Chemistry,Chemical Engineering and Materials Science of Soochow University,Suzhou 215123,China; 2.Jiangsu Laboratory of Advanced Functional Materials,Changshu 215500,China; 3.School of Chemistry and Material Engineering,Changshu Institute of Technology,Changshu 215500,China)
The silicon dioxide(SiO2)cavities microelectrode array was fabricated on the indium tin oxide(ITO) electrode,which was constructed by the Langmuir-Blodgett(LB)technology and sol-gel technology.The Prussian Blue(PB)film was fabricated on the SiO2cavities array by electrodeposition technique,which was used to construct electrochemical sensor for the detection of hydrogen dioxide(H2O2).A glucose biosensor was obtained by drop-coating glucose oxidase(GOD)in PB/SiO2cavities array/ITO electrode directly.The resulting biosensor was highly sensitive to glucose with a linear calibration plot in the concentration range of 4.7×10-6-3.8×10-3mol/L glucose,the detection limit 1.35×10-6mol/L glucose(S/N=3).It is free of interference by ascorbic acid,uric acid and other active substances.and also have good stability.
silicon dioxide cavities;microelectrode array;Prussian blue;hydrogen dioxide;glucose sensor
O657
A
1008-2794(2012)10-0060-05
2012-09-01
孙磊(1977—),男,浙江绍兴人,实验师,苏州大学硕士研究生,研究方向:电化学.
