周期性张应力作用下成骨样细胞MG-63中c-fos基因和丝状肌动蛋白相互关系的研究
2012-03-24堵安庆王羽赵森李炜鹏赵志河
堵安庆 王羽 赵森 李炜鹏 赵志河
(1.四川大学华西口腔医院 正畸科;2.口腔疾病研究国家重点实验室,四川大学,成都610041;3.中山大学光华口腔医学院·附属口腔医院 正畸科;4.广东省口腔医学重点实验室,广州510055)
颌面部骨组织的生长改建受口腔应力环境的影响,例如:偏侧咀嚼可使常用侧下颌骨强壮、废用侧变弱,义齿修复可延缓牙槽骨吸收,正畸力可影响牙移动等。因此,研究骨细胞在应力作用下的反应对了解颌面部骨组织的生长改建机制具有重要意义。c-fos基因是即刻早期基因家族中的重要成员,能对各种细胞外刺激迅速作出反应。有研究[1]指出:c-fos基因是骨样细胞对机械应力刺激反应的标记物。在正常细胞中,该基因的转录和表达水平都较低,而在应力等刺激因素作用下表达增高,被视为细胞力学信号转导过程中的重要信号分子。另有研究[2-3]表明:细胞骨架参与了力学信号转导过程中c-fos基因的表达,是应力诱导c-fos基因高表达的一个重要环节。对于成骨细胞c-fos基因和细胞骨架丝状肌动蛋白(filamentous actin,F-actin)在周期性张应力作用下相互关系的研究还很罕见,本实验拟从此方面进行探讨,以期初步了解骨细胞在应力作用下的应答反应机理。
1 材料和方法
1.1 成骨样细胞MG-63的培养
将MG-63细胞按每毫升1×104个细胞的密度接种于聚苯乙烯培养瓶中,加入含10%胎牛血清的DMEM培养基,置于37 ℃、5%CO2孵箱中培养,隔天换液,待细胞生长达80%融合时,按1∶1的比例传代培养。
1.2 MG-63细胞加力
参照本课题组前期的研究方法[4]对MG-63细胞加力。加力板由聚苯乙烯培养瓶切割而成,大小为4 cm×8 cm,厚度为1.15 mm。要求加力板周缘平滑、四角圆钝,以避免加力过程中出现应力集中。
采用传代后的细胞,消化离心后按每毫升1×105个细胞的密度接种于加力板中1/3区域(实验组和对照组同时种板),每板接种1 mL细胞悬液(即每板含1×105个细胞),置入培养皿中,于37 ℃孵箱中培养。培养4 h后,镜下观察待细胞完全贴壁后,加入20 mL培养基继续培养。加载前24 h,更换为无血清培养基,以同步化细胞周期。
采用Forcel四点弯曲加力装置,对接种在加力板上的MG-63细胞施加周期性张应力,频率为0.5 Hz,细胞应变为2 000 μstrain,按3、6、12 h不同时间段加力,使细胞在平行于贴壁方向上发生单轴牵张应变,每组重复3次。对照组不加力。每组3个样本均来自同一瓶培养细胞,以相同的密度和细胞量接种,除应力影响因素外,其他条件基本一致。
1.3 c-fos mRNA的荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测
用Trizol提取各组细胞的总RNA。荧光定量PCR扩增前,随机抽取3个实验样本的总RNA各5 μL,1%琼脂糖凝胶电泳30 min,观察28S和18S rRNA条带的亮度,测量260 nm和280 nm处的光密度(optical density,OD)值,计算二者的比值,观察有机物的污染情况。将RNA逆转录成cDNA后行荧光定量PCR检测,检测MG-63细胞在不同加力时间内c-fos mRNA的表达情况。
荧光定量PCR具体步骤如下。1)预混合下列溶液于PCR反应管中,包括10×buffer(不含Mg2+)3 μL、MgCl2(25 mmol·L-1)3 μL、dNTP(25 mmol·L-1)0.36 μL、正向引物(10 μmol·L-1)1 μL、反向引物(10 μmol·L-1)1 μL、SYBR Green Ⅰ核酸凝胶染液(10 μmol·L-1)2 μL、Taq聚合酶(5 U·μL-1)0.3 μL、ddH2O 17.34 μL、cDNA模板2 μL,总体积30 μL。2)反应体系在FTC-2000型荧光定量PCR仪上进行,扩增条件如下:94 ℃2 min;94 ℃20 s、52 ℃20 s、72 ℃30 s、80 ℃20 s,共45个循环。3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。扩增反应结束后,根据扩增动力学曲线确定每个样品管中荧光强度增加到阈值时的扩增循环数Ct。用2-ΔΔCt[5]计算各时间点相对于0 h基因表达的比值。cfos和GAPDH的引物序列如下。c-fos正向引物:5’-gcgcagagcattggcagga-3’,反向引物:5’-cctcagcttggcaatct-3’;GAPDH正向引物:5’-gggtgtgaaccatgagaagt-3’,反向引物:5’-ccaaagttgtcatggatgacct-3’。
1.4 F-actin的激光扫描共聚焦检测
选取c-fos基因表达高峰的时间点3 h为实验组,以0 h组样本为对照,进行F-actin和二脒基苯基吲哚(diamidino-phenyl-indole,DAPI)的免疫荧光双染色,步骤如下:1)3.7%多聚甲醛固定样本15 min,PBS漂洗3次,每次5 min,5%牛血清白蛋白(bovine serum albumin,BSA)37 ℃封闭30 min;2)滴加5 μg·mL-1的F-actin染色剂鬼笔环肽-异硫氰酸荧光素(phalloidinfluorescein isothiocyanate,phalloidin-FITC)(Sigma公司,美国)于加力板中1/3区域,37 ℃湿盒内避光孵育60 min,PBS漂洗3次,每次5 min,避光保存;3)滴加5 μg·mL-1的细胞核染色剂DAPI于加力板中1/3区域,室温避光染色5 min;PBS漂洗3次,每次5 min,避光保存。染色完成后在激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)(Leica公司,德国,TCS SP2型)下观察,打开激光发生器扫描样本,所有检测按同样的系统设置来完成。FITC和DAPI的激发光波长分别为495 nm和370 nm,发射光波长分别为520 nm和455 nm;绿色染色为F-actin,蓝色染色为细胞核。检测后应用Image J 1.44e图像处理软件随机对每一加力板上的6个细胞进行图像分析,测量F-actin的荧光强度(单位面积的荧光颗粒数),每组重复测量3次。
1.5 细胞松弛素D对c-fos基因表达和F-actin的影响
将细胞接种在加力板上,培养48 h并同步化后,用含有微丝细胞骨架解聚剂细胞松弛素D(cytochalasin D)的DMEM培养基(质量浓度为0.1 μg·mL-1)孵育1 h后再对细胞施加周期性张应力,频率为0.5 Hz,细胞应变为2 000 μstrain,时间为3 h。对照组为相同时间的单纯加力组。加力后收集样本,进行c-fos mRNA荧光定量PCR检测和F-actin及DAPI免疫荧光双染色,观察二者的表达变化。
1.6 统计分析
用SPSS 12.0统计软件处理数据。3组及3组以上的样本数据比较采用单因素方差分析,如差异有统计学意义,再行SNK检验;两组数据间的比较采用配对t检验,检验水准为双侧α=0.05。
2 结果
2.1 MG-63细胞加力和RNA提取
加力3、6、12 h后,收集各组细胞的培养液,镜下观察均未见细胞,证明加力没有造成细胞的死亡和脱落。各组细胞总RNA样品条带清晰,28S rRNA的条带亮度大于18S,OD260nm/OD280nm值为1.95,表明RNA提取质量良好,没有蛋白质等有机物的污染。
2.2 周期性张应力作用下MG-63细胞中c-fos mRNA的表达变化
在2 000 μstrain周期性张应力作用下,MG-63细胞中c-fos mRNA表达的情况见图1。由图1可见:MG-63细胞中c-fos mRNA表达增加,至3 h达到峰值,然后逐渐下降,到12 h降至正常水平。经统计学检验,c-fos mRNA在3 h的表达明显高于0 h(P<0.01),6 h的表达也高于0 h(P<0.05),12 h的表达与0 h的差异则无统计学意义(P>0.05)。这表明周期性张应力可以诱导c-fos mRNA出现短暂、一过性的表达。选取c-fos基因表达高峰的时间点3 h用于后续实验。
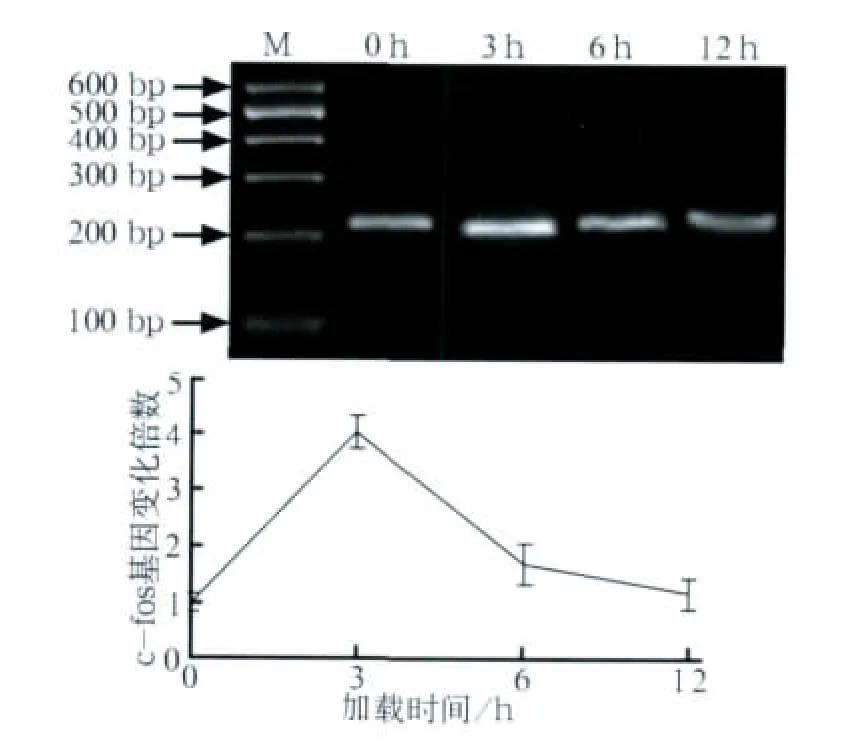
图1 周期性张应力作用下,MG-63细胞中c-fos mRNA的变化Fig 1 The change of c-fos mRNA in MG-63 osteoblasts under cyclic tensile stress
2.3 周期性张应力作用下MG-63细胞中F-actin的表达情况
F-actin的激光扫描共聚焦观察结果见图2:0 h组可见F-actin包绕细胞核排列,细胞核区有少量分布,呈染色均匀一致的膜状结构,无明显的方向性(图2A);3 h组F-actin在细胞内聚集形成应力纤维,细胞内可见明显的非极性并行排列的应力纤维,细胞体牵拉,边缘粗糙不规整,出现锯齿样结构(图2B)。F-actin的平均荧光强度值见图3:经配对t检验分析,两个时间点F-actin的荧光强度的差异无统计学意义(P>0.05)。结合图2、3可以看出:随着应力的加载,F-actin微丝蛋白的量并没有改变,只是出现了结构上的重组。
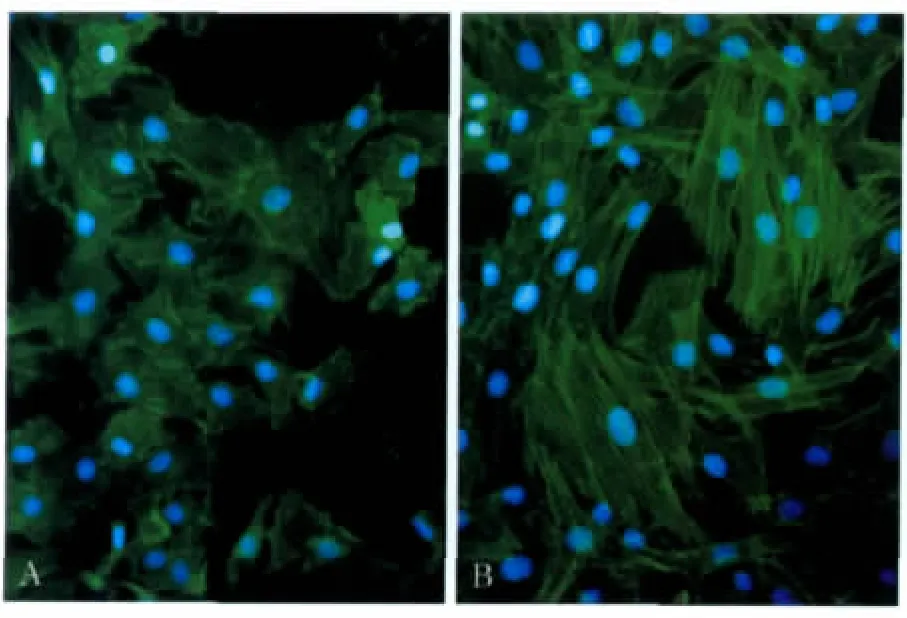
图2 MG-63细胞中F-actin的表达 LSCM×400Fig 2 The expression of F-actin in MG-63 osteoblastsLSCM×400
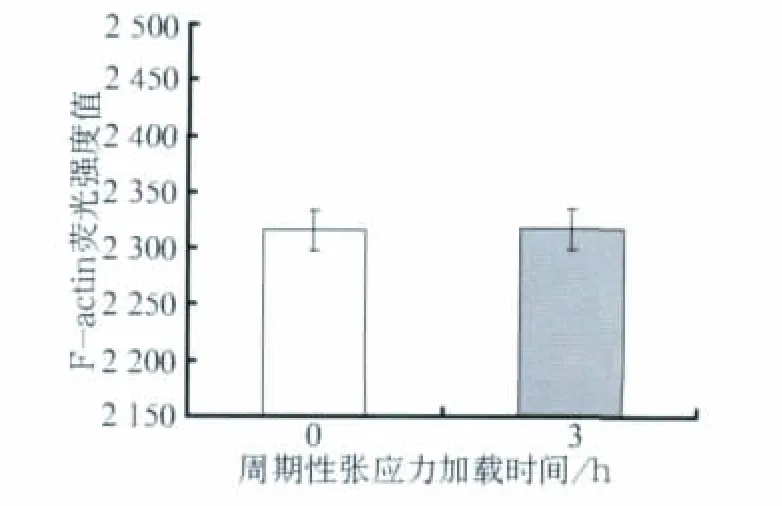
图3 MG-63细胞中F-actin的平均荧光强度Fig 3 The mean fluorescence intensity values of F-actin in MG-63 osteoblasts
2.4 细胞松弛素D对c-fos mRNA和F-actin表达的影响
加入细胞松弛素D后,镜下观察可见细胞仍然贴壁生长,符合后续实验的加力要求。c-fos mRNA表达的变化见图4:与单纯加力组相比,加入细胞松弛素D后c-fos mRNA的表达明显降低(P<0.01),提示细胞松弛素D对张应力诱导的c-fos mRNA表达有抑制作用。激光扫描共聚焦显微镜下观察可见:经细胞松弛素D处理后的MG-63细胞体内形成的应力纤维明显减少(图5)。F-actin的荧光强度值见图6,可见经细胞松弛素D处理后,F-actin的荧光强度明显降低(P<0.01)。

图4 周期性张应力作用下加入细胞松弛素D对c-fos mRNA表达的影响Fig 4 The change of c-fos mRNA expression after treated by cytochalasin D under cyclic tensile stress
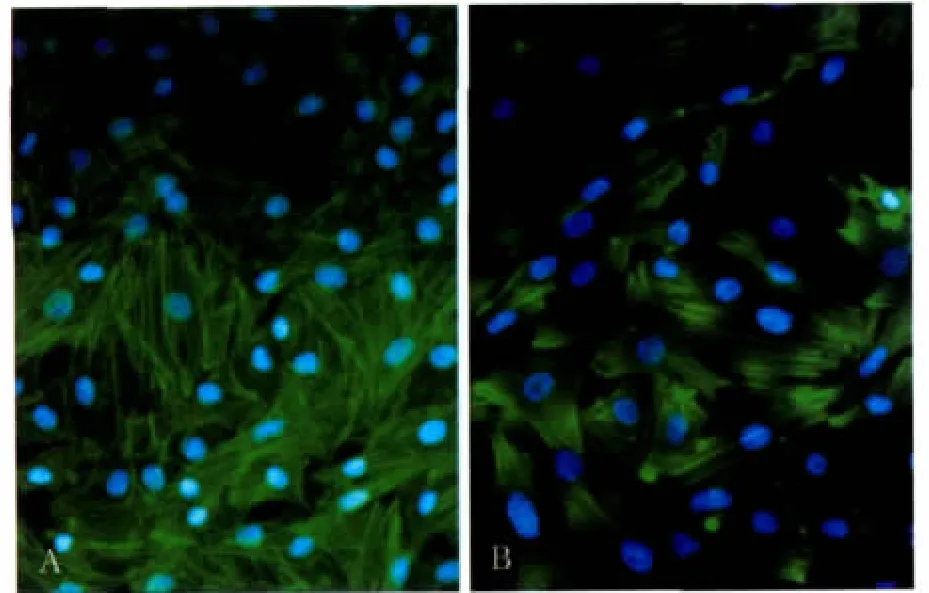
图5 细胞松弛素D对F-actin表达的影响 LSCM×400Fig 5 The change of F-actin expression after treated by cytochalasin D LSCM×400
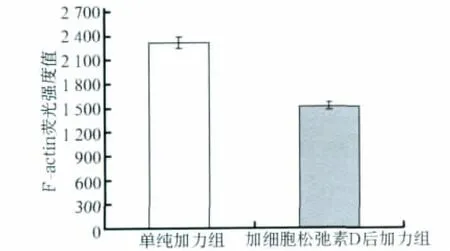
图6 加入细胞松弛素D后F-actin的平均荧光强度Fig 6 The mean fluorescence intensity values of F-actin after treated by cytochalasin D
3 讨论
本实验发现:在周期性张应力作用下,MG-63细胞中c-fos mRNA的表达增加,至3 h达到峰值,随后逐渐下降,12 h降至正常水平。该结果与Kletsas等[1]的研究结果一致。Kletsas等[1]研究表明:周期性应力加载0.5 h后c-fos出现表达,至3 h达到高峰,随后逐渐下降,12 h降至正常水平。这表明周期性张应力可以诱导c-fos mRNA呈现短暂、一过性的表达。
本研究结果显示:在应力加载作用下,F-actin微丝蛋白的量并没有明显变化,只是出现了结构上的重组。从量上来说,F-actin似乎是稳定的,并没有随着应力的加载而出现动态改变。这与其他学者[6-7]的研究结果不同。但Knight等[8]的研究也得出了与本实验类似的结果。Knight等[8]认为:在压应力作用下,与F-actin结合的蛋白和钙调节蛋白被激活,引起Factin重组;发生重组时,没有出现F-actin基因表达的变化,表明重组的是既有的F-actin。还有研究[9-10]证实:力学刺激是通过F-actin的重组来作用于细胞的。重组暂时改变了细胞的力学特性,通过这种反馈机制,细胞得以受到生理负荷的调节。本实验中,F-actin的重组使MG-63细胞发生形变,可见细胞受到了力学载荷的调节。
细胞松弛素D是微丝细胞骨架解聚剂,其作用机制是增加游离微丝的片段并阻止微丝重组[11]。加入细胞松弛素D后,细胞内F-actin的重组受抑制,形成的应力纤维明显减少,同时荧光强度降低,说明F-actin的量减少;与此同时,c-fos mRNA表达明显降低。Knight等[8]指出:F-actin的重组很可能参与了应力诱导c-fos基因的高表达。Pavalko等[2]发现:流体剪切力作用1 h后即能增加细胞中c-fos的表达,而导致这种现象产生的机制是应力作用下细胞骨架的重组。有研究[12]指出:整合素、微丝细胞骨架、膜受体蛋白G蛋白能作用于力学信号转导通路,抑制上述三方的任意之一均能抑制即刻早期基因的表达。张应力作用下,F-actin的表达和重组受抑制的同时c-fos基因的表达也明显降低,证实了F-actin重组是应力诱导c-fos基因高表达的一个重要环节。
由本研究结果可见:在应力加载作用下,F-actin微丝蛋白的量并没有发生变化,只是出现了结构上的重组,而且重组的是既有的F-actin;F-actin重组是应力诱导c-fos基因高表达的一个重要环节。
[1]Kletsas D,Basdra EK,Papavassiliou AG.Effect of protein kinase inhibitors on the stretch-elicited c-Fos and c-Jun up-regulation in human PDL osteoblast-like cells[J].J Cell Physiol,2002,190(3):313-321.
[2]Pavalko FM,Chen NX,Turner CH,et al.Fluid shear-induced mechanical signaling in MC3T3-E1 osteoblasts requires cytoskeletonintegrin interactions[J].Am J Physiol,1998,275(6 Pt 1):C1591-C1601.
[3]徐亚娟,张艺平,覃峰,等.细胞骨架完整性对流体剪切力诱导成骨细胞c-fos基因mRNA和蛋白表达的影响[J].中华口腔医学杂志,2009,44(11):681-685.
Xu Yajuan,Zhang Yiping,Qin Feng,et al.Effect of cytoskeleton integrity on the expression of c-fos in osteoblasts induced by fluid shear stress[J].Chin J Stomatol,2009,44(11):681-685.
[4]Wang Y,Li Y,Fan X,et al.Early proliferation alteration and differential gene expression in human periodontal ligament cells subjected to cyclic tensile stress[J].Arch Oral Biol,2011,56(2):177-186.
[5]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[6]Chen HQ,Tian W,Chen YS,et al.Effect of steady and oscillatory shear stress on F-actin content and distribution in neutrophils[J].Biorheology,2004,41(5):655-664.
[7]田卫,陈槐卿,陈蕴颖,等.流体切应力作用下中性粒细胞F-肌动蛋白的变化[J].生物医学工程学杂志,1999,16(4):399-405.
Tian Wei,Chen Huaiqing,Chen Yunying,et al.Changes of Factin in neutrophils under fluid shear stress[J].J Biomed Eng,1999,16(4):399-405.
[8]Knight MM,Toyoda T,Lee DA,et al.Mechanical compression and hydrostatic pressure induce reversible changes in actin cytoskeletal organisation in chondrocytes in agarose[J].J Biomech,2006,39(8):1547-1551.
[9]Schachar RA.Determination of the Poisson’s ratio of the cell:Recovery properties of chondrocytes after release from complete micropipette aspiration[J].J Biomech,2006,39(12):2344.
[10]Trickey WR,Baaijens FP,Laursen TA,et al.Determination of the Poisson’s ratio of the cell:Recovery properties of chondrocytes after release from complete micropipette aspiration[J].J Biomech,2006,39(1):78-87.
[11]Schliwa M.Action of cytochalasin D on cytoskeletal networks[J].J Cell Biol,1982,92(1):79-91.
[12]Hughes-Fulford M.The role of signaling pathways in osteoblast gravity perception[J].J Gravit Physiol,2002,9(1):257-260.
