RNA干扰酪氨酸激酶受体2对人脐静脉内皮细胞增殖的影响
2012-03-24吴世卿曾曙光温志欣彭细毛李玉兰卿安蓉
吴世卿 曾曙光 温志欣 彭细毛 李玉兰 卿安蓉
(1.南方医科大学附属医院·顺德第一人民医院 口腔科,顺德528300;2.广东省口腔医院 口腔颌面外科,广州510280)
酪氨酸激酶受体2(tyrosine kinase 2 with immunoglobulin-like and epidermal growth factor homology domains,Tie2)是表达于血管内皮细胞的血管生长调节因子,与肿瘤的微血管及生物学行为密切相关。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)具有分化潜能和新生血管内皮细胞的特异性。本研究采用RNA干扰(RNA interference,RNAi)技术,将携带有Tie2基因的特异性短发夹状RNA(short hairpin RNA,shRNA)片段的质粒转染入HUVECs中,然后用实时定量逆转录聚合酶链反应(real time quantitation reverse transcriptase polymerase chain reaction,QRT-PCR)和免疫印迹(Western blot)法分别检测细胞中Tie2 mRNA和蛋白表达的改变情况,探讨沉默Tie2基因是否会对HUVECs的生长起调控作用。
1 材料和方法
1.1 材料
HUVECs:第4~6代,由广东省口腔医院实验室保存。含有特异性针对Tie2的shRNA的pGenesil-1质粒(pGenesil 1.1-U6-Tie2-shRNA),由武汉晶赛公司设计合成,经预试验选用Tie2目的基因序列为5’-GATGCGTCAACAAGCTTCC-3’;以HUVECs里不具备的基因hk为阴性对照,其基因序列为5’-GACTTCATAAGGCGCATGC-3’。
1.2 方法
1.2.1 细胞分组和培养 细胞分为3组:实验组为pGenesil 1.1-U6-Tie2-shRNA质粒+LipofectamineTM2000脂质体,阴性对照组为pGenesil-hk质粒+LipofectamineTM2000脂质体,空白对照组为无转染组。转染前1 d,将HUVECs按每孔1×105个细胞接种于六孔板中培养;转染当日用OPTI-MEM Ⅰ培养基(Invitrogen公司,美国)稀释LipofectamineTM2000脂质体(Invitrogen公司,美国)和质粒(同一培养基中加入0.5 μL脂质体和1 μg质粒),转染HUVECs,具体操作按LipofectamineTM2000说明书进行。荧光显微镜下观察各组细胞的转染情况,并计算转染率。
1.2.2 QRT-PCR检测HUVECs中Tie2 mRNA的表达在Genbank中查找Tie2的序列(NM_000459.3),采用Olig5软件设计PCR引物。Tie2上游引物为:5’-TCCAAGGATGTCTCTGCTCTC-3’,下游引物为:5’-TTGGGGTCATCCTCGGTAT-3’;内参照甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物为:5’-ACACCCACTCCTCCACCTTT-3’,下游引物为:5’-TTACTCCTTGGAGGCCATGT-3’。
将细胞分别按实验组、阴性对照组和空白对照组接种于25 cm2培养瓶,分别在转染后24、48 h提取细胞总RNA(Invitrogen公司,美国),电泳检测RNA的完整性,紫外分光光度计检测RNA的质量浓度和纯度;QRT-PCR(GeneCopoeia公司,美国)检测Tie2 mRNA的表达。PCR反应条件为:预变性95 ℃10 min;变性95 ℃10 s,退火60 ℃20 s,延伸72 ℃15 s,40个循环;终末循环延伸72 ℃8 min。上述实验操作重复3次。Tie2的mRNA相对表达量经内参照GAPDH校正,参照Livak等[1]报道的方法分析结果。
1.2.3 Western blot法检测转染后HUVECs中Tie2蛋白的变化情况 细胞转染和分组同1.2.2。分别于转染后24、48 h提取各组细胞的蛋白,采用Western blot法检测Tie2的蛋白表达情况,按照说明书测定蛋白的相对表达量。各组所用的Tie2抗体和细胞骨架蛋白αtuburlin抗体均为美国Santa Cruz公司产品。实验操作重复4次。各组细胞的Tie2蛋白、α-tuburlin蛋白的Western blot结果由数码相机拍摄成像,并用Image J软件分析各显影带的灰度值。
1.2.4 转染后HUVECs凋亡的形态学观察 细胞转染和分组同1.2.2。分别于转染后24、48 h收集细胞涂片。每张涂片用苏木素染色10 min,自来水冲洗去除残留的染色液;用含1%盐酸的70%乙醇溶液进行分色,脱去多余的染料,自来水冲洗15 min使之蓝化;放入1%伊红水溶液中浸染10 min;蒸馏水洗去载玻片上的染液,脱水、透明、封片。在显微镜下观察细胞形态,分别选择细胞密度均一的5个高倍视野,计算总细胞数和凋亡细胞数(以细胞核染色质出现明显的边缘化凝集为凋亡细胞的标志)。
1.2.5 噻唑蓝比色分析(methyl thiazolyl tetrazolium,MTT)法检测转染后各组细胞的增殖情况 以每孔2×104个细胞接种到96孔板,分别在转染前和转染后1、2、3、4 d用MTT溶液显色,孵育,二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,置于酶标仪上测定各孔的吸光度A值,测定波长为490 nm。以培养时间为横坐标,A值为纵坐标绘制细胞的生长曲线图。
1.3 统计学分析
2 结果
2.1 pGenesil-1质粒转染情况
pGenesil-1质粒有效转染入HUVECs中,各组细胞的转染情况见图1:实验组和阴性对照组均有绿色荧光表达,而空白对照组无绿色荧光表达,提示转染成功。重复转染4次,转染率均为65%左右。
2.2 QRT-PCR检测结果
各组细胞的QRT-PCR结果见表1。与阴性对照组和空白对照组相比较,实验组转染24、48 h后细胞中的Tie2 mRNA相对表达量均下调,转染48 h后下调更为明显。
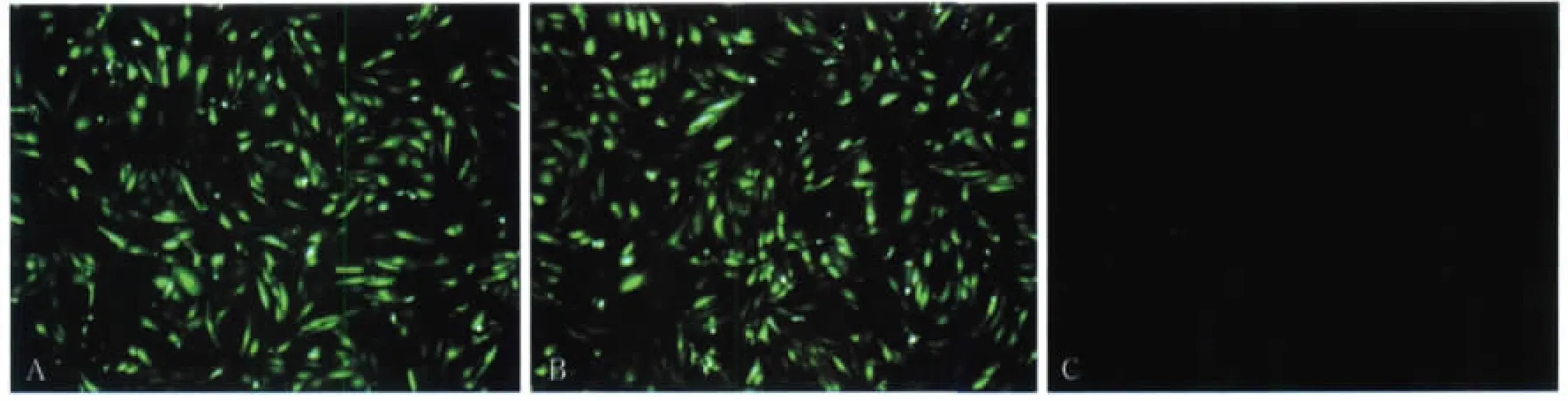
图1 转染的pGenesil-1质粒表达绿色荧光蛋白 荧光显微镜×100Fig 1 Cells successfully transfected with the pGenesil-1 plasmid expressed green fluorescent protein fluorescence microscope×100

表1 转染24、48 h后Tie2 mRNA的相对表达量Tab 1 The relative expression of Tie2 after transfected 24 h and 48 h
2.3 Western blot检测结果
各组细胞Tie2、α-tuburlin的Western blot结果见图2:实验组Tie2基因24、48 h条带均明显弱于阴性对照组和空白对照组,而两个对照组间的表达强弱无明显差异;实验组48 h的Tie2条带明显弱于实验组24 h的条带。对Western blot条带进行半定量分析(Tie2与α-tuburlin显影灰度值的比值),空白对照组、阴性对照组和实验组培养48 h时的灰度值分别为:1.089±0.134、1.024±0.408、0.466±0.037,培养24 h时的灰度值分别为0.983±0.036、0.985±0.724、0.722±0.078。经统计学分析,实验组48、24 h的灰度值分别与相同培养时间的两个对照组比较,其差异均有统计学意义(P<0.05),实验组低于对照组;实验组48、24 h的灰度值进行比较,其差异也有统计学意义(P<0.05)。
2.4 HUVECs凋亡的形态学观察
实验组出现凋亡的细胞数目明显增多,尤以48 h较为明显;而阴性对照组、空白对照组的细胞凋亡不明显。各组细胞的凋亡率见表2。采用卡方检验进行统计学分析,可见3组间细胞凋亡率的差异有统计学意义(P<0.05)。
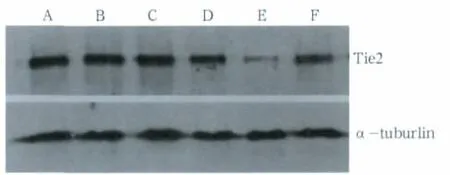
图2 Wesern blot检测结果Fig 2 Results of Western blot test
表2 细胞凋亡结果的统计分析
Tab 2 The statistical analysis of apoptosis
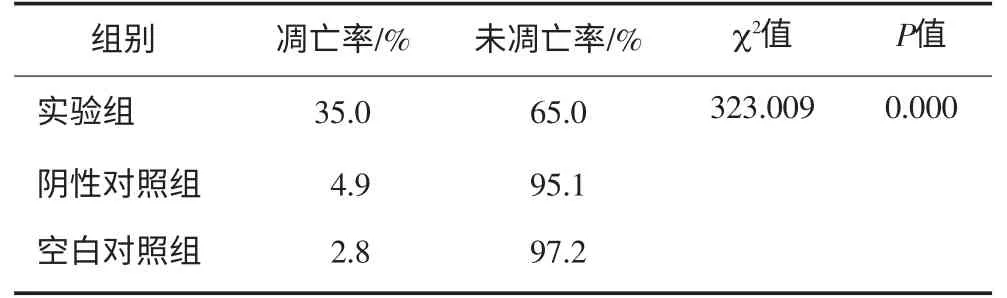
χ2值P值未凋亡率/%65.00.000阴性对照组4.995.1空白对照组2.897.2 323.009组别凋亡率/%实验组35.0
2.5 转染后各组细胞的增殖情况
MTT法检测转染前后HUVECs的增殖情况,其结果见图3。
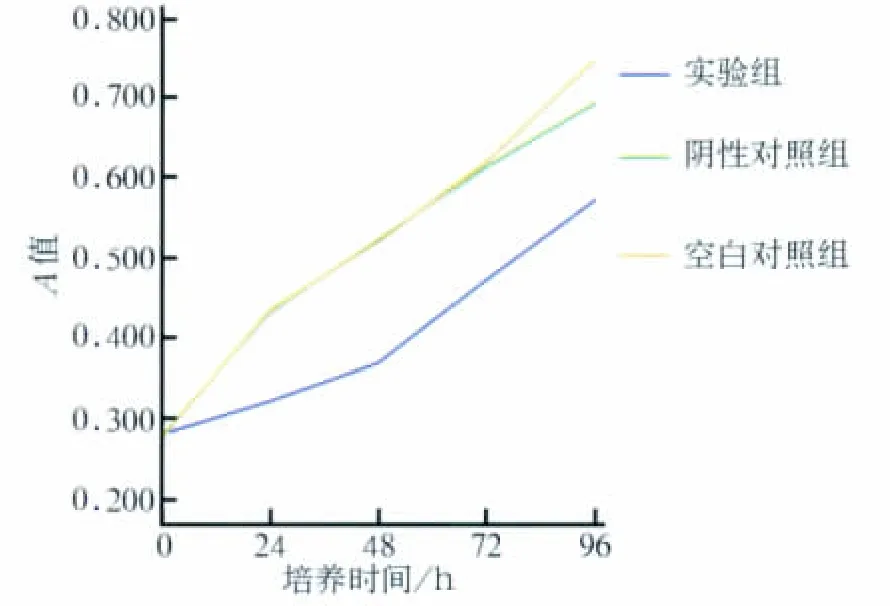
图3 pGenesil 1.1-U6-Tie2-shRNA对HUVECs增殖的影响Fig 3 The effect of pGenesil 1.1-U6-Tie2-shRNA on the proliferation of HUVECs
由图3可见:实验组在转染了pGenesil 1.1-U6-Tie2-shRNA后,细胞仍有增殖,但较空白对照组和阴性对照组缓慢得多(P<0.05);而两个对照组的细胞增殖良好,差异无统计学意义(P>0.05)。
3 讨论
Tie2在肿瘤血管生成中起着极为重要的作用。研究[2-4]发现:Tie2在许多恶性肿瘤如肝癌、乳腺癌、神经胶质瘤等出现表达上调现象。还有研究[5]报道:Tie2在口腔癌组织的表达明显高于正常对照组织,并随临床病理分级的增加呈现递增的趋势。部分阻断血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)途径且无生物学反应的肿瘤常表达Tie2,提示Tie2是肿瘤血管生成中另一条独立的调控途径[6]。
Tie2参与血管生成调节的机制可能是因为Tie2与其配体Ang结合后激活PI3-K/Akt信号途径,从而导致血管形成、内皮细胞迁移等[7]。Tie2基因是特异性表达于内皮细胞和某些造血祖细胞的酪氨酸激酶受体,国外大部分有关Tie2基因的体外研究都是建立在血管内皮细胞的基础上[8]。本实验的前期研究[9]结果提示:Tie2在HUVECs中呈高表达水平,与国内外相关研究结果相符。
本研究应用RNA干扰技术,将含有Tie2基因特异性shRNA的质粒转染入HUVECs。QRT-PCR结果显示:就同一时间点而言,转染HUVECs 24、48 h后,实验组Tie2 mRNA的相对表达量分别只有相应时间点的空白对照组的0.392倍和0.363倍;就同一对照组而言,转染HUVECs 24、48 h后,实验组Tie2 mRNA的相对表达量分别只有空白对照组(24 h)的0.392倍和0.543倍。此外,空白对照组培养48 h的Tie2 mRNA相对表达量也增高,由此推测,实验组转染48 h的Tie2 mRNA相对表达量比转染24 h高可能是由于基因拷贝所致,此机制仍需进一步研究。上述结果表明:转染的pGenesil 1.1-U6-Tie2-shRNA能够显著抑制Tie2基因的表达,且转染后48 h的HUVECs中Tie2 mRNA的表达量低于转染后24 h。Western blot结果显示:HUVECs经质粒转染后,Tie2蛋白表达明显低于阴性对照组和空白对照组,且实验组转染48 h的Tie2蛋白表达量显著低于转染24 h(P<0.05),而两个对照组之间的差异则没有统计学意义(P>0.05)。此外,阴性对照组和空白对照组转染48 h的Tie2基因表达量有所增高,但实验组转染48 h的Tie2基因表达量却进一步下降,说明转染的pGenesil 1.1-U6-Tie2-shRNA显著抑制了Tie2基因的表达。而引起阴性对照组和空白对照组培养48 h后Tie2基因表达量有所增高的原因,可能是由于上样量误差或是基因随时间有所拷贝所致,此机制仍需进一步研究。
本研究结果提示:实验组转染48 h后的细胞凋亡率达到35.0%,明显高于两个对照组(P<0.05),提示Tie2-shRNA沉默了HUVECs中的Tie2基因后能诱导细胞的凋亡,进一步证实了Tie2在HUVECs中的作用。MTT结果显示:实验组在转染了pGenesil 1.1-U6-Tie2-shRNA后,细胞仍有增殖,但较空白对照组和阴性对照组缓慢得多(P<0.05),提示pGenesil 1.1-U6-Tie2-shRNA显著抑制了HUVECs的增殖。上述结果均提示Tie2的表达与内皮细胞生物学活性密切相关。诱导内皮细胞凋亡、减少肿瘤血管生成可抑制肿瘤的生长,而本研究表明Tie2基因表达下调可导致内皮细胞增殖减缓、凋亡增多,提示沉默Tie2基因表达可能成为肿瘤治疗的新途径。
[1]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[2]Zhang ZL,Liu ZS,Sun Q.Expression of angiopoietins,Tie2 and vascular endothelial growth factor in angiogenesis and progression of hepatocellular carcinoma[J].World J Gastroenterol,2006,12(26):4241-4245.
[3]Dales JP,Garcia S,Bonnier P,et al.Tie2/Tek expression in breast carcinoma:Correlations of immunohistochemical assays and longterm follow-up in a series of 909 patients[J].Int J Oncol,2003,22(2):391-397.
[4]Lee OH,Xu J,Fueyo J,et al.Expression of the receptor tyrosine kinase Tie2 in neoplastic glial cells is associated with integrin beta1-dependent adhesion to the extracellular matrix[J].Mol Cancer Res,2006,4(12):915-926.
[5]武云霞,梁萍,南欣荣,等.血管生成素受体在口腔癌的表达及其意义[J].现代口腔医学杂志,2005,19(6):618-619.
Wu Yunxia,Liang Ping,Nan Xinrong,et al.Expression and significance of Tie-2 receptor in oral squamous cell carcinoma[J].J Modern Stomatol,2005,19(6):618-619.
[6]Martin V,Liu D,Fueyo J,et al.Tie2:A journey from normal angiogenesis to cancer and beyond[J].Histol Histopathol,2008,23(6):773-780.
[7]Eklund L,Olsen BR.Tie receptors and their angiopoietin ligands are context-dependent regulators of vascular remodeling[J].Exp Cell Res,2006,312(5):630-641.
[8]Niu Q,Perruzzi C,Voskas D,et al.Inhibition of Tie-2 signaling induces endothelial cell apoptosis,decreases Akt signaling,and induces endothelial cell expression of the endogenous anti-angiogenic molecule,thrombospondin-1[J].Cancer Biol Ther,2004,3(4):402-405.
[9]吴世卿,郑俊发,曾曙光,等.人脐静脉内皮细胞的分离培养和鉴定及酪氨酸激酶受体-2在其中的表达[J].华西口腔医学杂志,2009,27(6):653-656.
Wu Shiqing,Zheng Junfa,Zeng Shuguang,et al.Culture and identify the human umbilical vein endothelial cells and investigate the expression of tyrosine kinase-2 with immunoglobulin-like and epidermal growth factor homology domains in the cells[J].West China J Stomatol,2009,27(6):653-656.
