里氏木霉HC-415菌液体发酵产纤维素酶时形态学变化研究*
2012-03-19纪鸿雁
刘 斌,谭 宏,纪鸿雁
(湖南大学生物学院湖南长沙,410082)
纤维素物质是地球上最丰富的有机物资源,全球每年产生的纤维素高达1 000亿吨,但这些资源大部分利用率很低,且污染环境.如能借助纤维素酶将纤维素降解并进一步转化为乙醇、细胞蛋白及气体燃料等物质,对于解决全球面临的能源危机、食品短缺及环境污染等问题具有重大的意义.此外,纤维素酶还可广泛应用于医药、饲料、果蔬加工、造纸、中草药制造、石油开采、工业洗涤剂、细胞生物工程等行业[1].
纤维素酶目前主要通过木霉以固体、液体深层发酵方式发酵生产.在固体发酵中,生长状况及产酶峰期可以通过固体曲的干湿度、菌丝生长及分布状况、分生孢子的形成及颜色变化等因素直观辨别[2-3].在液体深层发酵中一般通过测定酶活性来确定产酶高峰期,然而这种传统的酶活性测定方法不仅需要多种专用仪器设备和化学试剂,还要结合对比标准曲线和计算,不仅费事费力,而且检测成本相应增高[4-5].因此,研究液体深层发酵中的产酶菌株形态学变化,建立其形态学指标体系,对于快速掌握发酵产酶的高峰期和调控发酵液的成熟度具有重要意义.本文以里氏木酶HC-415菌为研究材料,对该菌在液体深层发酵产酶时的菌丝体形态特征与纤维素酶活力间的相关性进行了研究,初步掌握了该菌液体发酵产纤维素酶时菌体形态学变化动态规律,现将结果报道如下.
1 材料、仪器与试剂
1.1 材料与试剂
里氏木霉(Trichoderma reesei)HC-415,湖南大学生物学院提供.菌种,稻草,豆粕,麸皮,羧甲基纤维素钠,新华1号滤纸等.
1.2 仪器设备
30L规模发酵罐出处,倒置荧光显微镜等.
2 培养基
斜面种培养基:PDA培养基;一级种培养基:麸皮,葡萄糖等,pH 5.5-6.0;二级产酶培养基:稻草,豆粕等,pH 5.5-6.0.
3 实验方法
3.1 纤维素酶液体深层发酵法
将HC-415菌斜面种的孢子液接入一级种培养基,28~30℃旋转式摇床上培养40h,再接入30L规模罐二级产酶培养基中进行液体深层产酶发酵试验.
3.2 纤维素酶活性测定方法
羧甲基纤维素酶(CMCase)活性测定:DNS法.滤纸糖酶(FPAase)活性测定:参照文献[4-5],在1mL适当稀释的酶液中加入1mL 0.05mol·L-1(pH 4.6)缓冲液和1条1*6cm2新华1号滤纸.50℃酶解60min,加3mL DNS试剂.沸水浴10min,测还原糖,扣除空白后计算酶活性.
酶液酶活性单位规定为:1h水解生成1mg葡萄糖的酶量为1个活性单位(U).
3.3 纤维素酶液的制备
采集的发酵液,离心除去稻草等固形物,上清液即为酶粗提取液,粗酶液应立即进行后续处理,否则,应放入4℃冰箱保存.
3.4 菌体形态观察
将含HC-415菌丝体的发酵液涂于载玻片上,滴加清水,或用乳酸石炭酸棉蓝染色液对菌体染色,置于倒置荧光显微镜下观察菌丝体形态并拍照记录.
4 结果与讨论
4.1 30L规模罐中HC-415菌产纤维素酶发酵过程动态变化
30L发酵罐装液量20L,搅拌速度为200~450 r/min,通气量0.25~0.6L/(min·L),发酵温度30±1℃,罐压0.01~0.03MPa,消泡剂聚醚添加量为0.6%,培养144h.发酵过程中间隔2h测定并记录pH、通气量、温度、搅拌速度、泡沫等的变化;每隔12h取样检测酶活性,观察记录菌体的形态学变化.从pH检测结果可以看出:菌液pH值在考察的时间内(0~132h)随着发酵时间的延长逐渐升高,从初始的pH值4.20升高至4.94.酶活性检测结果发现:前24h内CMC酶和FPA酶活性很低,基本处于停滞期,60h之后酶活性快速增长,在120 h左右这两种酶活性均达到高峰,120~132h酶活性处于高峰稳定期,132h后酶活性逐步降低(图1),该结果与以前报道的结果类似[6].

图1 产纤维素酶菌HC-415液体发酵时的CMC和FPA酶活性动态变化曲线Fig.1 The kinetic curves of CMCase(a)and FPAase(b)activity during the cellulase liquid fermentation by HC-415strain
4.2 发酵产酶第Ⅰ期菌体形态学及酶活性变化
根据取样观察的结果发现:HC-415菌在液体发酵产纤维素酶时的形态学变化可以明显的划分为4个时期,第Ⅰ期为接种后的0~24h区间,此时的CMC酶和FPA酶活性很低,CMC酶活性约为5 U,FPA酶活性约为0.5U(图1).12h取样观察,HC-415菌呈圆形、杆状小体分布(图2),发酵至24 hr时,HC-415菌已由短圆小体形成细长的团状菌丝体(图3),表明此阶段HC-415菌主要为丝状营养生长,较少分枝,产酶基本处于停滞期.

图2 发酵12h的HC-415菌呈小圆杆状10×20Fig.2 The small rod HC-415hypha after fermentation for 12h(10×20)

图3 发酵24h的HC-415菌丝团10×10Fig.3 The HC-415mycelium after fermentation for 24h(10×10)
4.3 发酵产酶第Ⅱ期菌体形态学及酶活性变化
形态第Ⅱ期变化为接种后的24~60h区间,此时的HC-415菌丝体不断伸长,分枝增多,菌丝体变粗(图4,图5),此期CMC酶和FPA酶活性增长明显(图1),CMC酶活性可增长至20U左右,较Ⅰ期增强约4倍;FPA酶活性可增长至5U左右,较Ⅰ期增强约10倍.

图4 发酵36h的HC-415菌10×10Fig.4 The HC-415mycelium after fermentation for 36h(10×10)

图5 发酵48h的HC-415菌分枝10×20Fig.5 The branched mycelium of HC-415 after fermentation for 48h(10×20)
4.4 发酵第Ⅲ期菌体形态学及酶活性变化
菌体形态第Ⅲ期变化约在接种后的60~132h区间,此阶段的HC-415菌丝体虽然较长,但已不再增长,开始出现横隔(图6),菌丝体变粗变短,在分枝顶部生出许多膨大的结节(图7~图8),至120h左右时,菌丝体断裂形成紧密相连的膨大圆形结节(图9),这段时期为发酵液中纤维素酶活力的快速增长期和产酶高峰稳定期(图1).CMC酶活性在此区间内有2个明显的产酶高峰期,第1个约在72h左右,酶活性可达55U,较Ⅰ期增强约11倍,第2个产酶高峰期约在120h左右,酶活性可达70U,较Ⅰ期增强约14倍;FPA酶活性在此区间则呈稳步快速增长态势,至120h左右到达产酶高峰稳定期,酶活性可达12U左右,较Ⅰ期增强约24倍.这种形态学特征与所对应的酶活性的相关性得到多次实验结果验证[7-8],可以作为快速掌握产酶高峰期发酵液成熟度的重要形态学指标.然而里氏木霉在产酶高峰期菌丝体变短变粗,并在顶部生出许多膨大结节的现象未见有报道,这些结节究竟是产酶结构、繁殖结构(分节孢子)或是休眠结构(厚垣孢子)尚有待进一步研究.

图6 发酵60h的HC-415菌10×20Fig.6 The mycelium of HC-415after fermentation for 60h(10×20)
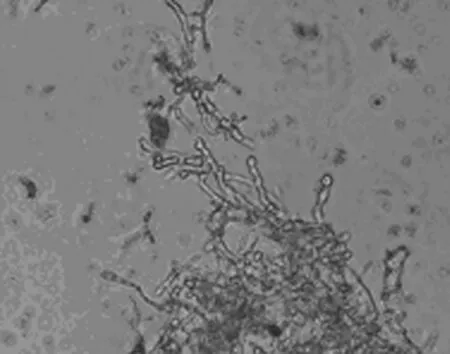
图7 发酵72h的HC-415菌顶端膨大结节10×40Fig.7 The enlargement top nodules of HC-415 after fermentation for 72h(10×40)

图8 发酵96h的HC-415菌顶端膨大结节10×40Fig.8 The enlargement top nodules of HC-415 after fermentation for 96h(10×40)
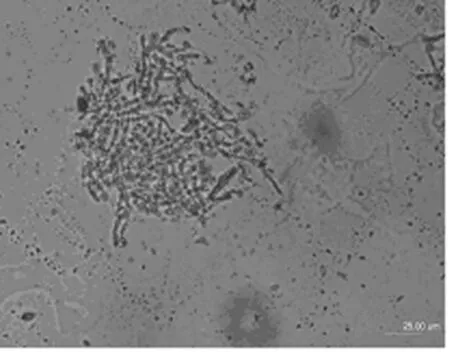
图9 发酵120h的HC-415菌10×40Fig.9 The HC-415mycelium after fermentation for 120h(10×40)
4.5 发酵后期菌体形态学及酶活性变化
发酵至132h后,HC-415菌丝体形态变化进入第Ⅳ期,此期间菌丝体虽呈粗短圆状,顶部仍有许多膨大结节,但菌体的数量开始逐渐变少(图10),从此时起CMC酶和FPA酶活性逐渐步下降.原因可能是随着发酵液中产生的纤维素酶、半纤维素酶及果胶酶等浓度的增高,HC-415菌丝体的合成受到抑制并被分解;另外,随着发酵时间延长和发酵液pH值升高,菌丝体出现衰老、自溶,导致菌体的数量逐渐变少;由于营养源的减少和纤维素酶自身的阻遏抑制效应,加上菌体数量的减少导致了CMC酶和FPA酶活性逐渐下降[9].
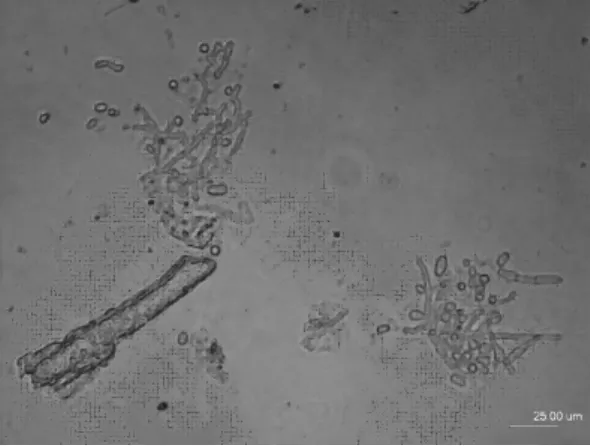
图10 发酵132h后逐渐变少的HC-415菌10×40Fig.10 The decreased number of HC-415mycelium after fermentation for 132h(10×40)
综上所述,里氏木霉液体发酵产纤维素酶时,菌体形态变化与发酵液中的酶活性高低有着密切的关联性,这种关联性可作为快速调控发酵液成熟度的重要指标,利用显微镜观察菌体形态作为直接快速判断该菌产酶能力的强弱具备可行性.HC-415菌丝体在产酶高峰期变短、变粗,并在分枝顶部生出许多的膨大结节究竟是产酶结构、繁殖结构(分节孢子)或是休眠结构(厚垣孢子)尚有待进一步研究.
[1] DEMAIN A L,NEWCOMB M,WU J H D.Cellulase clostridia and ethanol[J].Microbiol Mol Biol Rev,2005,69(1):124-154.
[2] 谭宏,谢小保,莫勇,等.里氏木霉液体发酵产纤维素酶的研究[J].工业微生物,1996,26(1):7-11.TAN Hong,XIE Xiao-bao,MO Yong,et al.Production of cellulase using submerged fermentation by Trichoderma reesei HC-415[J].Industrial Microbiology,1996,26(1):7-11.(In Chinese)
[3] VENDULA V,PETER B.Degradation of cellulose and hemicelluloses by the brown rot fungus Piptoporus betulinus production of extracellular enzymes and characterization of the major cellulases[J].Microbiology,2006,152(12):3613-3622.
[4] LYND L R,WEIMER P J,VAN ZYL W H,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiol Mol Biol Rev,2002,66(3):506-577.
[5] CHEN Xin-ai,ISHIDA N,TODAKA N,et al.Promotion of efficient saccharification of crystalline cellulose by Aspergillus fumigatus Swo1[J].Appl Envir Microbiol,2010;76(8):2556-2561.
[6] GAMA FM,TEIXEIRA JA,MOTA M.Cellulase morphology and enzymatic reactivity:a modified solute exclusion technique[J].Biotechnol Bioeng,1994,43(5):381-7.
[7] 谭宏,刘选明,盛培科,等.利用稻草液体发酵产纤维素酶及酶粉提取的研究[J].湖南大学学报:自然科学版,2011,38(9):75-78.TAN Hong,LIU Xuan-ming,SHENG Pei-ke,et al.Cellulase liquid fermentation and extraction with straw[J].Journal of Hunan University:Natural Sciences,2011,38(9):75-78.(In Chinese)
[8] SHAPIRO A,MULLINS J T.Hyphal tip growth in Achlya bisexualis.II.Distribution of cellulose in elongating and nonelongating regions of the wall[J].Mycologia,2002;94(2):273-279.
[9] HAN S O,YUKAWA H,INUI M,et al.Effect of carbon source on the cellulosomal subpopulations of Clostridium cellulovorans[J].Microbiology,2005,151(5):1491-1497.
