手性配体诱导的不对称频哪醇偶联反应研究进展
2012-03-14温集武
温集武
手性配体诱导的不对称频哪醇偶联反应研究进展
温集武1,2
(1.井冈山大学化学化工学院,江西,吉安 343009; 2.江西省配位化学重点实验室,江西,吉安 343009)
邻二醇是重要的合成中间体,也是不对称合成中常用的手性辅剂,手性配体或手性分子合成中间体。频哪醇偶联反应是合成邻二醇类结构最快捷的方法,不对称频哪醇偶联反应是通过人工创造的手性环境来实现频哪醇偶联反应中的立体选择性。本研究综述了近年来不对称频哪醇偶联反应研究中取得的重要进展,并对这一领域的发展提出了展望。
邻二醇;不对称合成;频哪醇偶联反应;综述
频哪醇即为邻二醇,是有机合成中的重要中间体,广泛用于农药、医药等精细化学品以及天然产物的合成中。同时,频哪醇还是立体选择性合成中的重要辅剂和配体以及配体合成中间体。经典的合成频哪醇的方法包括Sharpless双羟基化反应 (path I),环氧化合物开环反应(path II),频哪醇偶联反应 ( path III) 和邻二酮还原 ( path IV)等。
在众多方法之中,频哪醇偶联反应是合成邻二醇最快捷的方法,该方法的优点是在产生二羟基官能团的同时构建了C-C键骨架。正因如此,在频哪醇偶联反应发展的一百多年历史中,各种各样的合成方法日新月异,应用到此反应的合成试剂也不断推陈出新[1]。

频哪醇偶联反应的过程通常被认为是经历单电子转移机理来实现的。在产生单电子物种的过程中,活泼的主族金属如碱金属、碱土金属,特别是过渡金属都曾扮演了非常重要的角色[2]。比较常用的过渡金属是低价钛的反应体系[3],也有一些文献报道用Cr(II)[4],Ce(III)[5]和Nb(III)[6]也能顺利实现醛或酮的频哪醇偶联。
从频哪醇的结构来看,与羟基直接相连的两个碳原子都具有手性,如何实现频哪醇偶联反应中的立体化学控制一直是从事这一领域研究的众多科技工作者面临的难题和挑战之一。Furstner[7]和Hirao[8]将Me3SiCl引入到低价钛还原体系中无疑促进了立体选择性的频哪醇偶联反应的研究。此后,不同的硅烷化试剂(如Et3SiCl)以及不同的低价态过渡金属(如NiCl2和CrCl2)相继引入到频哪醇偶联反应中来。本研究拟对近年来在手性配体参与的不对称频哪醇偶联反应中取得的进展作一评述。
1 低价钛配合物诱导的不对称频哪醇偶联反应
低价钛配合物是不对称频哪醇偶联反应中研究最为广泛深入的一类手性诱导试剂,根据配合物用量的不同,分为化学计量和催化量两种情况,下面将分别予以讨论。
1.1 化学计量条件下低价钛配合物诱导的不对称频哪醇偶联反应
Matsubara等[9]首次报道用手性二胺配体1诱导不对称频哪醇偶联反应,在等摩尔比的TiCl2和2倍摩尔比的手性配体1存在的条件下,以dl / meso 11:1的非对映选择性获得邻二醇产物,尽管当时他们所获得的对映选择性不高,但却开创了对映选择性的频哪醇偶联反应研究的先河。
You小组[10]随后以二胺配体2和3诱导不对称频哪醇偶联反应,在TiCl4(THF)2/ Zn体系中,在化学计量的手性二胺存在下,只得到dl产物,对映选择性也达到34%~65% e.e.。
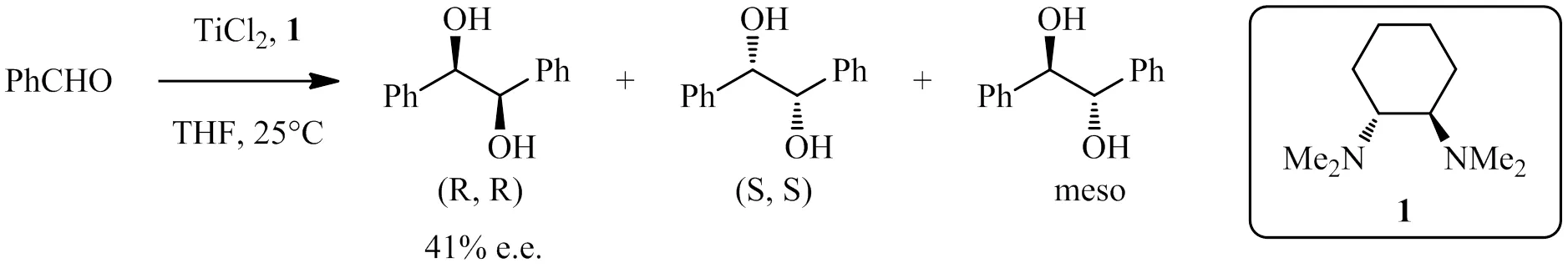
同样的,Enders等[11]也以一系列胺及其衍生物4~10诱导TiCl2体系中的不对称频哪醇偶联反应,研究发现配体4效果最好,在-78℃下反应23 h以dl / meso 81:19和65% e.e.获得邻二醇产物,但是产率不高。用其他配体诱导同样的反应时,虽然温度升高可以提高化学产率,但是立体选择性却不甚理想。
Nicholas等人[12]报道的手性二茂钛配合物11诱导的醛的不对称频哪醇反应,邻二醇产物的对映选择性可达32%~60% e.e.。
纵观以上这些不对称频哪醇偶联反应体系,虽然需要化学计量的手性配体的参与,但从实验事实上证明了手性配体对频哪醇偶联反应的立体选择性的调控是切实可行的,从而为后续研究奠定了基础。
1.2 催化量低价钛配合物诱导的不对称频哪醇偶联反应
化学计量的低价钛配合物能有效调控频哪醇偶联反应中的立体选择性,但是配体用量过大的缺点必然使反应成本增加,从而使其应用前景受到很大的限制,因此,更多的研究组把目标瞄准了催化意义上的不对称频哪醇偶联反应,不同的手性配体先后被用来催化不对称频哪醇偶联反应。
1.2.1 席夫碱类配体
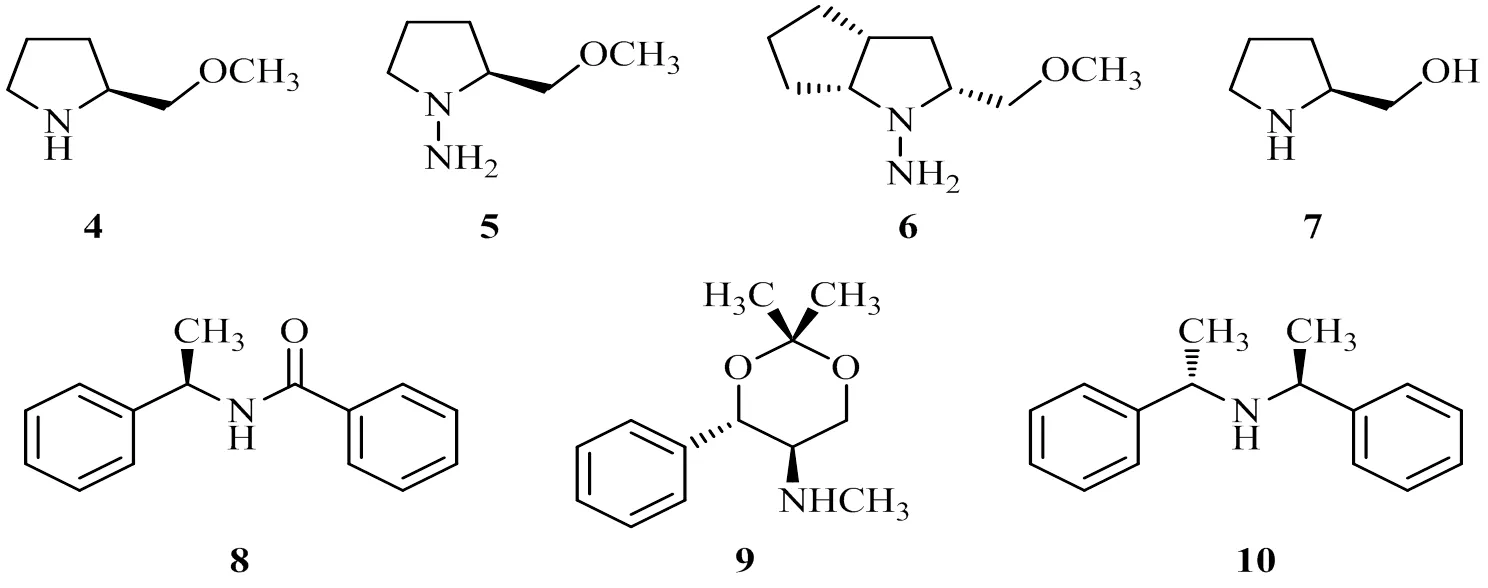
首例催化意义上的不对称频哪醇偶联反应源于Cozzi等人的研究[13],用手性的席夫碱(Schiff-base)配体12与TiCl4(THF)2生成的络合物L2TiCl2来催化频哪醇偶联反应,获得很高的非对映选择性,dl / meso最高达到99:1,相比较而言,对映选择性则不甚理想,以苯甲醛作底物时对映体过量值仅10% e.e.。
随后的Riant等的研究[14]却卓有成效,他们以简单的方法由席夫碱以及Salen 12的对映体分别与Ti(Oi-Pr)4和TMSCl反应生成了在空气中能稳定存在的钛的络合物13和14。
以13和14作催化剂,分别以化学计量和催化量的配合物诱导芳香醛的不对称频哪醇偶联反应。结果表明,不管是化学计量还是催化量的钛配合物,都能以较高的化学产率和较高的非对映选择性(dl / meso 最高达98:2)获得相应的邻二醇。尽管在化学计量的配合物存在时可以获得高达91% e.e.的对映选择性,但以催化量的钛配合物诱导不对称频哪醇偶联反应时只能获得中等的对映选择性(最高达 64% e.e.)。
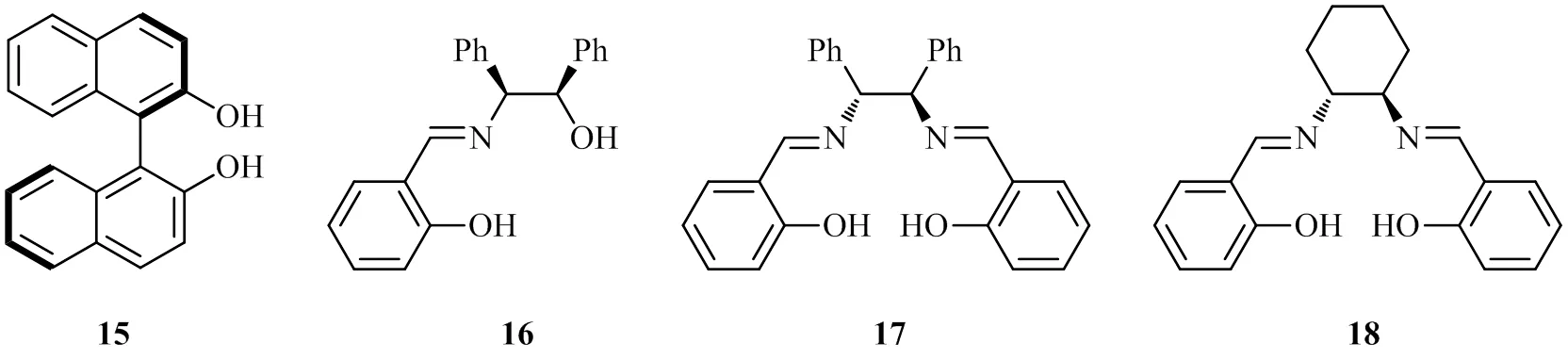
令人振奋的成果来自Jishi[15]的研究,在以配体15~17的钛配合物催化不对称频哪醇偶联反应未能获得满意结果(较低或中等的立体选择性)的情况下,他们以Salen配体18按照类似Riant的方法合成对空气不敏感的钛配合物Ti-18,使用10%的催化剂量对芳香醛的频哪醇偶联反应进行不对称诱导,获得很好的结果(最高达 96% e.e.)。
Joshi认为,产物的立体化学主要是通过环己二胺上的α-H来控制,手性催化剂与醛经过单电子转移后生成下图所示的过渡态, 然后经历自由基的二聚得到相应的邻二醇产物。

中国科学技术大学You小组[16]用2-吡啶醛和手性1, 2-二苯基乙二胺反应合成双席夫碱配体19,与钛形成的配合物能有效的催化不对称频哪醇偶联反应,以芳香醛为底物时对映选择性最高达到91% e.e.。
该研究组也报道了一类手性二肽席夫碱配体的合成及其在不对称频哪醇偶联反应中的应用[17]。用多肽的液相合成法,通过简捷的步骤合成手性二肽席夫碱类配体20~23。
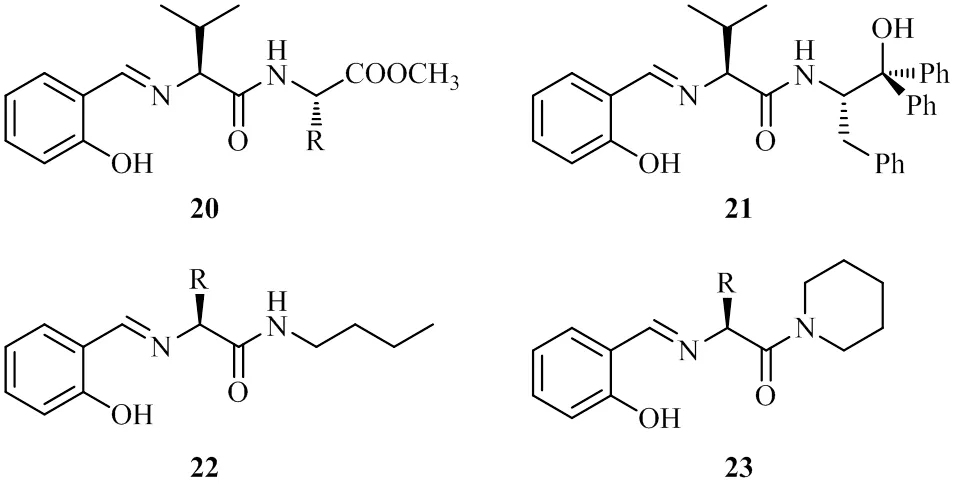
这类配体与钛反应生成的配合物对于催化芳香醛的不对称频哪醇偶联反应取得较高的非对映选择性和中等的对映选择性(最高达71% e.e.)。
1.2.2 酒石酸衍生的二醇类配体
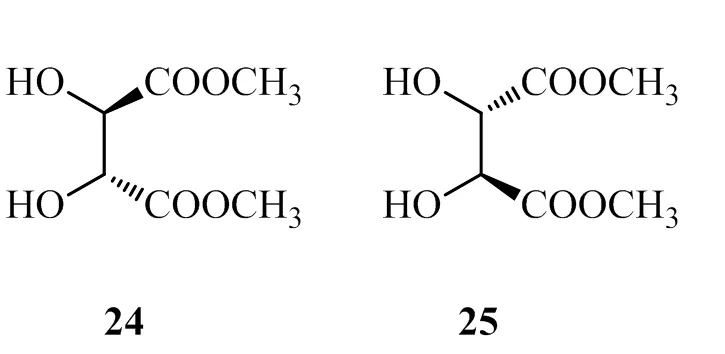
You小组从天然和非天然酒石酸出发合成二醇配体24~27,发现直接的酒石酸二甲酯24和25表现出较差的不对称诱导作用,原因可能还是配体本身的空间结构上的缺陷所致。相比之下,26和27在常温下反应即可获得较好的化学产率和非对映选择性,而且产物的对映选择性也可达到中等水平。进一步的条件优化表明,降低反应温度虽然使反应产率稍有降低,但却较大地提高了产物的非对映选择性和对映选择性,另外,研究还发现以锌作为还原金属对反应结果更为有利[18]。
1.2.3 噁唑啉类配体
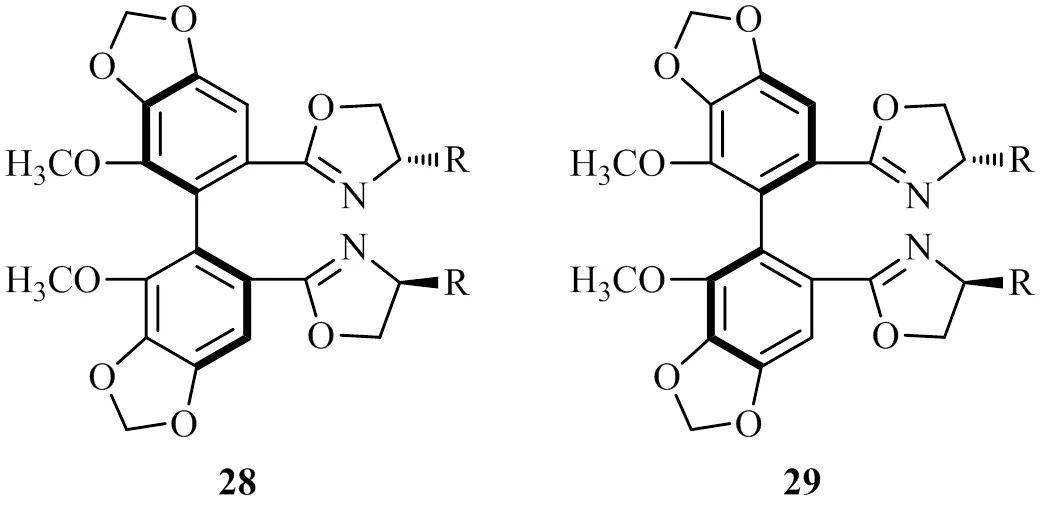
手性噁唑啉是不对称催化反应中应用广泛的一类重要的手性配体[19],You小组首次使用由抗肝炎药联苯双酯合成的手性噁唑啉配体28~29,其钛配合物能有效催化不对称频哪醇偶联反应[20]。研究还发现,联苯的轴手性对频哪醇偶联反应中的立体选择性影响不大。
2 低价铬配合物催化的不对称频哪醇偶联反应
低价铬(CrCl2)是有机合成中非常有用的一个还原试剂,广泛应用于烯丙基卤代烃的还原、Barbier、Reformatsky等反应中。以低价铬试剂用于醛的还原偶合反应(频哪醇偶联)早在上世纪中期就有报道,但当时研究的目的主要是出于对反应机理和反应动力学的考察。因此很长时间以来,关于这方面的文献报道很少,原因可能是因为反应过程中有毒的铬废物后处理比较困难。
Yamamoto等[21]报道了首例低价铬试剂催化的不对称频哪醇偶联反应。他们从7-特丁基-8-甲氧基喹啉合成联萘骨架的手性配体30 (TBOxH)。

以30与CrCl2生成的络合物TBOxCrCl催化芳香醛的频哪醇偶联反应。仅使用3%的催化剂量即获得了迄今为止最好的催化效果,不仅化学产率(88~94%)和产物的非对映选择性(dl / meso为92:8~98:2)很好,更为重要的是生成邻二醇的对映选择性也很高(95%~98% e.e.)。他们也尝试了环己基甲醛的频哪醇偶联反应,虽然得到邻二醇的产率不高(40%),但仍然获得了很好的非对映选择性(dl / meso为93:7)和对映选择性(84% e.e.)。
3 Mo和V的配合物催化的不对称频哪醇偶联反应
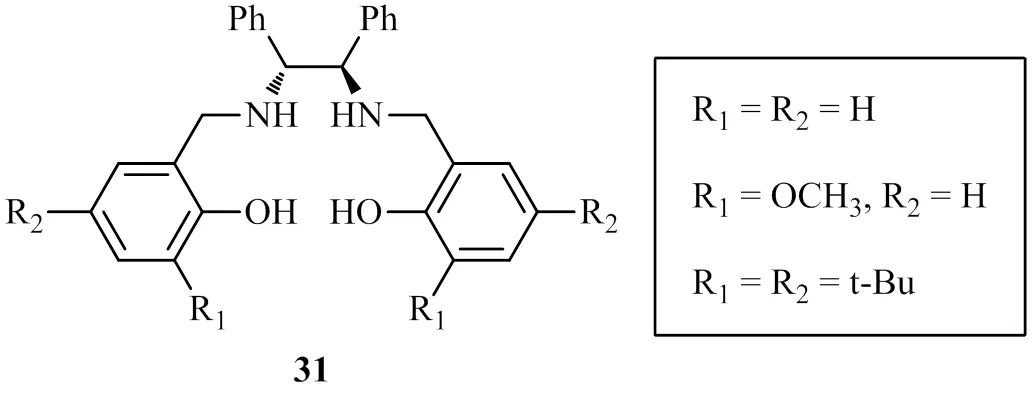
南京大学Zhu小组从手性1, 2-二苯基乙二胺出发合成手性配体31,该配体与MoO2(acac)2和VO(acac)2合成的配合物在催化芳香醛的不对称频哪醇偶联反应时表现出较好的立体调控能力,相比较而言,Mo配合物更为有效(最高95% e.e.)[22],而V配合物则只能获得中等以下的对映选择性(最高82% e.e.)[23]。
4 结语与展望
手性邻二醇作为一类非常重要的手性物质以及合成中间体,在科学研究乃至于手性药物,手性农药生产中都具有非常重要的理论和应用价值[24-25]。因此,开展不对称频哪醇偶联反应,特别是催化的不对称频哪醇偶联反应的研究,不仅在当前具有很好的理论探讨价值,随着研究的深入和拓展,也将实现从理论研究到在工农业生产中创造实际效益的转化。
迄今为止,在不对称频哪醇偶联反应的研究领域已经取得了重要的进展,SmI2促使的底物诱导不对称频哪醇偶联反应已经获得了很好的非对映选择性和对映选择性[26-27],但是,手性配体参与的不对称频哪醇偶联反应的研究则并不是很广泛和深入,好的成果为数不多。而从长远来看,催化的不对称反应更能够实现手性增殖。所以,针对当前的研究成果,以下三方面将成为这一研究方向的主要研究内容:(1) 高效普适的手性配体的设计与合成。当前的研究虽然有部分手性催化剂具有很高的不对称诱导效果,但反应底物基本局限于芳香族化合物,设计、合成对底物具有普适性的手性催化剂是今后必然要探讨的内容;(2) 基于频哪醇偶联反应的外延拓展方面的研究。频哪醇偶联反应是sp2杂化的羰基碳经历单电子转移的自由基偶联反应,由醛或酮生成的亚胺之间的偶联,以及醛酮与亚胺之间的交叉偶联的探讨必将使不对称频哪醇偶联反应的研究内容不断丰富和拓宽;(3) 利用不对称频哪醇偶联反应进行手性药物以及生物活性天然产物的全合成研究。理论的研究终极目的还是服务于国计民生,因此,随着在不对称频哪醇偶联反应方法学研究的逐步深入和成熟,开展含有邻二醇类结构的生物活性分子的合成研究也必会水到渠成。
[1] Trost M B. Comprehensive organic synthesis [M]. Oxford: Pergamon press, 1991: 562-611.
[2] Gansauer A, Bluhm H. Reagent-controlled transition- metal-catalyzed radical reactions [J]. Chem Rev, 2000, 100: 2771-2788.
[3] Furstner A, Bogdanovic B. New developments in the chemistry of low-valent titanium [J]. Angew Chem. Int Ed Engl, 1996, 35: 2442-2469.
[4] Furstner A. Carbon-carbon bond formations involving organochromium(iii) reagents [J]. Chem Rev, 1999, 99: 991-1045.
[5] Jeske M, Groth U. Diastereoselective ce(oi-pr)3catalyzed pinacol couplings of aldehydes [J]. Angew Chem. Int Ed Engl, 2000, 39(3): 574-576.
[6] Arai S, Sudo Y, Nishida A. A highly diasteroselective pinacol coupling reaction of aldehydes and ketones using low-valence niobium generated from Nb(V)[J]. Chem Pharm Bull, 2004, 52(2): 287-288.
[7] Fürstner A, Huppert A. Carbonyl coupling reactions catalytic in titanium and the use of commercial titanium powder for organic synthesis [J]. J Am Soc Chem, 1995, 117: 4468-4475.
[8] Hirao T, Hasegawa T, Muguruma Y, et al. A novel catalytic system for one-electron reduction. low valent vanadium-catalyzed coupling of aldehydes [J]. J Org Chem, 1996, 61: 366-367.
[9] Hanshimoto Y, Mizuno U, Matsubara S. et al. Structural studies of the low-valent titanium “solution”: what goes on in the pinacol coupling reaction? [J]. J Am Chem Soc, 2001, 123: 1503-1504.
[10] Li Y G, Jiang C S, You T P. et al. Asymmetric pinacol coupling of aromatic aldehydes catalyzed by ticl4(thf)2-zn/chiral diamines [J]. Chin J Chem, 2003, 21: 1369-1371.
[11] Enders D, Ullrich E C. Asymmetric pinacol coupling of aromatic aldehydes with ticl2/ enantiopure amine or hydrazine reagents [J]. Tetrahedron: Asymmetry, 2000, 11: 3861-3865.
[12] Dunlap S M, Nicholas K M. Catalyst structural effects in titanocene-catalyzed pinacol coupling: activity, stereoselectivity and mechanistic implications [J]. J Organomet Chem, 2001, 630: 125-131.
[13] Bandini M, Cozzi P G, Morganti S, et al. Highly diastereoselective pinacol coupling of aldehydes catalyzed by titanium-schiff base complexes [J]. Tetrahedron Lett, 1999, 40: 1997-2000.
[14] Bensari A, Renaud J L, Riant O. Enantioselective pinacol coupling of aldehydes mediated and catalyzed by chiral titanium complexes [J]. Org Lett, 2001, 3: 3863-3865
[15] Chatterjee A, Bennur T H, Joshi N N. Truly catalyzed and enantioselective pinacol coupling of aryl aldehydes mediated by chiral ti(iii) complexes [J]. J Org Chem, 2003, 68: 5668-5671.
[16] Li Y, Tian Q, Zhao J, et al. Asymmetric pinacol coupling of aromatic aldehydes catalyzed by a new titanium–schiff base complex [J]. Tetrahedron: Asymmetry, 2004, 15(11): 1707-1710.
[17] Wen J, Zhao J, Wang X, et al. Asymmetric pinacol coupling reaction catalyzed by dipeptide-type schiff bases [J]. Journal of Molecular Catalysis A: Chemical, 2006, 245 (1-2): 242-247.
[18] Wen J, Zhao J, You T. Asymmetric pinacol coupling catalyzed by taddol-titanium complexes [J]. Journal of Molecular Catalysis A: Chemical, 2006, 245 (1-2): 278-280.
[19] Hargaden G C, Guiry P J. Recent applications of oxazoline-containing ligands in asymmetric catalysis[J]. Chem Rev, 2009, 109: 2505–2550.
[20] Wen J, Tan Q, You T. Biphenyl-oxazoline ligands derived from β-DDB: Their synthesis and application in asymmetric pinacol coupling reaction [J]. Journal of Molecular Catalysis A: Chemical, 2006, 258 (1-2): 159-164.
[21] Takenaka N, Xia G, Yamamoto H. Catalytic, highly enantio- and diastereoselective pinacol coupling reaction with a new tethered bis(8-quinolinolato) ligand [J]. J Am Chem Soc, 2004, 126: 13198-13199.
[22] Yang H, Wang H, Zhu C. Enantioselective pinacol coupling of aryl aldehydes catalyzed by chiral salan-mo(iv) complexes [J]. J Org Chem, 2007, 72: 10029-10034.
[23] Sun J, Dai Z, Li C, et al. Enantioselective pinacol coupling reaction of aromatic aldehydes catalyzed by chiral vanadium complexes [J]. J Organomet Chem, 2009, 694: 3219-3221.
[24] Chatterjee A, Joshi N N. Evolution of the stereoselective pinacol coupling reaction [J]. Tetrahedron, 2006, 62(52): 12137-12158.
[25] Okano K. Synthesis and application of chiral hydrobenzoin [J]. Tetrahedron, 2011, 67: 2483-2512.
[26] Fukuzawa S, Oura I, Schimizu K, et al. Divalent samarium triflate mediated stereoselective pinacol coupling of planar chiral phosphanyl and phosphoryl ferrocenecarbaldehyde [J]. Eur J Org Chem, 2009, 716–720.
[27] Wang Y J, Wang B. SmI2-Promoted Intramolecular asymmetric pinacol-type ketone tert-butanesulfinyl imine reductive coupling: stereoselectivity and mechanism [J]. Org Lett, 2009, 11(15): 3410-3413.
PROGRESS IN ASYMMETRIC PINACOL COUPLING REACTION INDUCED BY CHIRAL LIGANDS
WEN Ji-wu1,2
(1.School of Chemistry and Chemical Engineering, Jinggangshan University, Ji’an, Jiangxi 343009, China;2.The Key Laboratory of Coordination Chemistry of Jiangxi Province, Ji’an, Jiangxi 343009, China)
Vicinal diols is an important category of synthetic intermediates, and also can act as chiral auxiliaries, ligands or synthetic intermediates for chiral molecules in asymmetric synthesis. Pinacol coupling reaction is a direct method for vicinal diols generation. Stereoselectivities in asymmetric pinacol coupling can be realized via chiral environments created by manual methods. This review summarized the recent progress in asymmetric pinacol coupling reaction, and corresponding prospects in this field have also been put forward.
vicinal diols; asymmetric synthesis; pinacol coupling reaction; review
1674-8085(2012)03-0031-06
O622.3
A
10.3969/j.issn.1674-8085.2012.03.007
2012-02-24;
2012-04-27
江西省教育厅科技项目(GJJ09331),井冈山大学博士科研启动基金(JZB11039)
温集武(1972-),男,江西赣州人,讲师,博士,主要从事不对称合成方法学的研究(E-mail: wenjiwu@163.com);
