曲古抑菌素A对甲状腺鳞癌SW579细胞株p53和p21表达的影响
2012-03-10张秀梅王翠瑶肖建英
刘 超,赵 颂,张秀梅,王翠瑶,刘 洋,肖建英
(辽宁医学院,辽宁锦州121001)
组蛋白去乙酰化酶抑制剂的应用标志着一种全新的肿瘤治疗途径。曲古抑菌素A(TSA)是一种高效、低毒的化疗新药,可通过多种途径发挥其抗癌效应,在体内外可阻滞多种肿瘤细胞株的生长,诱导分化及凋亡,但抗肿瘤的具体机制尚不清楚[1~4]。2010年10月~2011年7月,本研究通过选用不同浓度的TSA作用于甲状腺鳞癌SW579细胞株,旨在探讨TSA对甲状腺鳞癌SW579细胞株生长增殖及细胞周期蛋白p53与p21表达的影响,进而探讨TSA的抗癌机制,为TSA的临床开发应用提供详实的实验依据。
1 材料与方法
1.1 主要试剂与仪器 TSA、L15培养液(Sigma公司);RNA PCR Kit(AMV)Ver.3.0试剂盒(TaKaRa公司);p53(兔抗人多克隆抗体)、p21(小鼠抗人多克隆抗体)、β-Actin抗体(兔抗人多克隆抗体)购自Santacruz公司;Western细胞裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物技术公司;HRP标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司); ECL化学发光试剂盒(Piece Biotechnology公司);四甲基氮唑兰(Sigma公司);BB16UV CO2培养箱(Heraeus);Sunrise自动酶标检测仪(Tecan公司); BioPhotometer Plus核酸蛋白测定仪、PCR扩增仪购自Eppendorf公司;水浴式电转印槽DYY-Ⅲ40B型(北京六一仪器厂),凝胶自动成像仪GDS8000、电泳仪、电泳槽(Bio-Rad,美国)。
1.2 细胞培养及实验分组 甲状腺鳞癌细胞株SW579购自上海生命科学院细胞和生物化学研究所。培养基为L15,含10%的胎牛血清、100 U/mL青霉素、100 μg/mL链霉素,在饱和湿度、37℃、无CO2孵箱中培养,当细胞汇合至培养瓶底面积80%左右时进行传代培养。当细胞处于对数生长期时,以1×105个/mL浓度接种于25 cm2的培养瓶中或96孔培养板中。24 h后待细胞贴壁后给药,TSA组终浓度分别为50、100、200、400 nmol/L,DMSO组加入5 μL DMSO[DMSO浓度小于0.1%(V/V)],此浓度对细胞生长无影响。
1.3 MTT法检测细胞生长抑制率 取对数生长期细胞,以1×105个/mL接种于96孔板上,每孔200 μL,培养24 h后,分别加入不同浓度的TSA,各浓度组6复孔。培养48 h后,加入20 uL MTT(5 mg/ mL)孵育4 h。弃去培养液,加入150 μL二甲基亚砜,振荡15 min,使沉淀物充分溶解。用酶标仪490 nm测吸光度值(A值),测定细胞生长抑制率。公式如下:抑制率=1-加药组A值/对照组A值×100%。
1.4 RT-PCR方法检测p53、p21 mRNA表达 采用TRIzol一步法提取细胞总RNA,1%琼脂糖凝胶电泳检测RNA的完整性。用RNA PCR(AMV)Ver3.0试剂盒,按操作步骤进行逆转录和PCR。反转录条件42℃,30 min;99℃,5 min;5℃5 min。PCR引物序列:p53(5'-CAGCCAAGTCTGTGACTTGCACGTAC-3',5'-CTATGTCGAAAAGTGTTTCTGTCATC-3',292 bp);p21(5'-GGATGTCCGTCAGAACCCA-3',5'-CAGGTCCACATGGTCTTCC-3',399 bp);β– actin (5'-TGACGGGGTCACCCACACTGTGCCCATCTA-3',5'-CTAGAAGCATTTGCGGTGGACGATGGAGGG-3',661 bp)。循环条件:94℃预变性5 min;94℃30 s; p53 55.3℃;p21 58.5℃ 30 s;72℃ 50 s;30个循环;72℃终延伸10 min。取PCR产物10 μL进行琼脂糖凝胶电泳并拍照,应用EDAS290凝胶成像分析系统进行灰度测量。
1.5 Western blot方法检测p53、p21的蛋白表达用蛋白裂解液提取对数生长期细胞总蛋白,采用BCA蛋白浓度测定试剂盒测蛋白浓度,-20℃或-80℃保存备用。电泳前,加入2×SDS样品缓冲液,100℃煮沸5 min,离心后上样,10%SDS-PAGE电泳分离,然后将蛋白转至硝酸纤维素膜上,之后用含5%BSA的TBS(pH 7.4)将滤膜于室温摇动温育2 h进行封闭,封闭后的滤膜再分别与p53、p21抗体(稀释比为1∶200)、β-actin(稀释比为1∶1 000)4℃温育过夜。经TTBS洗涤后,HRP偶联的IgG作为二抗(稀释比为1∶5 000)室温温育2 h,洗膜后,使用ECL发光法显色。内参采用β-actin。计算机软件Image J进行密度分析,计算灰度值。
1.6 统计学方法 应用SPSS13.0统计软件,各组数据以s表示,多样本均数检验采用方差分析,以P≤0.05为差异有统计学意义。
2 结果
2.1 细胞生长抑制率检测结果 SW579细胞经不同浓度TSA(0、50、100、200、400 nmol/L)分别作用下,各组细胞抑制率随着药物浓度的升高而升高(P<0.01),分别为0、23.58%、32.39%、42.83%、74.03%,说明TSA各浓度组均可抑制细胞生长,且呈剂量依赖性。
2.2 RT-PCR结果 PCR产物琼脂糖凝胶电泳灰度测量分析表明,未加TSA组p53(0.190±0.002),p21(0.239±0.004)表达量较低。DMSO组p53 (0.216±0.001),p21(0.203±0.003)与未加TSA组比较差异无统计学意义。与未加TSA组比较,TSA在(50~400 nmol/L)浓度范围内p53的mRNA表达水平无明显提高,分别为0.212±0.001、0.211 ±0.001、0.249±0.001和0.268±0.001,且各组间无显著性差异(P>0.05)。而在TSA各浓度组p21的mRNA表达水平显著提高,且TSA在(50~400 nmol/L)浓度范围内灰度值分别为0.338±0.003、0.410±0.004、0.448±0.001和0.579±0.004,且有剂量依赖性。结果见图1、2。
2.3 Western blot结果 蛋白定量分析表明,未加TSA组p53(0.055±0.004),p21(0.287±0.004)表达量较低;与未加TSA组比较,TSA在(50~400 nmol/L)浓度范围内p53的蛋白表达水平明显提高,分别为0.146±0.008、0.267±0.004、0.298± 0.007和0.518±0.008,各组与对照组相比差异显著(P<0.05)。而TSA各浓度组随着TSA浓度的增加,p21蛋白表达量逐渐增多,且TSA在50~400 nmol/L浓度范围内灰度值分别为0.338±0.003、0.410±0.004、0.448±0.001和0.579±0.004,各组与未加TSA组相比差异均有统计学意义(P<0.05)。结果见图3。
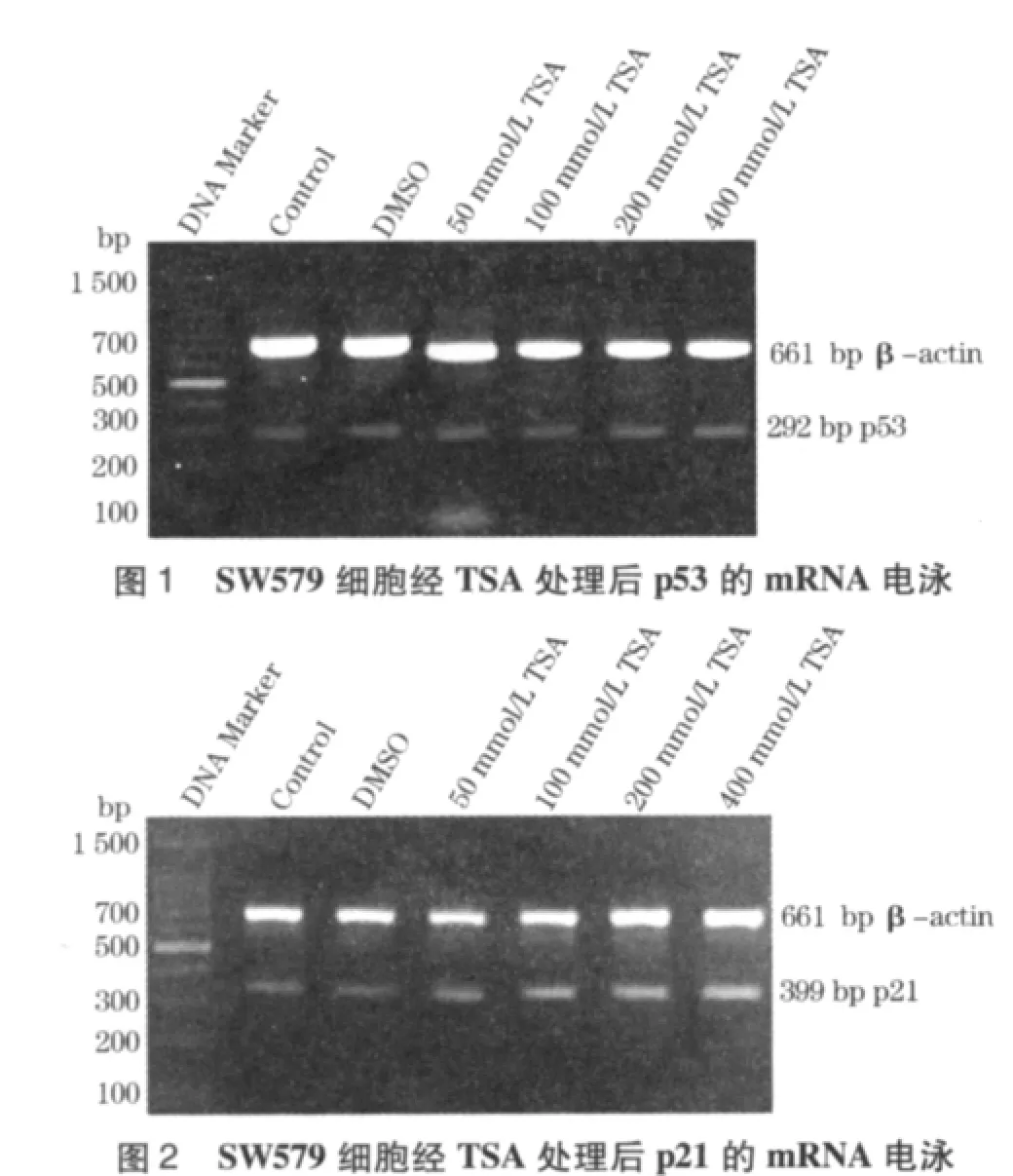
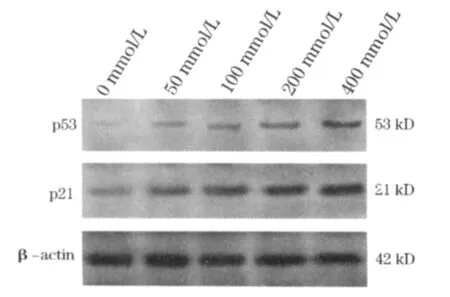
图3 SW579细胞经TSA处理后p53、p21蛋白的表达
3 讨论
TSA,以前被鉴定是抗真菌药物,抑制去乙酰化酶的活性。组蛋白乙酰化介导的转录有利于转录因子结合核DNA[5],表明组蛋白去乙酰化酶抑制剂能够促进p53依赖的下游基因Bax和p21waf1/Cip1的转录,结合p53基因转移比单独的p53基因转移更能有效地诱导细胞凋亡[6]。本实验结果表明,经50~400 nmol/L的TSA作用48 h后,TSA对SW579细胞的增殖均有显著的抑制作用,并呈剂量依赖效应。p53基因是重要的抑癌基因,野生型p53是细胞生长重要的负调节基因,维持细胞正常分化,抑制细胞增殖及癌变,同时也可诱导细胞凋亡。当DNA损伤或突变时,野生型p53积累,上调其下游p21靶基因表达[7]。本实验结果显示,TSA各浓度组作用SW579细胞之后,p53的mRNA水平变化不明显,蛋白表达水平随着浓度的增高显著上调,p53的mRNA水平未呈现与其蛋白水平一致的变化趋势,说明TSA可能通过调节p53的稳定性发挥作用。Nakajima等[6]报道250 nmol/L TSA作用于乳腺癌细胞株MDA-MB-231后对p53的mRNA和蛋白表达水平与对照组相比无明显差异。Sowa等[8]证明骨肉瘤细胞系MG63中TSA通过Sp1位点以p53非依赖的途径诱导p21WAF1/CIP1的转录激活,这与Li等[4]得出的TSA处理HeLa细胞时p53的表达改变的结论有所不同,分析可能由于不同实验室中细胞株由于较长时间培养基因背景发生改变所致,原因有待进一步分析。在何种情况下p53能够被TSA诱导表达并激活参与下游分子活性的调节是我们下一步的研究内容。
p21基因是p53基因的下游基因,在功能上继承了p53基因的抑癌作用,因此,p21作为抑癌基因是细胞周期重要的调控因子[9]。本实验结果显示,TSA各浓度组作用SW579细胞之后,p21的mRNA和蛋白表达水平显著上调,且随着TSA浓度的增大而增加,呈现剂量依赖性效应。Greenberg等[10]研究表明,TSA能抑制甲状腺癌ATC细胞株生长、促进其凋亡,阻滞细胞周期于G1和G2/M期,同时增加p21WAF1/CIP1及p27Kip1的表达,抑制Cyclins A、B的表达。本研究结果与上述报道一致,提示TSA抑制甲状腺鳞癌SW579细胞增殖的作用与上调p21表达水平有关。因此我们的研究认为TSA诱导内源p53表达增加时,增加的p53极可能通过直接作用于p21 WAF1/CIP1启动子上其效应元件而增强p21 WAF1/CIP1的表达,从而在TSA通过Sp1途径诱导p21 WAF1/CIP1转录激活中发挥协同作用,表明乙酰化修饰极可能是这些细胞系中p21 WAF1/CIP1表达沉默的分子基础。关于TSA对SW579细胞株的详细作用机制,本实验室仍在进一步研究之中。
[1]Wu ZQ,Zhang R,Chao C,et al.Histone deacetylase inhibitor trichostatin A induced caspase-independent apoptosis in human gastric cancer cell[J].Chin Med J(Engl),2007,120(23):2112-2118.
[2]Siavoshian S,Segain JP,Kornprobst M,et al.Butyrate and trichostatin A effects on the proliferation/differentiation of human intestinal epithelial cells:induction of cyclin D3 and p21 expression[J].Gut,2000,46(4):507-514.
[3]Seo JS,Cho NY,Kim HR,et al.Cell cycle arrest and lytic induction of EBV-transformed B lymphoblastoid cells by a histone deacetylase inhibitor,Trichostatin A[J].Oncol Rep,2008,19(1):93-98.
[4]Li H,Wu X.Histone deacetylase inhibitor,Trichostatin A,activates p21WAF1/CIP1 expression through downregulation of c-myc and release of the repression of c-myc from the promoter in human cervical cancer cells[J].Biochem Biophys Res Commun,2004,324(2):860-867.
[5]Struhl K.Histone acetylation and transcriptional regulatory mechanisms[J].Genes Dev,1998,12(5):599-606.
[6]Nakajima S,Niizeki H,Tada M,et al.Trichostatin A with adenovirus-mediated p53 gene transfer synergistically induces apoptosis in breast cancer cell line MDA-MB-231[J].Oncol Rep,2009,22 (1):143-148.
[7]Aneja R,Ghaleb AM,Zhou J,et al.p53 and p21 determine the sensitivity of noscapine-induced apoptosis in colon cancer cells[J].Cancer Res,2007,67(8):3862-3870.
[8]Sowa Y,Orita T,Minamikawa S,et al.Histone deacetylase inhibitor activates the WAF1/Cip1 gene promoter through the Sp1 sites[J].Biochem Biophys Res Commun,1997,241(1):142-150.
[9]Yao D,Alexander CL,Quinn JA,et al.Fos cooperation with PTEN loss elicits keratoacanthoma not carcinoma,owing to p53/p21 WAF-induced differentiation triggered by GSK3beta inactivation and reduced AKT activity[J].J Cell Sci,2008,121(Pt 10): 1758-1769.
[10]Greenberg VL,Williams JM,Cogswell JP,et al.Histone deacetylase inhibitors promote apoptosis and differential cell cycle arrest in anaplastic thyroid cancer cells[J].Thyroid,2001,11(4): 315-325.
