磁性温敏复合微球的制备及磁场中的释药行为
2012-03-07姚爱华艾凡荣王德平
姚爱华,陈 绮,艾凡荣,3,王德平
(1.同济大学材料科学与工程学院,上海201804;2.同济大学先进土木工程材料教育部重点实验室,上海201804;3.南昌大学机电工程学院,江西南昌330031)
肿瘤的磁热疗法是利用肿瘤细胞和正常细胞对热的敏感性不同,通过将磁性纳米粒子注射或植入肿瘤组织,然后在外加磁场的作用下产生热量,再将产生的热量传递给肿瘤组织,由于肿瘤中的血液供给不如正常组织充足,致使肿瘤细胞中热量扩散较慢,结果造成局部温度升高(一般控制在42~47°C之间),从而达到杀死肿瘤细胞的目的[1-3].由于磁性纳米粒子具有升温效应明显、给排方法简单、产热均匀等特点,在肿瘤热疗的研究中显示出越来越明显的优势.Fe3O4纳米粒子因具有较好磁热性能和良好的生物相容性,已被广泛用作肿瘤磁热疗的种籽材料[4-5].
将磁性纳米粒子与温度敏感性的聚合物复合而制备的兼有磁响应性和温度响应性的复合微球,即磁性温敏复合微球,可有效结合热疗的优势和靶向给药的特点,使肿瘤热疗与化疗相互促进,增强肿瘤的治疗效果,在肿瘤治疗领域具有广阔的应用前景[6-8].磁性纳米粒子赋予微球磁性,一方面可以在外加磁场的作用下定向运载药物到病变部位,同时磁性纳米粒子在交变磁场作用下使组织细胞升温至肿瘤热疗温度,在体内同步进行肿瘤的磁热疗.温敏性聚合物赋予微球温度响应性能,利用其在常温下的溶胀特性来装载药物,而在其最低临界溶解温度(LCST)上下实现收缩-溶胀的可逆转变,进而实现药物的可控释放.聚合物收缩-溶胀转变的热量由磁性纳米粒子提供,从而无需使用特殊的加温设备.为了实现上述目的,需要控制温敏性聚合物的LCST在肿瘤热疗的温度范围内(42~47°C).
聚(N-异丙基丙烯酰胺)(PNIPAAm)水凝胶及其共聚物是目前研究最多的温敏性聚合物,研究显示,纯N-异丙基丙烯酰胺(NIPAAm)水凝胶的LCST约为32°C,通过与亲水性更强的有机单体共聚可增加整个聚合物的亲水性,并增大聚合物与水分子之间的作用,从而提高其LCST[9].本文将NIPAAm与丙烯酰胺(Am)共聚,获得了LCST为42°C的温敏性聚合物,并采用无皂乳液聚合方法使其包覆在Fe3O4纳米粒子的表面,制备了Fe3O4/P(NIPAAm-co-Am)磁性温敏复合微球,研究了微球的结构、形貌及其在磁场作用下的磁热性能,并以维生素B12为模型药物,研究了复合微球在磁场作用下的药物释放过程.
1 实验部分
1.1 材料和测试
油酸,化学纯;FeCl3·6H2O,Na2SO3,浓氨水,过硫酸铵(APS),N,N-亚甲基双丙烯酰胺(MBA),均为分析纯,以上试剂均购于国药集团化学试剂有限公司,使用前未进行进一步的纯化处理;N-异丙基丙烯酰胺(NIPAAm),分析纯,购于百灵威化学试剂有限公司,使用前采用正己烷重结晶纯化;丙烯酰胺(Am),分析纯,购于国药集团化学试剂有限公司,使用前采用氯仿重结晶纯化.傅里叶变换红外光谱(FT-IR,Bruker EQUINOXSS),采用KBr粉末压片法进行测试;透射电镜(TEM,Hitachi H-800);振动样品磁强计(VSM,南京大学仪器厂LH-3),GW系列中频交变电流磁场发生器(南京大学仪器厂),频率范围为55~70kHz,最大磁场强度为7×103A·m-1;紫外-可见光分光光度计(JASCO V-570).
1.2 Fe3O4/P(NIPAAm co Am)磁性温敏复合微球的制备
首先采用部分还原共沉淀法制备的Fe3O4纳米粒子,并用油酸对其表面进行修饰,所得样品记为OA-Fe3O4,具体制备方法如文献[10]所述.量取2mL质量分数为1%的Fe3O4磁流体,分散于50 mL去离子水中,用浓氨水调节pH值至10,倒入三口烧瓶中,然后分别加入0.1g NIPAAm,0.003g Am,0.01g MBA.往溶液中充氮气鼓泡30min,以除去反应体系中的氧气,然后升温至70°C,加入0.1 mL质量分数为10%的APS浓液,反应7h后,磁分离产物,再分别用去离子水和无水乙醇洗涤3次,冷冻干燥,即得Fe3O4/P(NIPAAm-co-Am)复合微球.
1.3 P(NIPAAm co Am)共聚物LCST值的测定
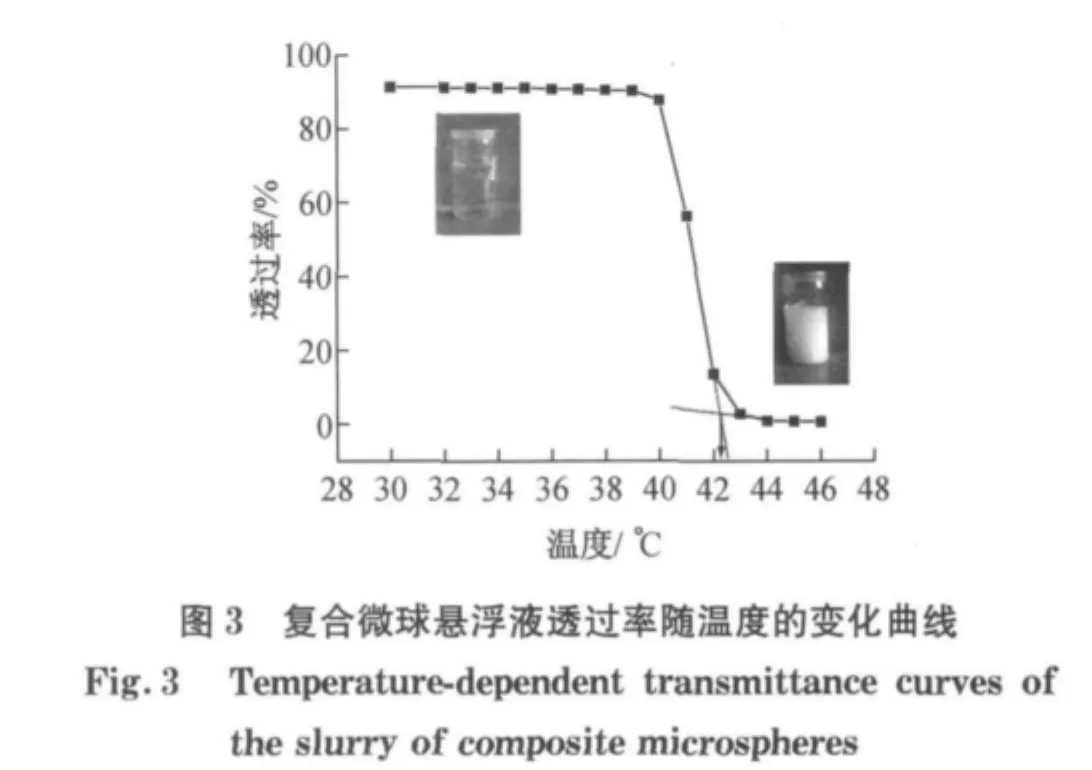
采用紫外-可见光分光光度计在500nm处测定不同温度下样品的透过率,升温速率为1℃·min-1,每个温度点停留2min读数,并绘制样品透过率随温度的变化曲线,曲线上透过率变化最大的点可确定为样品的LCST值.
1.4 维生素B12在复合微球中的装载及磁场作用下的释放过程
以维生素B12为药物模型.称取0.1g质量分数为10%的Fe3O4(OA-Fe3O4纳米粒子加入质量占有机单体质量的10%)复合微球样品,置于5mL离心管中,并在离心管中加入4mL质量浓度为1 mg·mL-1的维生素B12磷酸盐缓冲溶液(PBS)浓液,进行药物装载.药物释放过程测定:将上述载有维生素B12的载药微球浸泡于4mL PBS液中,并置于60kHz,6.5kA·m-1的交变磁场中,连续或间歇施加交变磁场.在“连续”实验中,持续施加磁场12 h,在此期间,每隔1h移取1mL PBS液,并补充相同体积的PBS液至4mL;而在“间歇”实验中,每3h施加交变磁场1h,待1h的磁场作用结束,移取1 mL PBS液,并补充相同体积的PBS液至4mL.用紫外-可见光分光光度计检测取出液在360nm处的吸光度,并计算维生素B12的浓度;根据溶液中维生素B12的浓度,计算不同时间的药物释放率,绘制释放曲线.
2 结果与讨论
2.1 磁性温敏Fe3O4/P(NIPAAm co Am)聚合物微球的结构和形貌
图1为OA-Fe3O4和Fe3O4/P(NIPAAm-co- Am)的红外图谱,图中586cm-1处较强的吸收峰为Fe3O4中Fe—O键的特征振动峰;2 969,2 927,2 851cm-1处的吸收带对应于—CH3和—CH2的对称和不对称伸缩振动.OA-Fe3O4的红外图谱中,1 710cm-1处的吸收峰归因于物理吸附在Fe3O4表面的油酸分子中C== O键的伸缩振动,而化学吸附在Fe3O4表面的油酸分子中的COO-因与Fe3+发生偶合作用,使其伸缩振动峰偏移至1 640cm-1附近[11].Fe3O4/P(NIPAAm-co-Am)的红外图谱中,—C(CH3)2的弯曲振动在1 365cm-1和1 386cm-1处分裂为双峰,1 642cm-1和1 548cm-1分别为酰胺Ⅰ和酰胺Ⅱ的特征吸收峰,由于—OH和N—H键的吸收峰重叠,在3 420cm-1处出现了宽泛的吸收峰.上述结果表明,P(NIPAAm-co-Am)共聚物已经成功包覆在Fe3O4的表面.
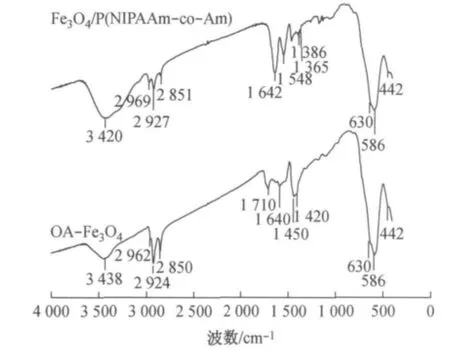
图1 油酸改性Fe3O4纳米粒子和聚合物微球的红外图谱Fig.1 FTIR spectra of OA-Fe3O4and the composite microspheres
2.2 P(NIPAAm co Am)共聚物的LCST值
聚(N-异丙基丙烯酰胺)(PNIPAAm)是一种常用的温敏性聚合物,因PNIPAAm大分子侧链上同时具有亲水性的酰胺基—CONH—和疏水性的异丙基—CH(CH3)2而显示出温度敏感特性[12].聚合物存在LCST,当外界温度低于LCST时,其分子链上的亲水基团与进入其内部的水分子形成氢键,使链段溶于水而发生溶胀,因此聚合物能够稳定而均匀地溶解于水.当温度升高达到聚合物的LCST时,氢键被破坏,链段的疏水性增强,单个微凝胶发生收缩,水分子被排出,同时这种疏水作用又导致分子链之间发生相互聚集,形成较大的聚集体.因而当温度升至LCST时,温敏聚合物溶液对光的折射、散射等作用会发生突变.因此,可通过测定不同温度下样品的透过率来确定其LCST值[13],利用此方法测定P(NIPAAm-co-Am)聚合物的LCST值,结果如图3所示.由图可知,所得共聚物的LCST值约为42°C,此温度恰好落在肿瘤热疗的温度范围内,因此将该共聚物与Fe3O4纳米粒子复合,有望同步实现肿瘤热疗和化疗药物的可控释放,增强治疗的效果.
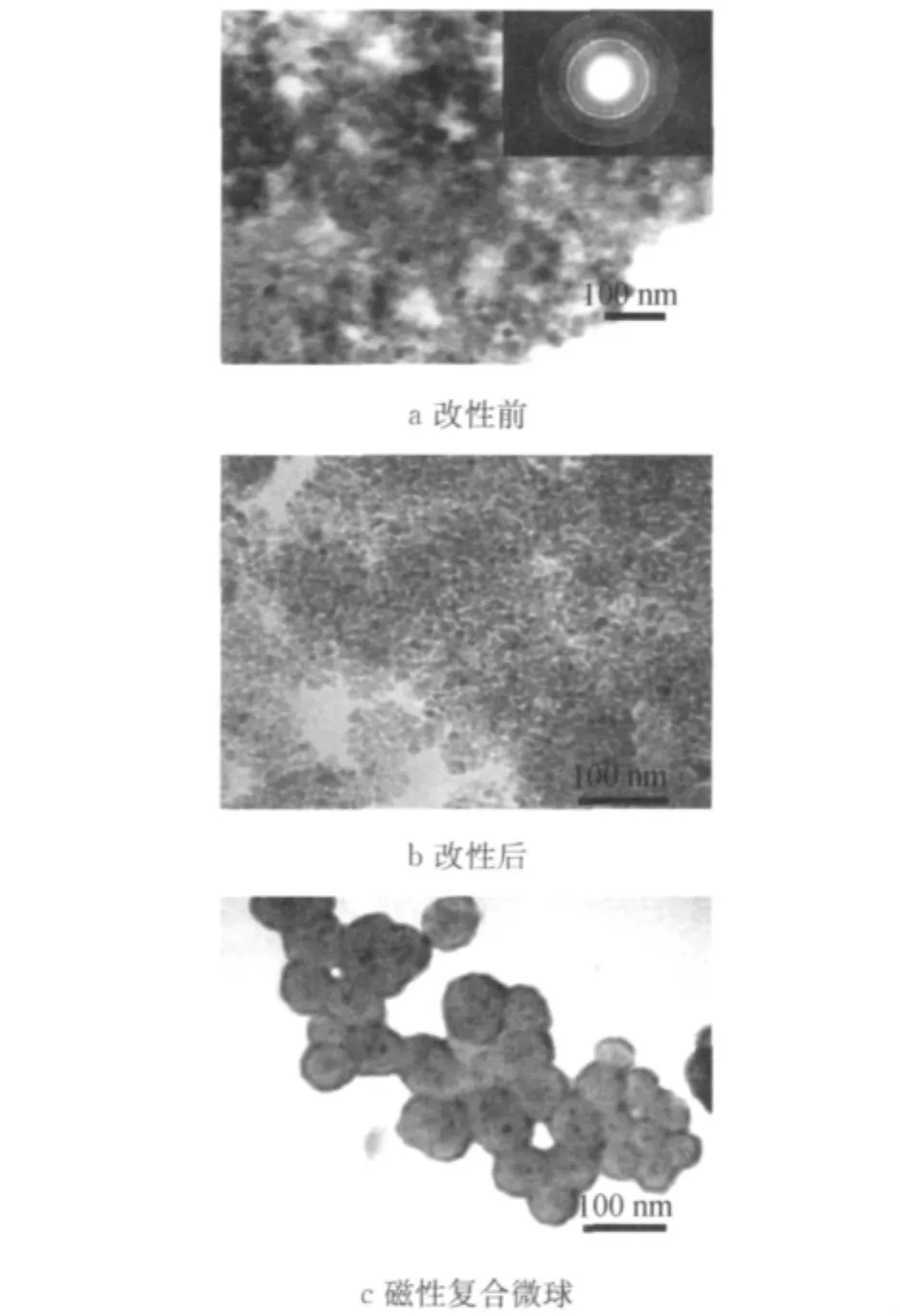
图2 油酸改性前后Fe3O4纳米粒子和磁性温敏复合微球的TEM图Fig.2 Transmission electron microscopy images of bare and OA-Fe3O4nanoparticles and the composite microspheres
2.3 Fe3O4/P(NIPAAm co Am)复合微球磁热性能
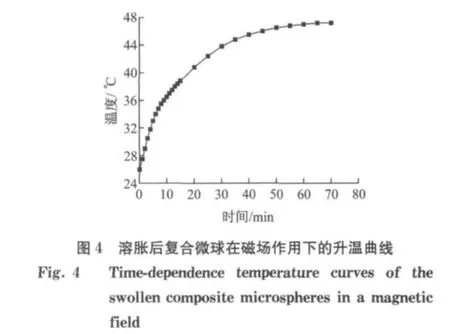
为了研究磁性温敏Fe3O4/P(NIPAAm-co-Am)复合微球在磁场作用下的热性能,将20mg充分溶胀的复合微球加入1mL去离子水中制成悬浮液,置于65kHz,6.5kA·m-1的交变磁场中,记录水温随时间的变化,结果如图4所示.图中显示水温在初始时间段内升高较快,20min内即升温至42°C左右,接近聚合物微球的LCST,此后由于材料产热和散热逐渐趋于平衡,使得温度变化趋于平缓.60min内升至47°C并维持不变.可见,复合微球内的磁性纳米粒子产生的热量能够满足肿瘤热疗的要求,且足以使温敏性聚合物P(NIPAAm-co-Am)因相变而收缩,从而实现药物释放.
2.4 磁性温敏聚合物微球的药物缓释研究
为了研究复合微球在磁场作用下的药物释放行为,将载有维生素B12的微球置于65kHz,6.5 kA·m-1的交变磁场中,分别研究了磁场持续作用和间歇作用的影响.图5为交变磁场持续作用下每小时的药物释放量及维生素B12的累积释放曲线.从图中可以看出,在药物释放初期存在突释现象,1h内药物的释放率达到49.4%,随后释放量逐渐减小,6h内药物的释放基本达到平衡,12h内的累积释放率约为69.0%.
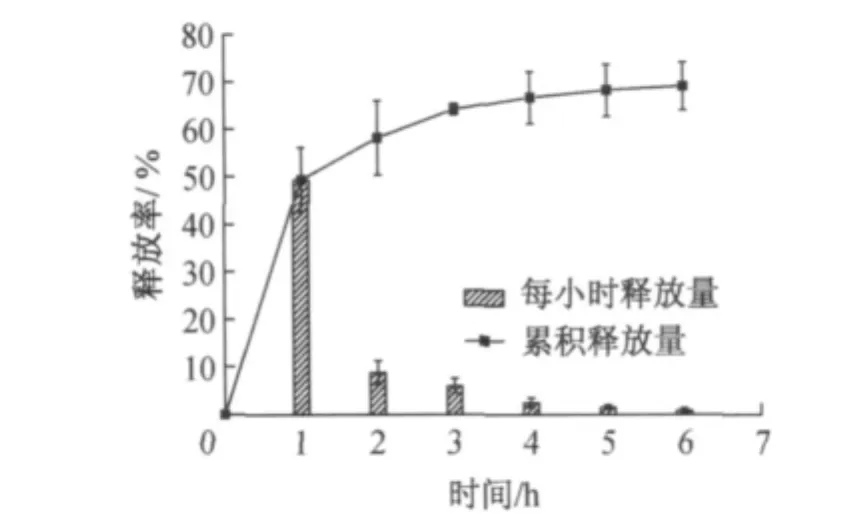
图5 交变磁场持续作用下药物缓释曲线Fig.5 VB12release behavior of composite microspheres exposed continuously to a magnetic field
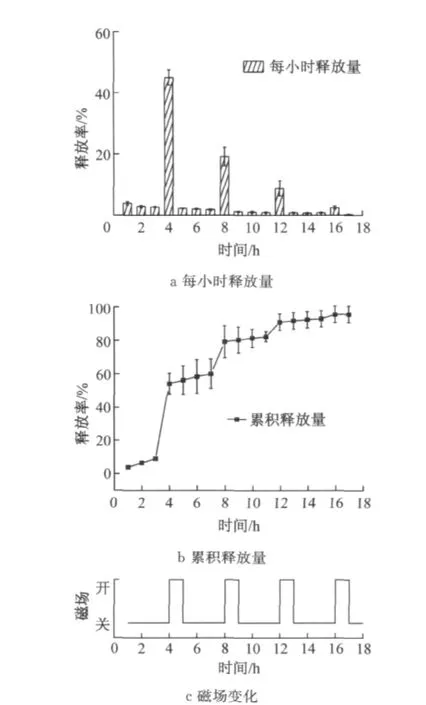
图6 交变磁场间歇性作用下药物释放曲线Fig.6 VB12release behavior of composite microspheres exposed to an intermittent magnetic field
图6a,b分别为间歇磁场作用下每小时的药物释放量及累积释放曲线.结果显示,当不施加磁场时,药物呈缓慢释放状态,施加磁场1h后药物的释放量急剧增加,但磁场进入间歇期,药物释放速率再度趋于平缓.随着磁场“开-闭”循环次数的增加,每次磁场作用下药物的释放量依次减小,由图6a可知,三次施加磁场时药物的释放量分别为45%,19%和9%,三次循环后药物的累积释放率达到90%以上(见图6b),远高于磁场持续作用下药物的累积释放率.
在交变磁场的作用下,复合微球内部的Fe3O4纳米粒子产生热量,并将热量传递给外层的温敏性聚合物,当温度达到聚合物的LCST时,聚合物由亲水态转变为疏水态,其分子内和分子间的疏水作用增强,酰胺基团与水分子之间的氢键被破坏,水分子从网络结构中排出,引起复合微球的体积收缩,从而使包封于聚合物中的药物因“挤压”效应被释放出来.相反,当磁场停止作用时,由于环境散热,温度回落,当低于聚合物的LCST时,聚合物恢复亲水状态,重新吸收水分而使自身溶胀,如此反复,即可实现图6b所示的脉冲式药物释放.而对于连续磁场作用的情况,复合微球无法实现溶胀-收缩的循环,药物的释放仅通过自由扩散作用,因此累积释放率较低.由此,将载有化疗药物的磁性温敏复合微球应用于肿瘤治疗,每次给药后可以间歇施加磁场,相对于化疗一次性给药,不仅可大大降低化疗药物的毒副作用,还可显著提高药物的累积释放率,提高疗效.
3 结论
(1)将NIPAAm与Am共聚,获得了LCST为42°C的温敏性聚合物,并通过无皂乳液聚合方法使其包覆在Fe3O4纳米粒子的表面,成功制备了具有核壳结构的Fe3O4/P(NIPAAm-co-Am)磁性温敏复合微球.
(2)所制备的复合微球显示出良好的磁热性能.在65kHz,6.5kA·m-1交变磁场作用下,20min内即使自身升高至42°C,60min内升至47°C并维持不变.微球所产生的热量能够满足肿瘤热疗的要求,且足以使外层的温敏性聚合物发生体积相变而实现药物释放.
(3)将载有维生素B12的微球置于交变磁场中,连续或间歇施加磁场,药物的释放行为明显不同.与连续施加磁场相比,间歇式施加磁场可延长药物的释放周期,提高药物的累积释放率.
[1] Müller S.Magnetic fluid hyperthermia therapy for malignant brain tumors—an ethical discussion[J].Nanomedicine:NBM,2009,5(4):387.
[2] Konishi K,Maehara T,Kamimori T,et al.Heating ferrite powder with AC magnetic field for thermal coagulation therapy[J].Journal of Magnetism and Magnetic Materials,2004,272-276:2428.
[3] Issels R D.Hyperthermia adds to chemotherapy[J].European Journal of Cancer,2008,44(17):2546.
[4] 陈琨,马明,顾宁.采用纳米磁性材料的肿瘤热疗技术[J].中国医疗器械杂志,2003,27(4):24.
CHEN Kun,MA Ming,GU Ning.Hyperthermia treatment of tumors with magnetic nanoparticles[J].Chinese Journal of Medical Instrumentation,2003,27(4):24.
[5] Jordan A,Scholz R,Maier-Hauff K,et al.Presentation of a new magnetic field therapy system for the treatment of human solid tumor with magnetic fluid hyperthermia[J].Journal of Magnetism and Magnetic Materials,2001,225(1-2):118.
[6] Zhang J,Misra R D K.Magnetic drug-targeting carrier encapsulated with thermosensitive smart polymer:core-shell nanoparticle carrier and drug release response[J].Acta Biomaterialia,2007,3(6):838.
[7] Zhang J L,Srivastava R S,Misra R D K.Core-shell magnetite nanoparticles surface encapsulated with smart stimuliresponsive polymer:synthesis,characterization,and LCST of viable drug-targeting delivery system[J].Langmuir,2007,23(11):6342.
[8] Wakamatsu H,Yamamoto K,Nakao A,et al.Preparation and characterization of temperature-responsive magnetite nanoparticles conjugated with N-isopropylacrylamide-based functional copolymer[J].Journal of Magnetism and Magnetic Materials,2006,302(2):327.
[9] Zhang X Z,Yang Y Y,Chung T S,et al.Preparation and characterization of fast response macroporous poly(N-isopropylacrylamide)hydrogels[J].Langmuir,2001,17(20):6094.
[10] 艾凡荣,姚爱华,黄文旵,等.磁场-温度双重响应性复合微球的制备与表征[J].高等学校化学学报,2010,31(9):1701.
AI Fanrong,YAO Aihua,HUANG Wenhai,et al.Preparation and characterization of composite microspheres with magnetic and temperature dual stimuli-responsive properties[J].Chemical Journal of Chinese Universities,2010,31(9):1701.
[11] Lan Q,Liu C,Yang F,et al.Synthesis of bilayer oleic acidcoated Fe3O4nanoparticles and their application in pH-responsive Pickering emulsions[J].Journal of Colloid and Interface Science,2007,310(1):260.
[12] 李晓卫,刘文广,朱敦皖,等.可注射温敏性聚合物的研究进展[J].高分子通报,2005(3):109.
LI Xiaowei,LIU Wenhuang,ZHU Dunwan,et al.Advances in injectable thermosensitive polymers[J].Polymer Bulletin,2005(3):109.
[13] Lee C F,Lin C C,Chien C A,et al.Thermosensitive and control release behavior of poly(N-isopropylacrylamide-coacrylic acid)/nano-Fe3O4magnetic composite latex particle that is synthesized by a novel method[J].European Polymer Journal,2008,44(9):2768.
