不同光质对韭菜生长及光合特性的影响
2012-02-23刘世琦孟凡鲁
陈 娴 刘世琦 孟凡鲁 张 涛 孙 齐
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部园艺作物生物学重点开放实验室,山东泰安 271018)
光是植物生命活动的能量来源,也是影响植物生长发育的重要环境因子之一。光质对植物的生长、形态建成、光合作用、物质代谢以及基因的表达均有调控作用。研究表明,蓝光可降低植物体内IAA 水平而抑制生长,红光可促进植物子叶伸长,抑制茎的过度生长;蓝光可促进烟草叶片中叶绿体发育基因的合成,但可被红光逆转(Richter &Wessel,1985)。Voskresenskaya等(1977)研究表明,蓝光较红光可提高豌豆叶片光能转化效率和电子传递速率;而增加光质中蓝光比例,可提高人参叶片的光合速率(洪佳华 等,1995)。储钟稀等(1999)以黄瓜为试验材料,发现红光处理的叶片与白光和蓝光处理相比,有较低的Chla/Chlb 值,生长在蓝光下的叶片叶绿素含量低于白光和红光下的含量,但蓝光下叶片Chla/Chlb 值最高。可见,光质对作物生长及光合作用的影响因植物种类不同而存在较大差异。
LED 光源与白炽灯、荧光灯和高压钠灯等传统人工光源相比具有光谱可调、寿命长、光谱纯、能耗低等明显优点(谢景 等,2012),适用于可控环境中的植物培养或栽培,如植物组织培养、设施园艺与工厂化育苗和航天生态生保系统等(刘立功 等,2009)。目前LED 光环境调控技术与机理研究已成为我国蔬菜栽培领域的重要课题。国内外研究结果均表明,不同光质对植物生长发育有不同的作用,大多数学者认为红蓝组合是植物生长的良好光源,但对于红蓝混合光比例大小对作物生长的影响研究还比较少见。
本试验通过LED 精量调制光质设不同红蓝光比例,研究其对韭菜(Allium tuberosumRottl.ex Spr.)生长、叶片光合作用和叶绿素荧光特性的影响,以期探明光质对韭菜生长形态和叶片光合特性的影响,为LED 光源在韭菜栽培上的应用提供理论依据。
1 材料与方法
1.1 试验材料及处理条件
供试韭菜品种:宽叶品种791 雪韭和窄叶品种紫根红。
处理条件:人造光源为红光(630~680 nm,吸收峰为660 nm;用T1 表示)、蓝光(450~500 nm,吸收峰为470 nm;用T2 表示)、(红/蓝)=(3/1)(灯的数量比,用T3 表示)、(红/蓝)=(7/1)(灯的数量比,用T4 表示)的发光二极管(LED),以发白光的普通光源为对照,由淄博曙光科技公司提供。距离光源50 cm处的光强为200 μmol·m-2·s1。光照培养架为钢架结构,光源设于顶部,高度可调。每个光质设3 次重复,各光质随机排列。不同光质图谱如图1所示。
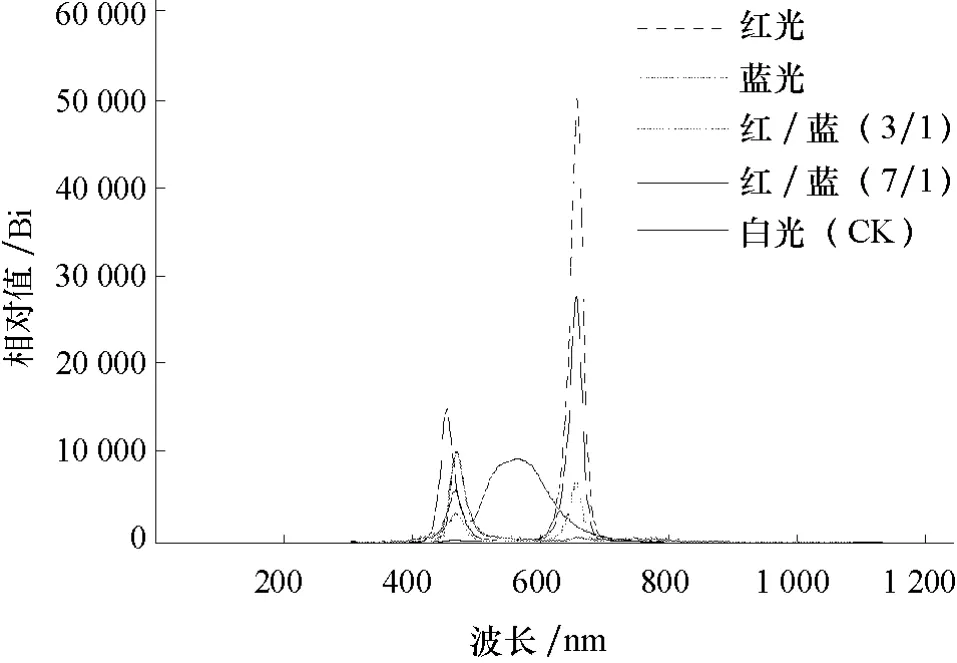
图1 不同光质图谱
1.2 试验方法
试验在山东农业大学蔬菜园艺试验站进行。将两个韭菜品种于2010年4月中旬直播于日光温室,播种量为2.75 kg·(667 m2)-1,田间常规管理。2011年3月中旬将温室培养的两个品种的韭菜剪根(留3 cm)去稍(留8 cm),移栽到装有基质的育苗盘(53 cm×25.5 cm×6 cm)中,每盘栽5 行,每行10 丛,每丛5 株。移栽30 d 割去第1 刀韭菜后将育苗盘转移到光质培养室,置于不同波长的光照下培养。每个处理12 盘,每个品种6 盘,采用完全随机排列,3 次重复。控制白天温度20~22 ℃,夜间8~10 ℃,每天光照12 h,生长过程精细管理。
生长量为处理30 d 的测定值。形态指标为50 株平均数,随机取样。根系活力采用TTC 法测定。叶绿素的测定按照Lichtenthaler(1998)对Arnon 修正的方法,采用80%丙酮浸提(邹琦,1995),并根据Arnon 公式计算叶绿素含量,3 次重复。
光合指标采用PP-Systems 公司生产的CIRAS-Ⅰ便携式光合仪测定,测定时光强为韭菜培养时的光强200 μmol·m-2·s-1,叶温为(25±1)℃,CO2气源为室外大气CO2。叶绿素荧光参数采用英国汉莎科学仪器公司生产的FM S-2 便携调制式荧光仪测定。在相同叶片测定荧光参数:初始荧光(Fo)、可变荧光(Fv)、暗适应下PSⅡ最大光化学效率(Fv/Fm)、最大荧光(Fm)、PSⅡ实际光化学效率(ΦPSⅡ)、光化学猝灭系数qP,每个处理重复测定3 次。
1.3 数据处理
应用DPS 3.01 软件进行数据分析,采用多重比较LSD 法进行方差显著性检验。
2 结果与分析
2.1 不同光质对韭菜生长量的影响
由表1 可知,光质对两个品种韭菜生长的影响趋势一致。不同品种株高依次为红光>红/蓝(7/1)>红/蓝(3/1)>白光>蓝光,红光处理791 雪韭和紫根红株高分别比对照高19.35%和19.68%。茎粗和叶宽均以红/蓝(7/1)处理最高,红光次之,蓝光处理最低。红/蓝(7/1)处理下791 雪韭和紫根红茎粗分别比对照高22.91%和33.24%。分蘖系数以红光处理最高,极显著高于其他处理。地上部干鲜质量比依次为红/蓝(7/1)>红光>红/蓝(3/1)>白光>蓝光,红/蓝(7/1)处理极显著高于其他处理。
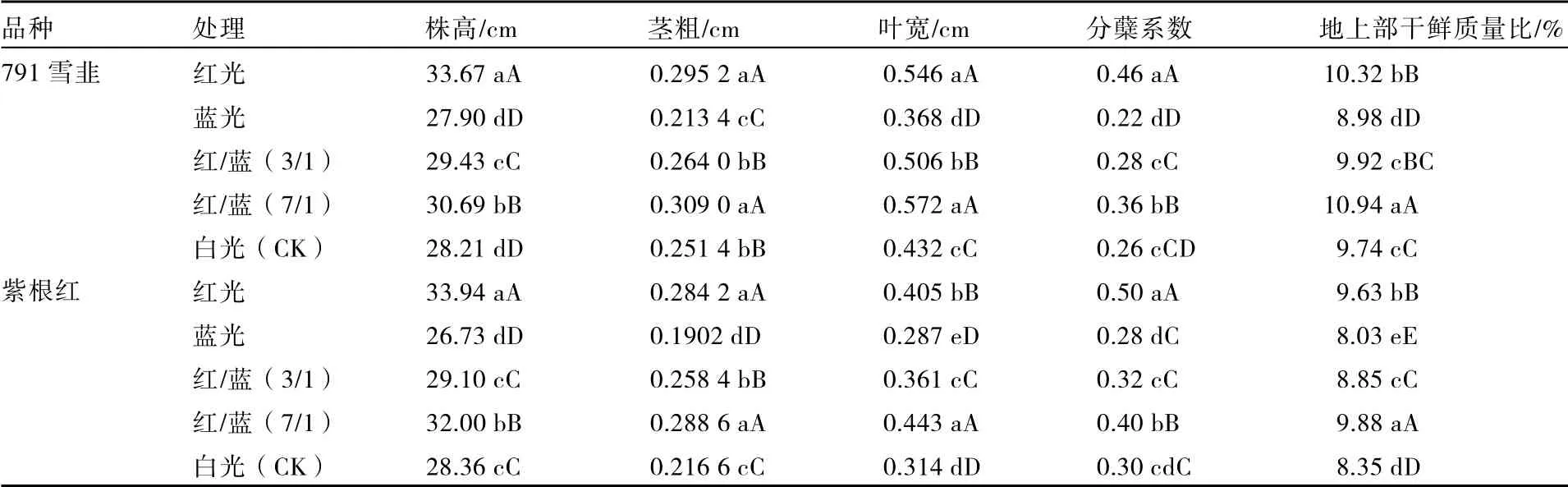
表1 不同光质对韭菜生长指标的影响
2.2 不同光质对韭菜根系活力的影响
图2 表明,两个品种韭菜根系活力对不同光质的响应趋势一致,依次为红/蓝(7/1)>红光>红/蓝(3/1)>白光>蓝光。结合表1和图2 分析发现,红/蓝(7/1)处理下韭菜根系活力高,茎较粗,地上部干物质含量高,植株健壮,光合产物的分配更有利于韭菜生长健壮。
2.3 不同光质对韭菜叶绿素和类胡萝卜素含量的影响
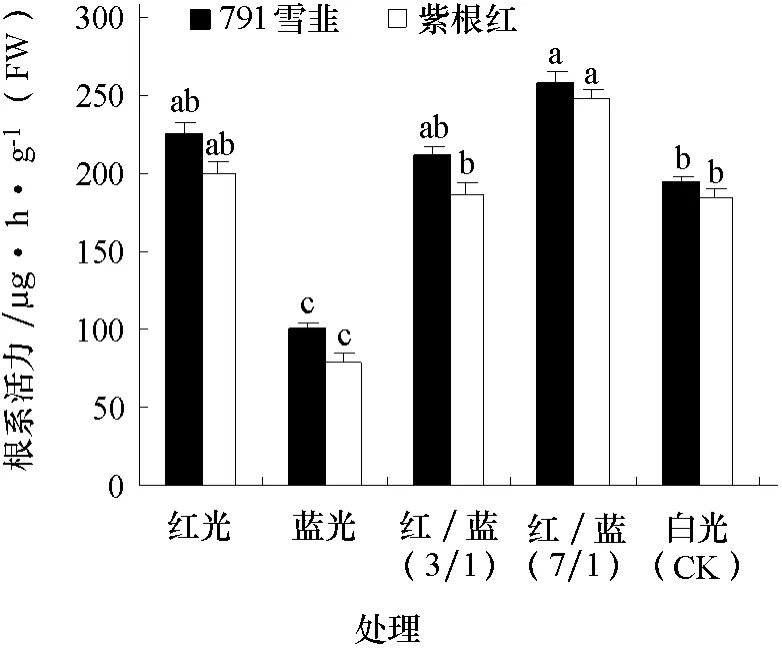
图2 不同光质对韭菜根系活力的影响
表2 表明,不同光质处理对两个品种韭菜叶绿素和类胡萝卜素含量的影响趋势基本一致。叶片中叶绿素a(除紫根红外)、叶绿素b、叶绿素(a+b)和类胡萝卜素含量均为红光>白光>红/蓝(3/1)>红/蓝(7/1)>蓝光,且红光处理显著高于其他4 个处理。紫根红叶片中叶绿素a 含量:红光>白光>红/蓝(7/1)>红/蓝(3/1)>蓝光,紫根红叶片中叶绿素a/b 值:红光>白光>红/蓝(7/1)>红/蓝(3/1)>蓝光,791 雪韭叶片中叶绿素a/b 值:红光>白光>红/蓝(3/1)>红/蓝(7/1)>蓝光,除红光处理显著高于其他处理外,各处理间差异不显著。
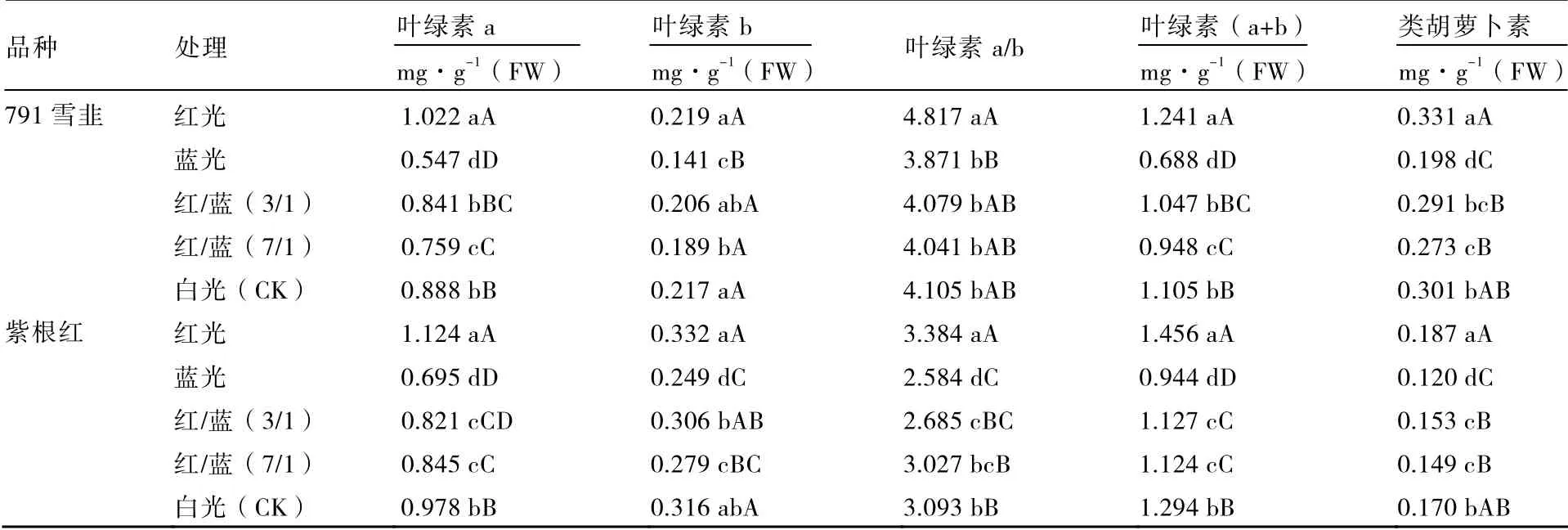
表2 不同光质对韭菜叶片叶绿素和类胡萝卜素含量的影响
2.4 不同光质对韭菜光合特性的影响
由表3 可以看出,不同光质处理下两个品种韭菜光合速率均以红/蓝(7/1)处理显著高于其他处理,其次为红/蓝(3/1),蓝光处理最低。红/蓝(7/1)和红/蓝(3/1)处理下791 雪韭叶片的光合速率分别比对照高57.47%和19.78%;紫根红叶片光合速率在红/蓝(7/1)和红/蓝(3/1)处理下分别比对照高65.44%和39.82%。两个品种蒸腾速率变化均依次为红/蓝(7/1)>红/蓝(3/1)>红光>白光>蓝光,红/蓝(7/1)处理下791 雪韭和紫根红叶片蒸腾速率分别比对照高59.70%和53.33%。791 雪韭叶片气孔导度大小:红/蓝(7/1)>红/蓝(3/1)>红光>白光>蓝光;紫根红叶片气孔导度大小:红/蓝(7/1)>红/蓝(3/1)>白光>红光>蓝光,两个品种韭菜叶片气孔导度变化趋势表现为品种间差异性。两个品种韭菜胞间CO2浓度均以蓝光处理最高,白光次之,红/蓝(7/1)最低,胞间CO2浓度大小与叶片光合速率大小呈相反趋势。
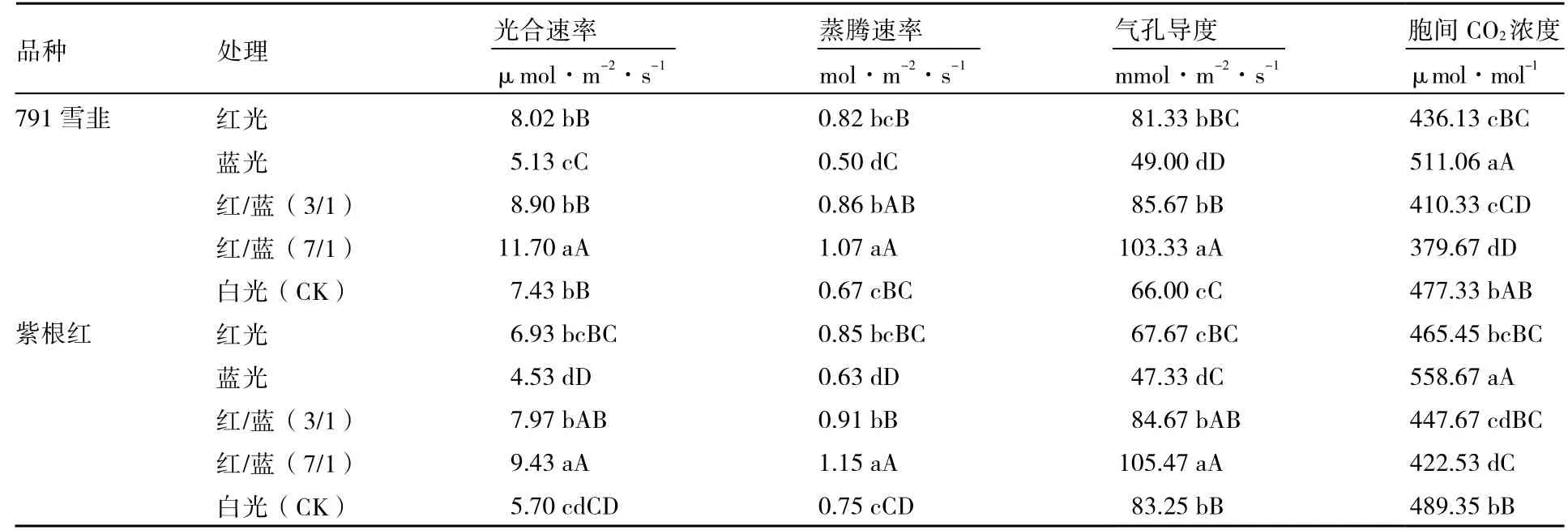
表3 不同光质对韭菜光合特性的影响
2.5 不同光质对韭菜荧光特性的影响
表4 显示,不同光质处理对两个品种韭菜荧光参数的影响趋势一致。Fv/Fm 和Fv/Fo 大小均依次为红/蓝(7/1)>红/蓝(3/1)>红光>白光>蓝光,ФPSⅡ和qP 大小依次为蓝光>白光>红/蓝(3/1)>红/蓝(7/1)>红光。
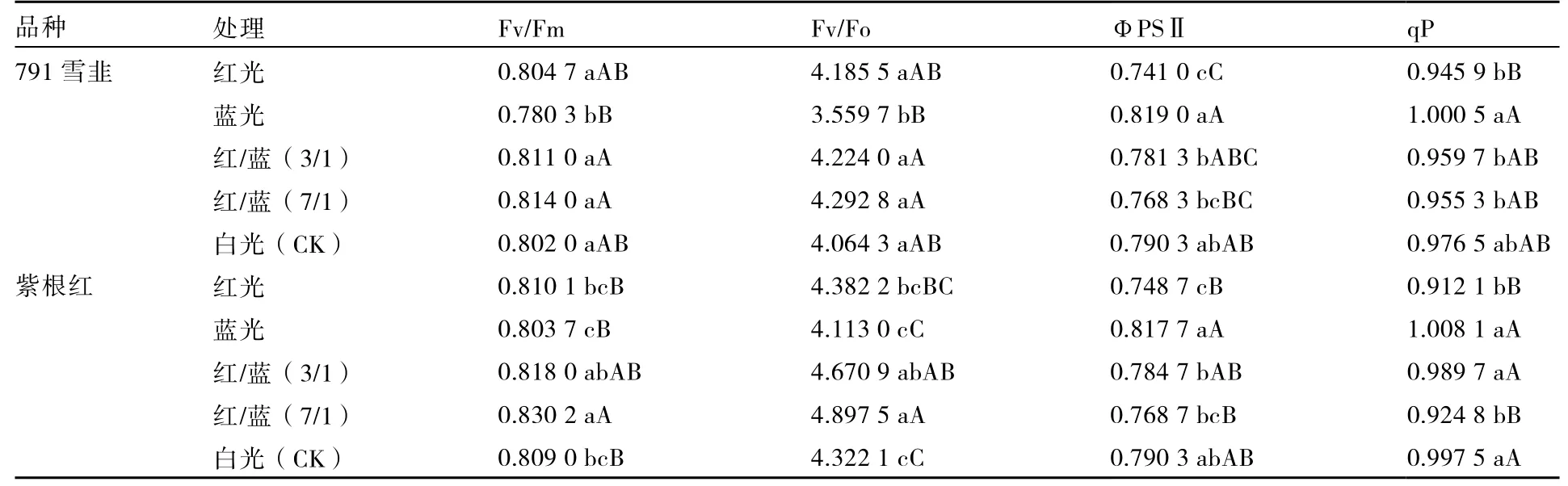
表4 不同光质对韭菜叶片Fv/Fm、Fv/Fo、ΦPSⅡ、qP 的影响
3 结论与讨论
植物能通过光受体感受光质与光强的微妙变化,这些光受体通过信号传递途径来改变发育中的形态建成(Ward et al.,2005)。本试验结果表明,不同比例红蓝混合光和单纯红光对韭菜株高、茎粗、叶宽都有不同程度的促进作用,而蓝光抑制,这与杜洪涛等(2005)、张立伟等(2010)的研究结果一致。蓝光抑制韭菜伸长生长的作用机理可能是:蓝紫光能提高吲哚乙酸(IAA)氧化酶的活性,降低IAA 水平,进而抑制植物的伸长生长。在分子水平上,红光促进细胞伸长,而蓝光具有相反效果。分蘖数是韭菜特有的生长指标,其分蘖能力强弱直接影响产量的高低,红光下韭菜有较强的分蘖能力,且分蘖能力强弱与红光比例大小呈正相关。韭菜干鲜质量比以红/蓝(7/1)处理最高,红光次之,蓝光最小,说明红光可以促进韭菜干物质积累,蓝光则相反,这与Voskresenskaya 等(1977)、齐连东等(2007)的研究结果一致。而本试验结果还显示低比例的蓝光与红光混合比单纯红光对韭菜同化产物积累更有利,这可能是由于单色光之间具有互补和加性效应。
光是影响光合色素合成的重要条件,不同波长的光与植物体内相应的光受体作用,调控色素合成。本试验研究表明,红光明显促进了韭菜叶片叶绿素的形成,蓝光抑制,这与徐凯等(2005)在草莓上的研究结果一致。而Anna 和Alicja(2001)研究发现,蓝光促进风信子愈伤组织叶绿素的形成,而红光降低叶绿素含量,这可能是由于固体组织培养条件下愈伤组织叶绿素形成的光响应机制与正常生长条件下不同所致。不同光处理下韭菜叶片中Chla/b 值除红光处理高于对照外,不同比例红蓝混合光和蓝光处理均低于对照,这与储钟稀等(1999)在黄瓜上的结论不一致,但与车生泉等(1997)、杨晓健等(2011)的研究结果相同,这可能与不同作物对光质的反应不同有关。
前人研究表明,在相同光量子通量密度下,红光处理的青蒜苗叶片光合速率Pn 较高(杨晓健 等,2011),绿光处理的生姜叶片Pn 较高(张瑞华 等,2008),而蓝紫光处理的人参叶片Pn 最高(洪佳华 等,1995)。可见不同作物Pn 对光质的反应不同。李韶山和潘瑞炽(1993)研究认为红光和远红光可在转录水平上调节光合机构的组装,从而影响植物的光合作用,而不同植物由于生理特性和组织结构不同,其光合机构对适应不同光质的调控机理也有所不同。本试验不同品种韭菜叶片Pn 均表现为红/蓝(7/1)>红/蓝(3/1)>红光>白光>蓝光,蓝光处理明显低于其他处理,其原因可能是蓝光透过的光谱中红光含量较少,而光合作用的主要色素叶绿素的吸收峰在红光区。不同光处理韭菜叶片蒸腾速率和气孔导度与Pn 变化趋势一致,表明红蓝混合光有利于韭菜叶片的光合作用,且光合作用大小与红蓝光比例具有相关性。光质变化可以影响叶片解剖结构及光合细胞器结构(Eskins et al.,1985),从而影响植物叶片对光能的吸收利用效率,这可能是红蓝混合光处理韭菜叶片Pn 较高的主要原因。
叶绿素荧光是研究环境变化对植物PSⅡ光合机构管理的探针。Ramalho 等(2002)研究表明,不同光源的光质影响咖啡叶片PSⅡ的光化学效率及电子传递速率;储钟稀等(1999)报道,红光处理下黄瓜叶片 PSⅡ活性和 PSⅡ原初光能转化效率最高。本试验中两个品种韭菜叶片Fv/Fo 和Fv/Fm 值均以红/蓝(7/1)处理最高,表明红/蓝(7/1)处理下有较高的PSⅡ反应中心活性和原初光能转换效率;蓝光处理下叶片的ФPSⅡ和qP 均最高,表明蓝光有利于韭菜叶片PSⅡ反应中心电子传递。试验结果表明红光、蓝光对韭菜叶片PSⅡ的发育过程起调控作用,但作用机理还有待进一步探究。
车生泉,盛月英,秦文英.1997.光质对小苍兰茎尖试管培养的影响.园艺学报,24(3):269-273.
储钟稀,童哲,冯丽洁,张群,温晓刚,宋森田,朱孝凤.1999.不同光质对黄瓜叶片光合特性的影响.植物学报,41(8):867-870.
杜洪涛,刘世琦,蒲高斌.2005.光质对彩色甜椒幼苗生长及叶绿素荧光特性的影响.西北农业学报,14(1):41-45.
洪佳华,马月华,刘明孝,王铁生,王化民,孟繁莹.1995.光强、光质对人参光合的影响.中国农业气象,16(1):19-22.
李韶山,潘瑞炽.1993.植物的蓝光效应.植物生理学通讯,29(4):248-252.
刘立功,徐志刚,崔瑾,张欢.2009.光环境调控及LED 在蔬菜设施栽培中的应用和前景.中国蔬菜,(14):1-5.
齐连东,刘世琦,许莉,于文艳,梁庆玲,郝树芹.2007.光质对菠菜草酸、单宁及硝酸盐积累效应的影响.农业工程学报,23(4):201-204.
谢景,刘厚诚,宋世威,孙光闻,陈日远.2012.光源及光质调控在温室蔬菜生产中的应用研究进展.中国蔬菜,(2):1-7.
徐凯,郭延平,张上隆.2005.不同光质对草莓叶片光合作用和叶绿素荧光的影响.中国农业科学,38(2):369-375.
杨晓健,刘世琦,张自坤,刘忠良,马琳,张宇.2011.不同LED 光源对青蒜苗生长及叶绿素荧光特性的影响.中国蔬菜,(6):62-67.
张立伟,刘世琦,张自坤,杨茹,杨晓健.2010.不同光质下香椿苗的生长动态.西北农业学报,19(6):115-119.
张瑞华,徐坤,董灿兴.2008.光质对生姜叶片光合特性的影响.中国农业科学,41(11):3722-3727.
邹琦.1995.植物生理生化实验指导.北京:中国农业出版社:36-38.
Anna B,Alicja K.2001.Effect of light quality on somatic embryogenesis inHyacinthus orientalisL.‘Delft’s blue’.Biological Bulletin of Poznan,38(1):103-107.
Eskins K.Duysen M.Dybas L.1985.Light quality effects on corn chloroplast development.Plant Physiology,77:29-34.
Lichtenthaler H K.1988.Applications of chlorophyll fluorescence.Dordrecht:Kluwer Academic Publishers:129-142.
Ramalho J C,Marques N C,Semedo J N,Matos M C,Quartin V L.2002.Photosynthetic performance and pigment composition of leaves from two tropical species is determined by light quality.Plant Biology,4(1):112-120.
Richter G,Wessel K.1985.Red light inhibits blue light-induced chloroplast development in cultured plant cells at the mRNA level.Plant Molecular Biology,5(3):175-182.
Voskresenskaya N P,Drozdova I S,Krendeleva T E.1977.Effect of light quality on the organization of photosynthetic electron transport chain of pea seedling.Plant Physiol,59(2):151-154.
Ward J M,Cufr C A,Denze M A,Neff M M.2005.The Dof transcription factor OBP3 modulates and cryptochrome signaling in Arabidopsis.Plant Cell,17:475-485.
