大肠杆菌共表达LeGGPS2、LePSY1和crtI基因合成番茄红素
2012-02-09陈吉裕蒲志群肖雅文李翠萍杜小兵苏承刚张兴国
陈吉裕,蒲志群,肖雅文,李翠萍,杜小兵,苏承刚,张兴国
南方山地园艺学教育部重点实验室 西南大学园艺园林学院, 重庆 400715
番茄红素是抗氧化能力最强的一种类胡萝卜素[1],可预防心血管疾病、多种癌症和一些慢性病发生,近年来成为医学、营养学和食品学研究的热点[2]。番茄和番茄制品是人们摄取番茄红素的重要来源。然而,传统育种和核转基因途径在丰量提高番茄的番茄红素含量上均存在难度[3-4]。大量研究表明,质体转基因具有表达效率高、不存在共抑制和位置效应、可多顺反子表达等优点[5]。如果在番茄果实的质体中建立一条与核基因同步表达的番茄红素合成途径,则可能突破提高番茄红素含量的技术瓶颈。但番茄质体转化耗时长、难度大,而且真核基因要在质体中表达,必须进行原核化改造。由于质体起源于蓝细菌,除部分基因存在内含子外,其基因的结构与表达机制仍保留原核特性[6];而且质体基因可以在细菌中表达,细菌的启动子和终止子等控制元件也可以在质体中行使功能[7]。因此,预先将原核化的番茄红素合成基因在原核细胞中进行功能验证,可以避免质体转化的技术风险。
利用大肠杆菌等原核生物发酵制备番茄红素,具有高效和副产物少等优点,已得到深入研究[8-9]。大肠杆菌不能合成进入番茄红素合成途径的前体物质牛儿基牛儿基焦磷酸(GGPP),但能产生合成GGPP的前体物质法尼基焦磷酸 (FPP), 牻 牻故需导入包括 牛儿基 牛儿基焦磷酸合成酶基因在内的多个外源基因才能塑建番茄红素合成途径[10]。目前应用最多的是来自欧文氏菌Erwinia uredovora 牻的分别编码 牛儿基牻牛儿基焦磷酸合成酶、八氢番茄红素合成酶和八氢番茄红素脱氢酶的crtE、crtB和crtI基因[11]。不仅获得了合成番茄红素的高产菌株[10-12],而且所建立的原核表达模式还可以用来验证新克隆的相关基因的功能[13-14]。除采用野生型crtE、crtB和crtI基因外,利用Lac乳糖操纵子[8]和T7/T7RNAP转录系统[15]可以更高效地促进和调控番茄红素合成。由于真核化的 T7/T7RNAP系统是目前最具有发展潜力的质体转基因高效表达调控系统[16-17],因此,本文利用T7/T7RNAP原核表达系统来验证由番茄LePSY1和LeGGPS2基因及欧文氏菌 crtI基因构成的 T7::crtILeGGPS2-LePSY1::Ter多顺反子结构的功能。结果显示,添加上核糖体结合位点 (rbs) 的LePSY1和LeGGPS2的cDNA序列及crtI的编码区序列,单独或组合后受控于T7启动子和终止子,在含有T7RNAP基因的大肠杆菌菌株BL21 (DE3) 中能够表达出预期大小的目的蛋白,且表达的LePSY1和LeGGPS2蛋白可协同crtI酶催化合成番茄红素。该研究证实了原核化的 LePSY1和LeGGPS2基因的功能,获得了利用 T7::crtILeGGPS2-LePSY1::Ter基因簇合成番茄红素的大肠杆菌菌株,为今后利用该基因簇在番茄质体中建立番茄红素合成途径奠定了基础。
1 材料与方法
1.1 材料
番茄Solanum lycopersicon L. cv Ailsa Craig和含有crtI基因的pMD-crtI载体由重庆大学陈国平教授惠赠。大肠杆菌菌株 XL1-Blue和 BL21 (DE3) 购自北京鼎国生物技术有限责任公司。载体pET32a (+) 购自Novagen公司。SanPrep柱式DNA胶回收试剂盒、柱式质粒小抽提量试剂盒购自上海生工生物工程有限公司,并委托该公司合成引物和测序。工具酶购自宝生物 (大连) 工程公司。IPTG (异丙基-β-D-硫代吡喃半乳糖苷) 为Sigma公司产品。其他所需试剂均为国产分析纯。
1.2 LeGGPS2、LePSY1和crtI基因的克隆及其表达载体构建
用Plant RNAzol试剂 (鼎国生物技术有限责任公司) 从番茄红熟果实中提取总 RNA,经M-MLV逆转录酶和Oligo (dT21)引物合成cDNA第一链。参照番茄品种Moneymaker 牻的 牛儿基牻牛儿焦磷酸合成酶基因 LeGGPS2 (GenBank Accession No. DQ267903) 序列设计PCR引物1和引物2,用PrimStar HS DNA聚合酶从cDNA中扩增1 109 bp大小片段。PCR反应条件为:95 ℃变性2 min,1个循环;95 ℃变性10 s,50 ℃退火20 s,72 ℃延伸1 min 20 s,3个循环;95 ℃变性10 s,57 ℃退火20 s,72 ℃延伸1 min 20 s, 27个循环;72 ℃延伸10 min。PCR产物电泳分离和纯化后,用NdeⅠ酶切20 h,再经85 ℃水浴变性5 min后立即冰浴2 min,使切下的9 bp片段呈单链,而1 099 bp的片段保持双链结构;如此处理,既省时又避免电泳纯化带来DNA损失。将该酶切产物与pET32a(+) 载体经Hind Ⅲ酶切后补平,再经NdeⅠ酶切后电泳分离和纯化的5 384 bp片段按3∶1的比例混合,用T4 DNA连接酶于 16 ℃连接 16 h,转化大肠杆菌XL1-Blue感受态细胞,用引物2和引物3 (位于载体T7启动子的上游) 从Amp抗性平板上筛选 PCR产物为 1 202 bp大小的阳性克隆pT7-LeGGPS2 (6 483 bp),再经酶切和测序鉴定。
用引物 4和引物 5自 pMD-crtI中扩增1 498 bp大小的八氢番茄红素脱氢酶基因 crtI;PCR反应条件为:95 ℃变性2 min,1个循环;95 ℃变性10 s,50 ℃退火20 s,72 ℃延伸1 min 30 s,3个循环;95 ℃变性10 s,61 ℃退火30 s,72 ℃延伸 1 min 40 s,27个循环;72 ℃延伸10 min。PCR产物纯化后,用NdeⅠ酶切,再经变性使9 bp小片段单链化后,将1 489 bp的片段与上述pET32a (+)载体的酶切大片段连接,转化大肠杆菌XL1-Blue感受态细胞,用引物5和引物3筛选PCR产物为1 592 bp大小的Amp抗性阳性克隆pT7-crtI (6 873 bp),再经酶切和测序鉴定。
参照番茄 Ailsa Craig的八氢番茄红素合成酶基因LePSY1 (GenBank Accession No. Y00521、X60441和M84744) 序列设计引物6和引物7,自上述cDNA中扩增1 248 bp大小带;PCR反应条件为:95 ℃变性2 min,1个循环;95 ℃变性10 s,52 ℃退火20 s,72 ℃延伸1 min 30 s,3个循环;95 ℃变性10 s,57 ℃退火30 s,72 ℃延伸1 min 20 s,27个循环;72 ℃延伸10 min。PCR产物纯化后,用NheⅠ酶切,再经变性使8 bp小片段单链化后,将1 240 bp的片段与pT7-crtI载体经Nde I酶切后补平、再经Nhe I酶切后的5 394 bp片段相连接,转化大肠杆菌 XL1-Blue感受态细胞,用引物7和引物3筛选PCR产物为1 352 bp大小的Amp抗性阳性克隆pT7-LePSY1 (6 634 bp),再经酶切和测序鉴定。
pT7-crtI载体经 NheⅠ和 XhoⅠ酶切后,回收6 850 bp大片段,与pT7-LeGGPS2的XbaⅠ和XhoⅠ酶切1 154 bp小片段相连,得到重组载体pT7-crtI-LeGGPS2。该载体经NheⅠ和XhoⅠ酶切后,回收7 984 bp大片段,与pT7-LePSY1的XbaⅠ和XhoⅠ酶切1 305 bp小片段相连,得到重组载体pT7-crtI-LeGGPS2-LePSY1。该载体经Hind Ⅲ酶切,回收8 563 bp大片段,自环化后得到重组载体 pT7-crtI-LePSY1。其中,二价和三价基因表达载体同其单基因表达载体一样,均由T7启动子和T7终止子 (Ter) 控制,且每个基因带有独立和相同的核糖体结合位点 (图2A)。所有载体均经过PCR扩增和酶切鉴定。

表1 引物序列Table 1 Primer sequences
1.3 目的基因的原核表达分析
将 构 建 的 pT7-LeGGPS2、 pT7-crtI、pT7-LePSY1、 pT7-crtI-LePSY1、 pT7-crtILeGGPS2-LePSY1和对照载体pET32a (+) 分别转化进BL21 (DE3) 后,在LB含100 mg/L Amp培养基中培养过夜,作为种子液。在初始表达条件下,即将种子液以1∶50接种于20 mL含Amp 100 mg/L的LB培养基中,37 ℃摇菌8 h后,加IPTG至20 μmol/L,30 ℃表达6 h离心收集菌体,观察是否显红色,分析蛋白表达水平;对能产生番茄红素的菌株进行优化发酵条件。
1.4 番茄红素的提取及测定方法
1.4.1 标准曲线制定
按国标GB/T14215-93方法,以苏丹Ⅰ替代易被氧化的番茄红素制作标准曲线。所得图1标准曲线的回归方程为:A=0.2340C+0.0014,R2=0.9999;其中A为485 nm处的吸光度值,C为番茄红素浓度。
1.4.2 菌液干重的测定
取菌液1 mL至已称重 (精确至0.0001 g) 的1.5 mL离心管中,13 000 r/min离心3 min收集菌体,弃上清液,用灭菌水洗1次,105 ℃干燥至恒重,重复3次。所得质量差为1 mL菌液的干重。
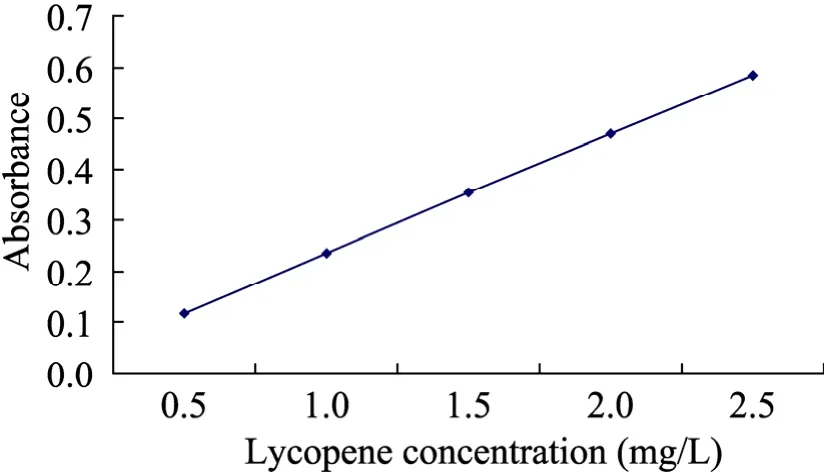
图1 番茄红素浓度与485 nm吸光度的标准曲线Fig. 1 Standard curve between lycopene concentration and absorbance at 485 nm.
1.4.3 番茄红素的提取与测定
收集2 mL菌液的菌体,用灭菌水洗1次,加 400 μL丙酮,黑暗中 50 ℃浸提 15 min,13 000 r/min离心10 min收集上清液,重复浸提1次。将提取液按适当比例稀释,测定在485 nm波长处的吸光度值。按所得回归方程计算出番茄红素量,以mg/g DCW (Dry cell weight) 单位表示。
1.5 培养条件的优化
取 5 mL过夜培养的菌液至 50 mL含100 mg/L Amp的LB培养基中再培养约8 h,以获得足够量的种子液。在相同种子液及初始表达条件 (同 1.3) 下摸索培养条件,均重复3次。
1.5.1 最佳诱导时期和表达时间的筛选
取种子液400 μL接入装有20 mL附加3%蔗糖和 100 mg/L Amp的 LB培养基的三角瓶(100 mL) 中。分别在摇菌6 h、8 h、10 h、12 h时加IPTG至20 μmol/L,再于30 ℃诱导5 h,取样提取番茄红素,确定最佳诱导时期。
采用上述方法接种,37 ℃摇菌8 h时加IPTG至20 μmol/L,再于30 ℃诱导3 h、5 h、7 h、9 h时取样提取番茄红素,确定最佳表达时间。
1.5.2 适宜碳源及其浓度的筛选
在LB培养基中分别添加30 g/L葡萄糖、蔗糖、麦芽糖,筛选出适宜碳源。在含1%、3%、5%、7%适宜碳源的LB中,筛选出适宜的工作浓度。
1.5.3 适宜培养温度的确定
摇菌8 h后加IPTG至20 μmol/L,分别在25 ℃、30 ℃、37 ℃诱导5 h,取样提取番茄红素,确定适宜的培养温度。
1.5.4 培养基适宜pH值的确定
将加3%蔗糖的LB培养基的pH值分别调至6.4、6.6、6.8、7.0、7.2,摇菌8 h后加IPTG至20 μmol/L,诱导培养5 h后提取番茄红素,确定适宜的pH值。
1.5.5 IPTG适宜浓度的筛选
摇菌8 h后分别添加IPTG至0、20、40、60、80、100 μmol/L,诱导5 h后,取样提取番茄红素,筛选最佳IPTG诱导浓度。
1.6 SDS-PAGE电泳
将分别含pET32a (+) 与构建的5个载体的菌株,用1.3所述方法于50 mL培养基和37 ℃培养8 h后,各取500 μL至1.5 mL灭菌离心管中作为非诱导对照,在剩余菌液中加 IPTG至0.5 mmol/L,两者再同时于30 ℃诱导10 h。将诱导后的菌液于8 000 r/min离心10 min收集菌体,加5 mL PBS缓冲液洗1次,再离心弃上清液,加5 mL PBS缓冲液重悬,以功率为15%开3 s关4 s的方式于冰上超声波破碎25 min。将破碎后的菌液于8 000 r/min离心10 min,取其上清1 mL至1.5 mL离心管中再经16 000 r/min离心20 min,取10 μL作为上清液样本;同时取其沉淀少量至新的离心管中,加10 μL无菌水,作为细胞碎片样本。另外,将非诱导对照离心后,取少量沉淀加无菌水,作为未诱导样本。将三者加上样缓冲液后煮沸10 min,进行SDS-PAGE电泳,经考马斯亮蓝染色后拍照。
2 结果与分析
2.1 重组载体与目的基因表达水平
测序结果显示,crtI基因序列完全同预期;LeGGPS2与番茄品种Moneymaker的LeGGPS2有7个碱基的差异,所推导的氨基酸序列之间有2个残基的不同;而LePSY1完全同M84744,但不同于Y00521和X60441的序列,且由pT7-crtI载体的NdeⅠ酶切补平端与引物6的5′端相连后,恢复NdeⅠ位点及该基因的翻译起始密码子ATG (序列略)。pT7-crtI-LePSY1、pT7-crtI-LeGGPS2和 pT7-crtI-LeGGPS2-LePSY1载体 (图 2A) 经PCR扩增和酶切检测,均鉴定为阳性 (结果略)。
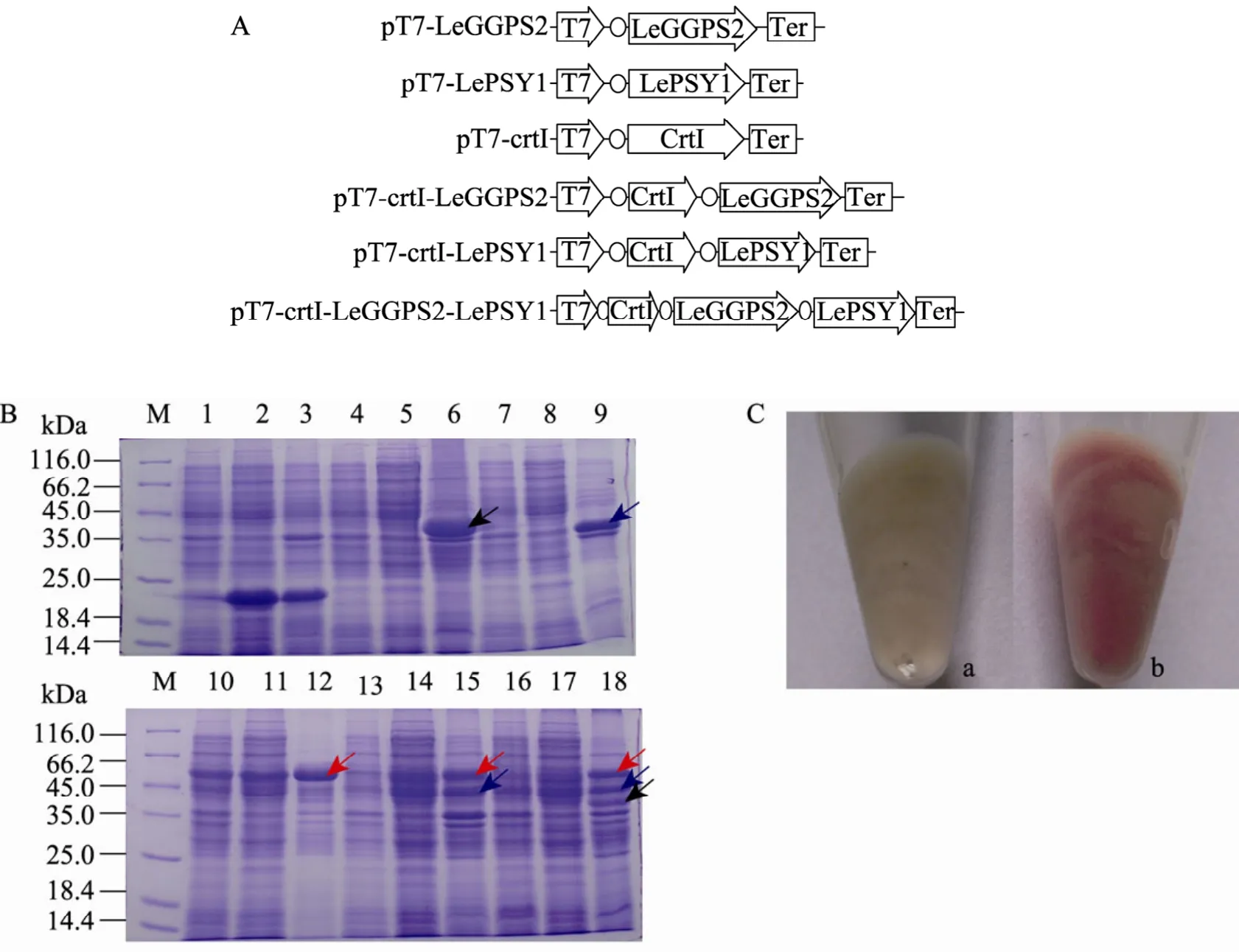
图2 载体结构与目的基因的表达Fig. 2 Physical maps of vectors and the expression of the target genes. (A) Physical maps of the vectors. (B) Protein profiles of the gene expression from the five constructed vectors and pET32a(+) as a control. (C) IPTG induced lycopene synthesis. T7: T7 promoter; LeGGPS2: tomato geranylgeranyl pyrophosphate synthase gene 2; crtI: phytoene dehydrogenase gene of Erwinia herbicola; LePSY1: tomato phytoene synthesase gene 1; o (before the genes in the map): ribosome binding site; Ter: T7 terminator; M: protein molecular weight marker; 1−3: pET32a(+); 4−6: pT7-LeGGPS2; 7−11: pT7-LePSY1; 10−12: pT7-crtI; 13−15: pT7-crtI-LePSY1; 16−18: pT7-crtI-LeGGPS2-LePSY1; 1,4,7,10,13,16: whole cell lysates without IPTG induction; 2,5,8,11,14,17: soluble supernatants with IPTG induction; 3,6,9,12,15,18: insoluble cell debris with IPTG induction; a: pET32a(+); b: pT7-crtI-LeGGPS2-LePSY1.
经IPTG诱导表达后,对照pET32a(+) 无目的条带,而分别含有 pT7-LeGGPS2、pT7-crtI、pT7-LePSY1、 pT7-crtI-LePSY1、 pT7-crtILeGGPS2-LePSY1载体的工程菌均有宽且亮的目的条带 (箭头所指),说明目的蛋白均得到表达;其中,LeGGPS2、LePSY1和crtI表达的蛋白分别为39.019 kDa、46.745 kDa和54.839 kDa,均与预期大小相符。未诱导的与诱导后的菌体同样有相应的表达蛋白带,但前者明显比后者弱。各菌诱导后,3个目的基因表达的蛋白在沉淀中比在上清液中的带要亮,说明有较多的目的蛋白形成了包涵体 (图2B)。
发酵结果显示,仅含 pT7-crtI-LeGGPS2-LePSY1的菌株经诱导后收集的菌体呈红色,而含其他载体的菌株诱导培养后均为菌体本色(图2C),表明仅含有pT7-crtI-LeGGPS2-LePSY1的菌株能合成番茄红素。
2.2 诱导时期和表达时间对番茄红素含量的影响
表2可见,培养6 h时,即在工程菌处于对数生长中期时诱导,番茄红素含量相对来说最低;培养8 h时诱导,番茄红素含量最高,此时OD600值在3.00左右,且菌体生长处于对数生长后期;培养10 h和12 h时,菌体OD600值均接近5.00,即细菌生长处于稳定期,此时诱导的番茄红素含量虽比在对数生长中期诱导的番茄红素含量多,但明显比在对数生长后期诱导时的含量少。因此,含有pT7-crtI-LeGGPS2-LePSY1的工程菌表达番茄红素时添加IPTG诱导的最佳时期为对数生长后期。
如表3所示,摇菌8 h时添加IPTG诱导后的0~5 h内,番茄红素含量随时间延长而增加,且于5 h时达到最高,但随后反而减少。这可能是由于诱导5 h后菌体衰老,代谢废物增加,pH值改变,影响了番茄红素合成和稳定。因此,IPTG诱导5 h是最佳诱导时间。
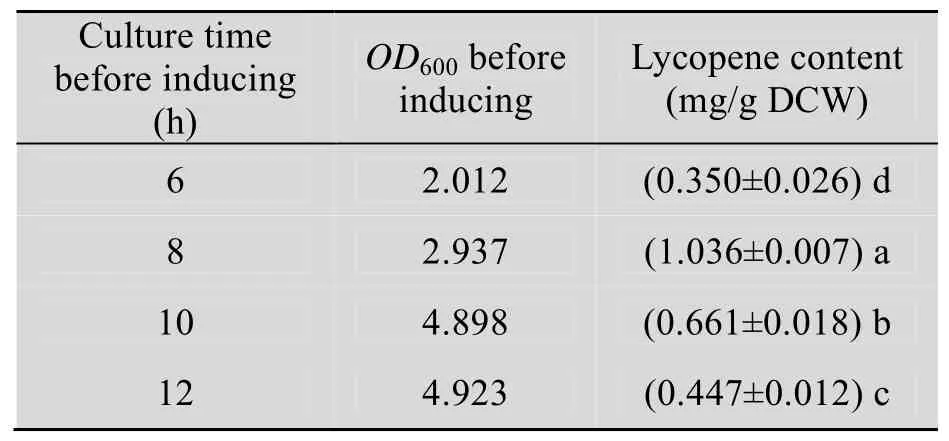
表2 诱导时期对番茄红素含量的影响Table 2 Effects of the inducing phases on the lycopene content of the bacteria
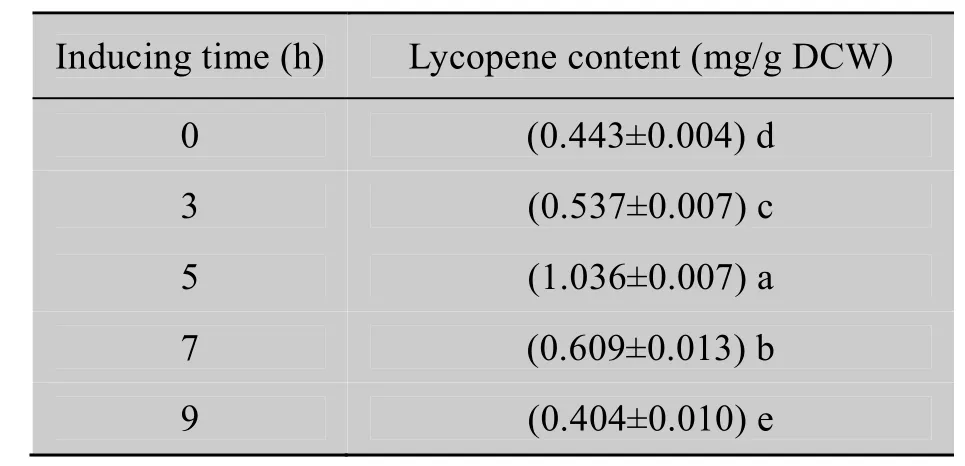
表3 诱导时间对番茄红素含量的影响Table 3 Effects of the inducing time on the lycopene content of the bacteria
2.3 碳源及其浓度对番茄红素含量的影响
由表4可见,工程菌在添加葡萄糖和麦芽糖的培养基中生长速度比在添加蔗糖中的快,但前两者培养的菌体的番茄红素含量远远低于以蔗糖为碳源的菌体的番茄红素含量,故选择蔗糖作为该工程菌的适宜碳源。
蔗糖含量从1%到5%时,每升菌液干重也随之增长,但当蔗糖含量到7%时,菌体干重反而减少,而番茄红素含量以 3%蔗糖时为最高(表5)。
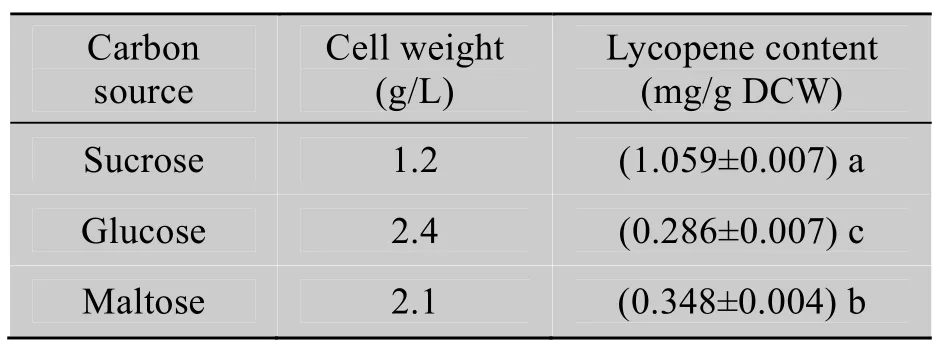
表4 不同碳源对番茄红素含量的影响Table 4 Effects of different carbon sources on the lycopene content of the bacteria
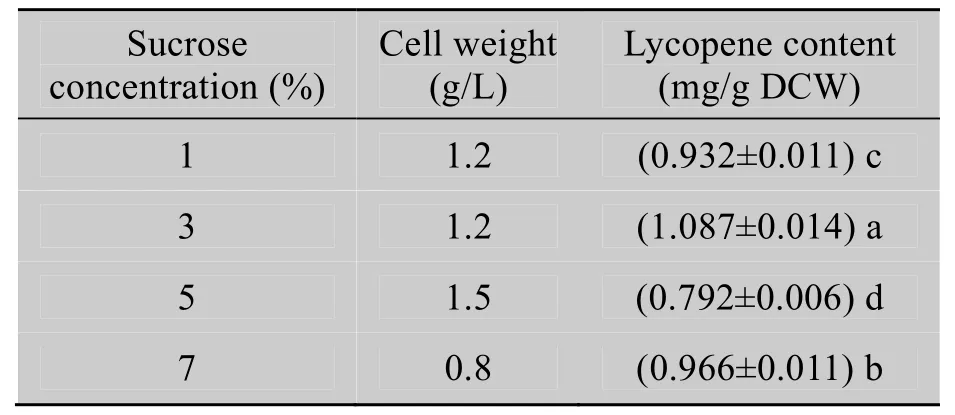
表5 蔗糖浓度对番茄红素含量的影响Table 5 Effects of sucrose concentration on the lycopene content of the bacteria
2.4 培养温度对番茄红素含量的影响
表6显示,30 ℃培养条件下,工程菌产生的番茄红素量最高。25 ℃培养时菌体干重与在30 ℃时差别不大,但番茄红素含量明显偏低;37 ℃培养时的菌体最多,但番茄红素含量最低。
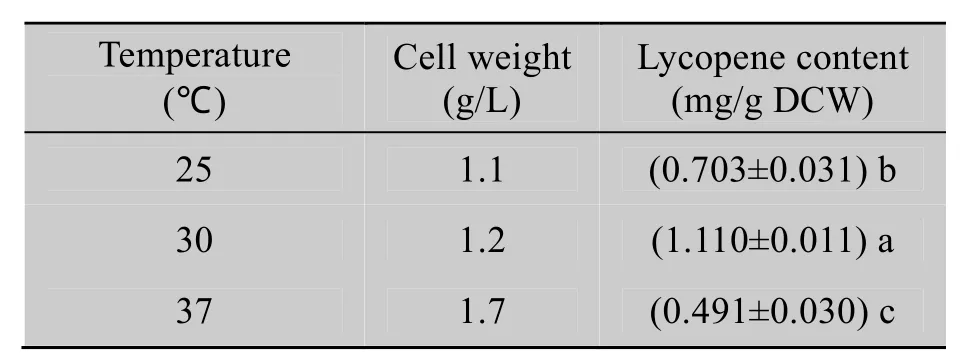
表6 培养温度对番茄红素含量的影响Table 6 Effects of culture temperature on the lycopene content of the bacteria
2.5 培养基pH对番茄红素含量的影响
工程菌在所设的5个pH值的培养基中均能正常生长,但pH在6.6以下时,不利于番茄红素合成;pH 6.8时,番茄红素产量最高;pH值在7.0和7.2时略有降低 (表7)。
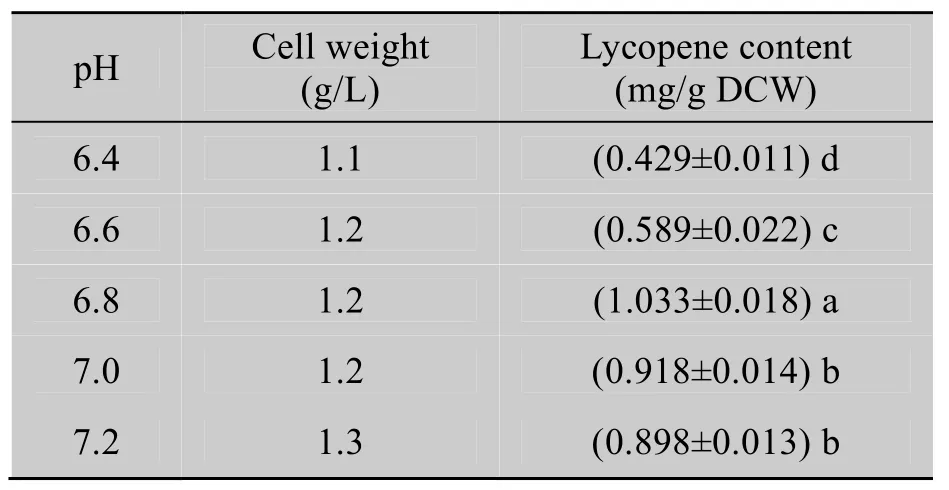
表7 培养基pH值对番茄红素含量的影响Table 7 Effects of pH value of the medium on the lycopene
2.6 IPTG浓度对番茄红素含量的影响
表8可见,IPTG不加时存在泄露;0~60 μmol/L范围内,番茄红素含量随IPTG浓度的增加而增加,至80 μmol/L时达到最高,但加至100 μmol/L时又降低。这可能和T7强启动子、酶的活性和可溶性有关。
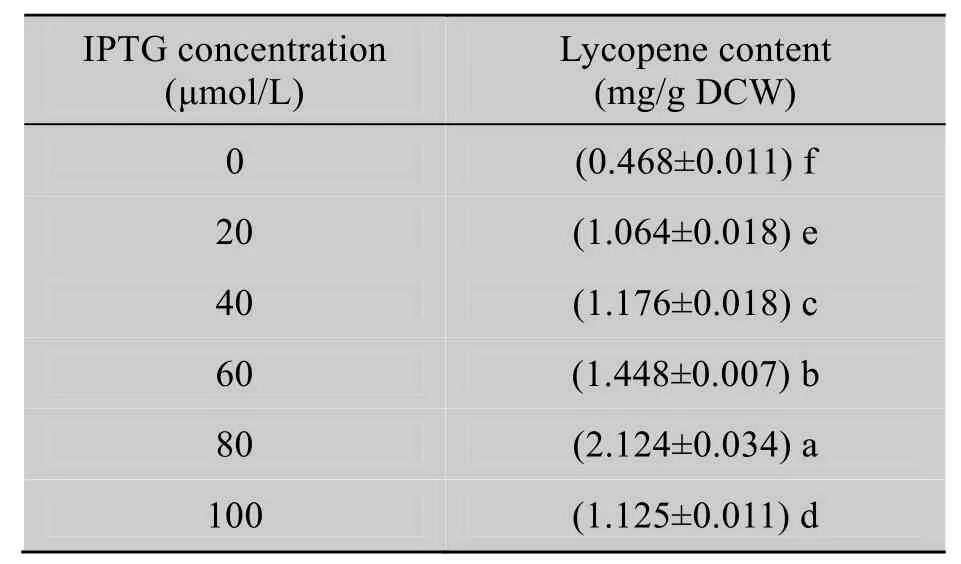
表8 IPTG浓度对番茄红素合成的影响Table 8 Effects of IPTG concentration on the lycopene content of the bacteria
3 讨论
本研究将由 T7启动子控制的 LeGGPS2、LePSY1、crtI、crtI-LePSY1和 crtI-LeGGPS2-LePSY1基因 (图2A) 分别转化进大肠杆菌BL21 (DE3) 菌株中,均能表达出预期大小的目的蛋白 (图2B),但仅crtI-LeGGPS2-LePSY1共表达时才能合成番茄红素 (图2C),表明这3个基因的共表达盒构建正确,而且真核基因LeGGPS2和LePSY1在组织结构和表达方式上得到了正确的原核化转换,所表达的蛋白具有预期的功能。由于原核细胞和植物质体的基因表达机制具有相似性,因此,如果今后将 T7::crtI-LeGGPS2-LePSY1::Ter基因导入番茄质体,并通过整合进核基因组的、表达后定位于质体的T7RNAP专一性诱导表达,可望在番茄质体中建立一条完整的番茄红素合成途径,促进番茄红素的合成。
本研究利用 T7::crtI-LeGGPS2-LePSY1::Ter基因在BL21 (DE3) 中和优化的发酵条件下合成番茄红素的最高含量为2.124 mg/g DCW。该水平虽然比 Matthews等直接利用野生型crtE-crtB-crtI基因簇获得的 (160±32) μg/g DCW的产量高[18],但比刘敏等采用T7/T7RNAP系统表达crtE-crtB-crtI基因簇获得的5.8 mg/g DCW产量低[15],更显著低于 Alper等的 18 mg/g DCW[10]和Yuan等的22 mg/g DCW[12]。究其原因,既可能是由于T7/T7RNAP系统活性过强,所表达的LeGGPS2、LePSY1和crtI蛋白较多地形成了包涵体 (图 2B),也可能是由于合成番茄红素的前体物质FPP不足而引起的[18]。其中,前者的解决方法可以通过降低IPTG使用浓度或采用弱启动子以降低目的蛋白的表达水平,或改善目标酶的可溶性;后者可以通过导入dxs[19]、idi[8]等基因来增加FPP量,或者按Vadali等的方式,在菌株中建立甲羟戊酸途径以协同已存在的非甲羟戊酸途径来促进前体物合成[17]。此外,LeGGPS2和LePSY1在番茄中为质体定位蛋白,在被转运进质体并切除质体定位信号肽后方能成为成熟蛋白,但在本研究中是否由于原核表达未切除该信号肽而导致2个酶的活性及工程菌株合成番茄红素的能力偏低,尚有待证实。
本研究结果显示,菌体处于对数生长后期时用IPTG进行诱导比较适合 (表2),可能是因为该时期的细胞处于“活力”最旺的时期,菌体生长、代谢和蛋白合成能力比较旺盛,中间代谢物比较稳定,有丰富的代谢中间产物用于番茄红素合成。这与Ruther等研究玉米黄素原核合成的结果相一致[20]。值得注意的是,在未添加IPTG诱导时,含T7::crtI-LeGGPS2-LePSY1基因的工程菌能表达一定量的目的蛋白 (图 2B),也能合成番茄红素 (表8),表明T7/T7RNAP表达系统存在泄露;这与刘敏等[15]利用带有T7启动子和欧文氏菌crtE、crtB、crtI的BL21 (DE3) 表达番茄红素情况相似。此外,本研究添加的IPTG浓度极低 (表8),只需0.08 mmol/L即可,而高浓度的IPTG反而不利于合成番茄红素。Kim等发现不添加IPTG的本底表达即可满足合成番茄红素所需蛋白,而添加IPTG后反而使得番茄红素产量变低[8]。Yoon等也发现无 IPTG 诱导crtE-crtB-crtI表达合成的番茄红素量是用0.1 mmol/L的IPTG诱导合成量的2倍[9]。这可能是由于目的蛋白表达过量或过快时容易形成包涵体所致 (图2B)[8-11]。
本研究的工程菌在以蔗糖为碳源时,番茄红素含量最高 (表 4),但蔗糖浓度并非越高越好(表5),这可能是因为“葡萄糖效应”,即当碳源浓度超过一定浓度,细胞反而会因为“负担过重”,超过自身的氧化能力,从而抑制菌体生长或影响蛋白的表达[21];此外,蔗糖含量过高会赋予培养基过高的渗透压,影响细菌的生长和代谢。
REFERENCES
[1] Sandmann G. Carotenoid biosynthesis and biotechnological application. Arch Biochem Biophys, 2001, 385(1): 4−12.
[2] Giovannucci E. A review of epidemiologic studies of tomatoes, lycopene, and prostate cancer. Exp Biol Med, 2002, 227(10): 852−859.
[3] Fraser PD, Romer S, Shipton CA, et al. Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit-specific manner. Proc Natl Acad Sci USA, 2002, 99(2): 1092−1097.
[4] Wan Q, Zhang XG, Song M. Fruit-specific RNAi-mediated Lcy gene silencing enhances content of lycopene in tomatoes. Chin J Biotech, 2007, 23(3): 429−433.万群, 张兴国, 宋明. 果实特异性 RNAi介导的Lcy基因沉默来增加番茄中番茄红素的含量. 生物工程学报, 2007, 23(3): 429−433.
[5] Magee AM, Coyne S, Murphy D, et al. T7 RNA polymerase-directed expression of an antibody fragment transgene in plastids causes a semi-lethal pale-green seedling phenotype. Transgenic Res, 2004, 13(4): 325−337.
[6] Kahlau S, Aspinall S, Gray JC, et al. Sequence of the tomato chloroplast DNA and evolutionary comparison of solanaceous plastid genomes. J Mol Evol, 2006, 63(2): 194−207.
[7] Hibberd JM, Linley PJ, Khan MS, et al. Transient expression of green fluorescent protein in various plastid types following microprojectile bombardment. Plant J, 1998, 16(5): 627−632.
[8] Kim SW, Kim JB, Ryu JM, et al. High-level production of lycopene in metabolically engineered E. coli. Proc Biochem, 2009, 44(8): 899−905.
[9] Yoon SH, Kim JE, Lee SH, et al. Engineering the lycopene synthetic pathway in E. coli by comparison of the carotenoid genes of Pantoea agglomerans and Pantoea ananatis. Appl Microbiol Biotechnol, 2007, 74(1): 131−139.
[10] Alper H, Miyaoku K, Stephanopoulos G. Construction of lycopene-overproducing E. coli strains by combining systematic and combinatorial gene knockout targets. Nat Biotechnol, 2005, 23(5): 612−616.
[11] Fraser PD, Misawa N, Linden H, et al. Expression in Escherichia coli, purification, and reactivation of the recombinant Erwinia uredovora phytoene desaturase. J Biol Chem. 1992, 267(28): 19891−19895.
[12] Yuan LZ, Rouvière PE, LaRossa RA, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E. coli. Metab Eng, 2006, 8(1): 79−90.
[13] Li ZH, Matthews PD, Burr B, et al. Cloning and characterization of a maize cDNA encoding phytoene desaturase, an enzyme of the carotenoid biosynthetic pathway. Plant Mol Biol, 1996, 30(2): 269−279.
[14] Zhu XF, Suzuki K, Okada K, et al. Cloning and functional expression of a novel geranylgeranyl pyrophosphate synthase gene from Arabidopsis thaliana in Escherichia coli. Plant Cell Physiol, 1997, 38(3): 357−361.
[15] Liu M, Li RG, DU GC, et al. Studies of Escherichia coli accumulating lycopene and its culturing conditions. China Biotechnol, 2006, 26(8): 47−51.刘敏, 李荣贵, 杜桂彩, 等. 累积番茄红素的大肠杆菌工程菌及其培养条件的研究. 中国生物工程杂志, 2006, 26(8): 47−51.
[16] Maliga P. Progress towards commercialization of plastid transformation technology. Trends Biotechnol, 2003, 21(1): 20−28.
[17] Vadali RV, Fu YC, Bennett GN, et al. Enhanced lycopene productivity by manipulation of carbon flow to isopentenyl diphosphate in Escherichia coli. Biotechnol Prog, 2005, 21(5): 1558−1561.
[18] Matthews PD, Wurtzel ET. Metabolic engineering of carotenoid accumulation in Escherichia coli by modulation of the isoprenoid precursor pool with expression of deoxyxylulose phosphate synthase. Appl Microbiol Biotechnol, 2000, 53(4): 396−400.
[19] Wang CW, Oh MK, Liao JC. Engineered isoprenoid pathway enhances astaxanthin production in Escherichia coli. Biotechnol Bioeng, 1999, 62(2): 235−241.
[20] Ruther A, Misawa N, Böger P, et al. Production of zeaxanthin in Escherichia coli transformed with different carotenogenic plasmids. Appl Microbiol Biotechnol, 1997, 48(2): 162−167.
[21] Lau J, Tran C, Licari P, et al. Development of a high cell-density fed-batch bioprocess for the heterologous production of 6-deoxyerythronolide B in Escherichia coli. J Biotechnol, 2004, 110(1): 95−103.