大鼠Walker-256移植性肺癌模型的建立
2012-02-03黄文革陈凤英黄河清
黄文革,李 婕,陈凤英,黄河清
(中山大学实验动物中心,广州 510080)
肺癌是目前死亡率最高的癌症之一。建立理想的动物肿瘤模型是研究恶性肿瘤发生、发展、转移及疗效评价的重要手段。其中,可移植肿瘤模型因操作简便、易于观察,得到了学者们的广泛认可。Walker-256是目前广泛认可的大鼠可移植性肿瘤细胞株,植入体内能较好地模拟人类恶性肿瘤的膨胀性和浸润生长方式[1]。目前,学者们主要应用Walker-256细胞植入大鼠支气管[2],构建原位性肺癌模型。但此造模方法对实验技术要求较高,术后动物死亡率高,在实际应用中成模率低;而采用尾静脉注射建立肺癌移植性模型鲜见报道。本研究采用静脉注射方法建立大鼠Walker-256移植性肺癌模型,观察大鼠的成瘤及生存情况,为进一步的肿瘤实验研究奠定基础。
1 材料和方法
1.1 材料
大鼠Walker-256瘤株,由中山大学实验动物中心细胞库提供;KM小鼠,4只,体重18~22 g,雄性,SPF级,实验动物质量合格证明号:No.0084621。SD大鼠40只,体重60~70 g,雄性,SPF级,实验动物质量合格证明号:No.0084696,均购于中山大学实验动物中心,生产许可证号:SCXK(粤)2009—0011。动物饲养于标准的屏障环境动物实验室。实验动物设施许可证号:SYXK(粤)2007—0081.
1.2 实验方法
1.2.1 细胞的复苏和腹水的制备:Walker-256癌细胞常规复苏,置于新生小牛血清的RPMI-1640培养液中,低速离心,弃上清液,再用培养液配成细胞悬液(1×107/m L),将细胞悬液接种到KM小鼠腹腔中,0.2 m L/只,5~7 d后出现腹水。
1.2.2 移植性肺癌模型的建立:将KM小鼠的Walker-256细胞腹水,无菌操作,用5 m L一次性注射器(6号针头)抽出腹水,用生理盐水稀释,用细胞计数仪进行计数,再用生理盐水稀释成高、中、低三个浓度(分别为1.5×106/m L,0.5×105/m L,2.5× 104/m L)备用。取40只SD大鼠随机分为高、中、低三个模型组和正常对照组,共4组,每组10只,采用尾静脉注射接种法,模型组大鼠尾静脉注射不同浓度的腹水细胞悬液,0.2 mL/只,正常对照组大鼠尾静脉注射等量的生理盐水,所有动物饲养在屏障环境动物实验室中。实验期间,动物自由饮食;连续观察21 d。
1.3 观察指标
1.3.1 大体观察:观察注射腹水细胞悬液后大鼠的毛色、体重、饮食、活动情况;当模型组有动物出现死亡时结束实验观察,采用颈椎脱臼法处死全部大鼠,对大鼠进行常规解剖,肉眼观察肺脏及其他器官的大小、色泽、质地及有无肿瘤结节形成,。
1.3.2 取材:称取各组大鼠的肺部、肝脏、脾脏的重量,计算脏器系数(脏器系数=器官重量/体重×100%)。
1.4 组织病理学分析
所取的大鼠的肺和可疑脏器,用10%福尔马林固定,常规石蜡包埋,切片厚4~5μm,HE染色,观察病理形态学变化。
1.5 统计学方法
用SPSS 17.0软件包处理,数据以x¯±s表示,组间差异采用方差分析,P<0.05认为有统计学意义。
2 结果
2.1 动物的一般情况及体重变化
模型组大鼠注射肿瘤腹水细胞悬液后7 d动物饮食、体征正常,14 d后大鼠出现食量明显减少,活动少,倦怠状,对外界刺激反应迟钝,皮毛松、无光泽,体质消瘦等癌症恶病质体征。注射后7、12、14和21 d,高、中、低三个模型组体重均明显低于正常对照组(P<0.05)。注射后21 d高浓度模型组大鼠开始出现死亡。各组大鼠不同时间点的体重情况见表1。
2.2 移植性肺癌模型的成瘤率
注射肿瘤腹水细胞悬液后21 d,高浓度组动物出现死亡,处死所有实验组大鼠,解剖后肉眼观察发现高浓度模型组全部动物肺部均出现多个肉眼可见的癌结节(10/10),中浓度组则有8只(8/10),低浓度组中有3只(3/10)出现上述表现,各组移植性肺癌成瘤率见表2。
2.3 各组大鼠脏器系数
高、中、低浓度组大鼠肺脏系数、肝脏系数高于正常对照组,其中高剂量组差异有统计学意义(P<0.05);各浓度组大鼠脾脏系数与正常对照组相比无显著性差异,见表3。
表1 各组动物不同时间点的体重情况(±s) Tab.1 The body weight of the rats at different time
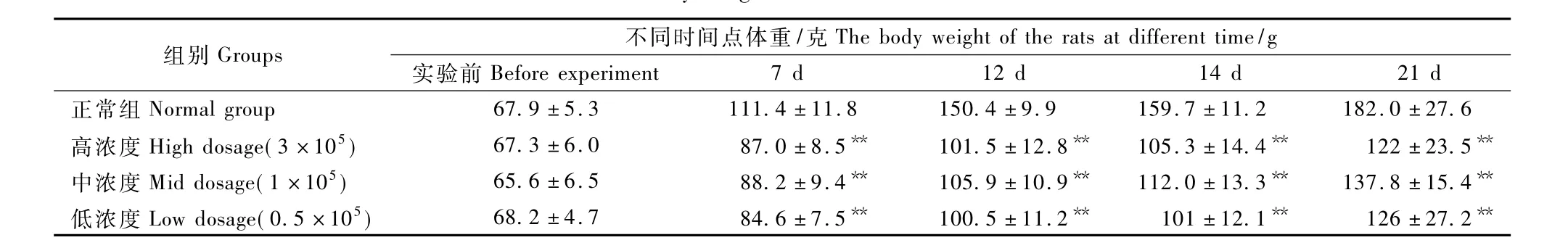
表1 各组动物不同时间点的体重情况(±s) Tab.1 The body weight of the rats at different time
注:与正常对照组相比,**P<0.01.Note:Compared with the normal group,**P<0.01
组别Groups 不同时间点体重/克The body weight of the rats at different time/g实验前Before experiment 7 d 12 d 14 d 21 d正常组Normal group 67.9±5.3 111.4±11.8 150.4±9.9 159.7±11.2 182.0±27.6高浓度High dosage(3×105)67.3±6.0 87.0±8.5** 101.5±12.8** 105.3±14.4** 122±23.5**中浓度Mid dosage(1×105)65.6±6.5 88.2±9.4** 105.9±10.9** 112.0±13.3** 137.8±15.4**低浓度Low dosage(0.5×105)68.2±4.7 84.6±7.5** 100.5±11.2** 101±12.1** 126±27.2**
3 讨论

表2 各组动物肺癌成模情况Tab.2 The establishment status of lungcancermodels in the rats
2.4 肺部大体解剖情况
正常组大鼠,常规解剖后肉眼观察,各器官未见异常变化,肺部表面光滑;10只高浓度模型组大鼠,肺部均见有中央型、弥漫性病灶,呈结节状,不规则,结节表面光滑,与周围正常组织边界清楚,质硬,灰白。中、低浓度模型组部分大鼠肺部也可见少数肿块结节。各模型组大鼠肝脏、脾脏等器官均未发现异常(图1)。
2.5 肺部病理学检查
经过HE染色,镜下可见高浓度模型组10只大鼠(10/10)、中浓度模型组有8只大鼠(8/10)、低浓度模型组有3只大鼠(3/10)的肺部组织可见不规则的癌巢,肿瘤细胞排列紧密,癌细胞核大,浆少、核分裂相多见、核内染色质粗糙,部分呈空泡状,周围炎症细胞浸润,癌巢形态大小不一(图2,图1、2见彩插7)。所有模型组大鼠的肝脏和脾脏未见癌细胞转移(图3、图4,见彩插8)。
肺癌疗效得不到提高的主要障碍在于肺癌临床表现复杂,难以早期发现,复制出与人类肺癌发病机制、发展过程相似的动物模型是肿瘤学研究必不可少的手段之一。目前肺癌动物模型的制备方法多采用诱发性、移植性或转基因动物模型。移植性动物模型又可分为原位移植和异位移植,其中异位移植因其方法简便、成模率高而被广泛应用,但该类模型适用于抗癌药物疗效检测,不适合用于肿瘤发生和形成机制的研究。原位移植动物模型被认为是目前比较理想的模型,主要通过将癌细胞直接注射到肺部支气管复制肺癌原位模型[3、4],该模型能较真实地模拟肺癌患者的临床特征,但手术操作难度较大,动物死亡率高,成瘤率低。
Walker256肿瘤是大鼠自发性乳腺癌,多移植于SD大鼠或W istar大鼠这两种远交系动物中,用于肿瘤学基础研究或细胞传代[5]。Walker256也被用于移植性肺癌模型的制作[6]。
本研究选取KM小鼠腹腔注射Walker256癌细胞,成功制备了腹水瘤细胞悬液,采用尾静脉注射Walker256癌细胞悬液的方法建立大鼠移植性肺癌模型,比较三个不同细胞浓度的肺癌成瘤情况。结果显示,造模14 d后,模型组动物出现摄食减少,活动减少,皮毛欠光泽等恶病质体征;造模21 d时,注射高浓度Walker256癌细胞(3×105个细胞/只)的动物肺部均出现肉眼可见癌结节,成瘤率为100%,肺脏系数和肝脏系数远远高于正常对照组。HE结果显示,不同浓度组动物肺部均发现多发性癌灶,但并未出现其他脏器转移,与肺原位接种方法建立的肺癌模型病理结果类似[7]。在生存状态上,此模型大鼠的症状与临床上癌症病人消瘦、乏力、食欲不振等临床病症类似,为药物的初步筛选提供参考依据。相比于传统的移植性肺癌造模方法,此造模方法简单可行,成模时间短,成模率高,与肺癌的发展进程较一致,但肿瘤转移率不高,不能反映晚期癌症病人的临床生物学体征,仍有待进一步的研究。
本研究采用尾静脉注射Walker-256细胞成功建立大鼠移植性肺癌模型,可作为肿瘤学可靠的研究手段之一,为肿瘤发病机制及治疗研究奠定实验基础。
[1]王红卫,卓忠雄,赵树文.大鼠Walker-256皮下移植瘤模型的建立及其超声评价[J].临床超声医学杂志,2007,9 (2):68-71.
[2]Gomes Neto A,Simao AF,Miranda Sde,P,et al.Experimental rat lung tumor model with intrabronchial tumor cell implantation[J].Acta Cir Bras,2008,23(1):84-92.
[3]Kondo K,Fujino H,Miyoshi T,et al.Orthotopically implanted SCID mousemodel of human lung cancer suitable for investigating metastatic potential and anticancer drug effects[J].Oncol Rep,2004,12(5):991-999.
[4]Wang HY,Ross HM,Ng B,et al.Establishment of an experimental intrapulmonary tumor nodule model[J].Ann Thorac Surg,1997,64(1):216-219.
[5]姚明,杨建平,王丽娜,等.腹水传代和体外培养Walker256癌细胞系建立大使骨癌痛模型的可行性[J].中华医学杂志,2008,88(13):880-889.
[6]彭永海,李琦,刘庆,等.大鼠肝包膜下接种Walker-256瘤株肺转移的观察[J].第二军医大学学报,2002,10(23):1084-1122.
[7]刘馨,伍治平,左曙光,等.小鼠Lewis肺癌原位模型的构建[J].中国肺癌杂志,2010,1(1):42-47.
