D-二聚体单克隆抗体制备及其在免疫荧光快速定量检测中的应用
2012-02-03康可人吴培钿卢艳华张健唐时幸王继华
康可人,吴培钿,卢艳华,张健,唐时幸,王继华
D-二聚体单克隆抗体制备及其在免疫荧光快速定量检测中的应用
康可人,吴培钿,卢艳华,张健,唐时幸,王继华
D-二聚体(D-dimer,D-D)是纤维蛋白单体经活化因子 XIII 作用后形成的交联纤维蛋白凝块,再经纤溶酶水解所产生的一种特异性降解产物,医学应用上将它作为一个特异性的纤溶过程标记物,反映纤维蛋白溶解功能[1]。与纤维蛋白破坏有关的疾病,如深静脉血栓形成(DVT)、肺栓塞(PE)和弥漫性血管内凝血(DIC)等,均可导致体内 D-D水平升高[2-6]。近年来 D-D 的临床应用范围越来越广,除了以上提及的疾病外,在恶性肿瘤、糖尿病、肝脏疾病、脓毒血症的诊断以及溶栓治疗监测方面均具有重要的参考价值[7-9]。
目前 D-D 蛋白检测方法主要有胶体金法、酶联免疫吸附法(ELISA)和第二代胶乳凝集法(免疫比浊法)[10]。胶体金法快速简单,但无法实现定量检测;ELISA 法可精确定量,但操作步骤繁琐;免疫比浊法敏感性高,检测结果准确,但试剂以进口为主[11]。荧光免疫定量检测技术,属于即时检测(point-of-care testing,POCT)[12]领域的新兴技术,能快速、灵敏、简便地实现指标的定量检测,免疫荧光定量检测技术经过一定阶段的发展,目前主要在感染性指标(如C 反应蛋白)和心脏标志物指标的应用上较为多见,厂家以欧美、韩为主。本研究利用杂交瘤技术制备筛选能稳定分泌特异性抗 D-D 抗体的细胞株,初步应用于免疫荧光定量检测平台,实现对 D-D 快速定量检测,为临床相关疾病的诊断、治疗、监测提供有效工具与手段。
1 材料与方法
1.1 材料
1.1.1 试剂及动物 人源 D-二聚体蛋白购自英国 Abcam公司;纤维蛋白原购自北京博润莱特科技公司;人纤溶酶、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、小鼠单克隆抗体亚型检测试剂盒均购自美国 Sigma 公司;RPMI1640培养基、胎牛血清(FBS)、HAT、HT、聚乙二醇(PEG)(Mw 4000)均为美国 Gibco 公司产品;羊抗鼠 IgG-HRP酶购自北京中杉金桥公司;纤维蛋白原降解物(纤维蛋白解复合物、D 和 E 片段)由本室制备保存;小鼠骨髓瘤细胞系(SP2/0)为本实验室传代保存;实验室用水为超纯水;所用化学试剂均为国产分析纯。SPF 级 BALB/c 纯系小鼠,鼠龄 6 ~ 8 周,体重 18 ~ 22 g,由中山大学实验动物中心提供。
1.1.2 仪器 Multiskan MK3 酶标仪、BB15 型 CO2培养箱为美国 Thermo 公司产品;SDS-PAGE 电泳仪购自北京六一公司;飞测免疫荧光定量检测仪由广州万孚生物技术有限公司研制;高速冷冻离心机为日本 Hitachi 公司产品;ACL TOP 血凝分析仪为美国 Beckman 公司仪器,D-D 检测试剂为西班牙 Werfen Group 产品。
1.1.3 临床样品来源 自 2011年1月至 6月期间,收集江门市五邑中医院门诊病人血浆(枸橼酸钠抗凝血,离心收集血浆),共 106 例。D-二聚体含量均经血凝仪定值。
1.2 方法
1.2.1 杂交瘤细胞株的建立 取 6 ~ 8 周龄的 BALB/c小鼠,首次免疫将福氏完全佐剂与等体积的 D-D 蛋白乳化后于小鼠皮下、足垫处注射,50 μg/只,经 3 次加强免疫后,尾静脉采血,间接 ELISA 法检测小鼠血清效价,效价大于104的小鼠,腹腔冲击免疫 1 次,3 d 后取其脾细胞制备杂交瘤。细胞融合按照常规半固体法进行。将离心好的融合细胞,依次加入 FBS、饲养细胞、HAT 溶液、半固体培养基,定容至 40 ml,置于混匀仪上混匀 30 min 后,分别倒入30 个培养皿中,确保半固体均匀贴皿底,装入湿盒,37 ℃,5% CO2培养箱中培养。5 ~ 7 d 后,挑选大小适中的单集落克隆,转入 96 孔板培养,细胞长至培养孔面积 50% 后,用间接法检测细胞上清,筛选高效价的细胞株进行多次亚克隆,确保细胞株在体外连续传代 3 个月和多次冻存后再复苏仍能稳定分泌抗体。经定株后常规制备腹水,采用小鼠体内诱生法制备腹水,经正辛酸-饱和硫酸铵法进行腹水纯化,制备单克隆抗体。
1.2.2 单克隆抗体的鉴定
1.2.2.1 效价测定 单克隆抗体的效价采用间接 ELISA法测定。用 D-二聚体蛋白(1 μg/ml)包被 ELISA 板,将抗体稀释到 1 mg/ml 后,从 1∶1000 浓度开始做 10 倍稀释,加入板中,37 ℃ 孵育 1 h,洗涤后加二抗 HRP 标记的羊抗鼠-IgG 反应,洗涤后加入 TMB 底物显色,设阴性(N)、阳性(P)对照。效价以 P/N > 2.1 为阳性标准。
1.2.2.2 Ig 类和亚类的鉴定 采用小鼠 mAb 分型试剂盒测定抗 D-D 单抗的 Ig 亚类。依照试剂盒说明书操作。
1.2.3 mAb 特异性鉴定
1.2.3.1 抗体交叉反应性研究 用间接 ELISA 法测定。将 D-D、纤维蛋白原、纤维蛋白原降解物、D 片段、E 片段包被于 ELISA 微孔板,加入抗体,再加入二抗 HRP 标记的羊抗鼠-IgG,进行显色反应。
1.2.3.2 免疫印迹法测定单抗特异性 天然状态的 D-D为二聚体,且与纤维蛋白原有同源性,故采用非还原蛋白、还原蛋白、纤维蛋白原及其降解片段进行检测。D-D 分子量约为 200 kD,纤维蛋白原分子量约为 340 kD,降解后片段约 47 ~ 150 kD 不等。因此,为确保纤维蛋白原各片段均转移到硝酸纤维素膜上,经预实验,选取 5% 浓缩胶,8%分离胶进行 SDS-PAGE 电泳,上样量 1 μg,并以预染marker 作示踪。待 50 kD 条带达到分离胶下缘约 3 cm 左右处,停止电泳,进行湿转印。转印条件为 300 mA,4 ℃,恒流转印 2 h,于转印后用丽春红 S 染色,确认转印效果。以 3% BSA封闭,放置 4 ℃ 封闭过夜。室温下加一抗孵育 1 h,一抗浓度为 1 μg/ml,用 PBST 洗涤 4 次,每次10 min;室温下加二抗,二抗稀释比例为 1∶20 000,用 PBST洗涤 4 次,每次 10 min,以增强型化学发光(ECL)为底物,进行显影。
1.2.3.3 mAb 亲和力测定 采用非竞争酶免疫试验,参照David Beatty 方法[13],按公式Ka = (n-1)/2(n[Ab′]t - [Ab]t)计算亲和常数Ka 值。分别以每孔 0.5、0.25、0.125 μg/ml 的D-D 蛋白包被 ELISA 板,加入倍比稀释的 mAb,37 ℃作用 30 min 后,加入 1∶20 000 稀释的 HRP 标记羊抗鼠-IgG,37 ℃ 反应 30 min,TMB 显色,测 450 nmOD值。以 mAb 浓度对数为横坐标,以OD值为纵坐标,得到OD值对抗体浓度的对数作图,以每条曲线上部平坦段的OD值作为 100%,在曲线上查出 50% 的OD值所对应的mAb 浓度,然后按公式计算出亲和常数。n = [Ag′]t/[Ag]t,[Ag′]t 和 [Ag]t 为不同包被抗原的浓度;[Ab′]t、[Ab]t 是对应不同包被抗原的浓度条件下,将抗体梯度稀释得到最大吸光度一半处的抗体浓度。
1.2.4 免疫荧光定量方法的建立及临床应用
1.2.4.1 标准曲线建立 将 D-D 蛋白稀释到 10、5、1、0.5、0.2 和 0.1 μg/ml 浓度,以血凝仪检测各定标点得到实际浓度,使用定值后的系列梯度蛋白溶液作为实验标准品。根据检测标准品的定标浓度及测得的荧光值确定数据处理方法,绘制标准曲线,得到方程。
1.2.4.2 临床初步应用 使用筛选到的抗 D-D 配对抗体建立双抗体夹心法,利用“飞测”免疫荧光定量检测仪检测临床样本荧光信号,将测得的荧光值代入方程,反求出样本实际浓度,并将样本测得的浓度与医院检测浓度对比,计算相关系数。
1.3 统计学处理
采用直线相关与统计学方法进行分析。以 Pearson 乘积矩相关系数定量表述线性相关的程度。P< 0.05 为差异显著。
2 结果
2.1 杂交瘤细胞株的建立
经过 4 次细胞融合,采用间接 ELISA 法进行反复筛选,3 ~ 5 次亚克隆,最终获得 7 株稳定分泌特异性抗 D-D抗体的细胞株,对其进行亚克隆建株保存。后经 ELISA 抗体配对实验,筛选出 2 株配对效果好的抗体,命名为 2-6D、4-4C,进行以下抗体鉴定分析及临床应用评价。
2.2 抗 D-二聚体单抗的鉴定
2.2.1 效价测定 mAb 的效价采用间接 ELISA 法测定。结果显示,2 株抗体 2-6D 和 4-4C 的效价分别为 0.321 ×10-6和 0.372 × 10-6。效价均大于 1∶105。
2.2.2 Ig 类和亚类的鉴定 经小鼠 mAb 分型试剂盒测定,所获得的两株抗 D-D mAb 为 IgG2a 亚类。
2.2.3 mAb 特异性鉴定
2.2.3.1 抗体交叉反应性研究 结果显示,两株单克隆抗体与纤维蛋白原及其降解物,D 片段和 E 片段不发生反应,与 D 单体有反应。
2.2.3.2 免疫印迹法测定单抗特异性。如图 1A、图 1B 所示,两株 mAb 与非还原的 D-D 蛋白呈阳性反应,与其他蛋白包括还原 D-D 均不反应。

图 1 4-4C(A)与 2-6D(B)抗体免疫印迹分析
2.2.4 mAb 亲和力测定 采用非竞争酶免疫试验,参照David Beatty 方法测定。两株单抗与 3 个不同包被浓度的D-D 蛋白均特异性结合,经 Beatty 推导公式,计算亲和常数,结果显示单克隆抗体 2-6D 和 4-4C 的亲和常数分别为9.84 × 10-7和 1.46 × 10-6。结果见图 2。
2.3 免疫荧光定量方法的建立及临床样本检测结果
2.3.1 标准曲线建立 将 D-D 蛋白稀释到 10、5、1、0.5、0.2、0.1 μg/ml 浓度,血凝仪检测各定标点,得到实际浓度分别为 10、5.03、1.03、0.53、0.32、0.11 μg/ml。以此系列梯度蛋白溶液作为实验标准品,D-D 浓度值为横坐标,荧光检测值为纵坐标,绘制标准曲线。由标准曲线可以得出,检测浓度的线性范围在 0.1 ~ 10 μg/ml,荧光信号强度与浓度之间的线性关系表达式是 y = 0.0016x3- 0.0367x2+0.5177x + 0.7892(y 表示荧光信号强度,x 表示 D-D 浓度)。根据公式计算r² = 0.9996。结果见图 3。
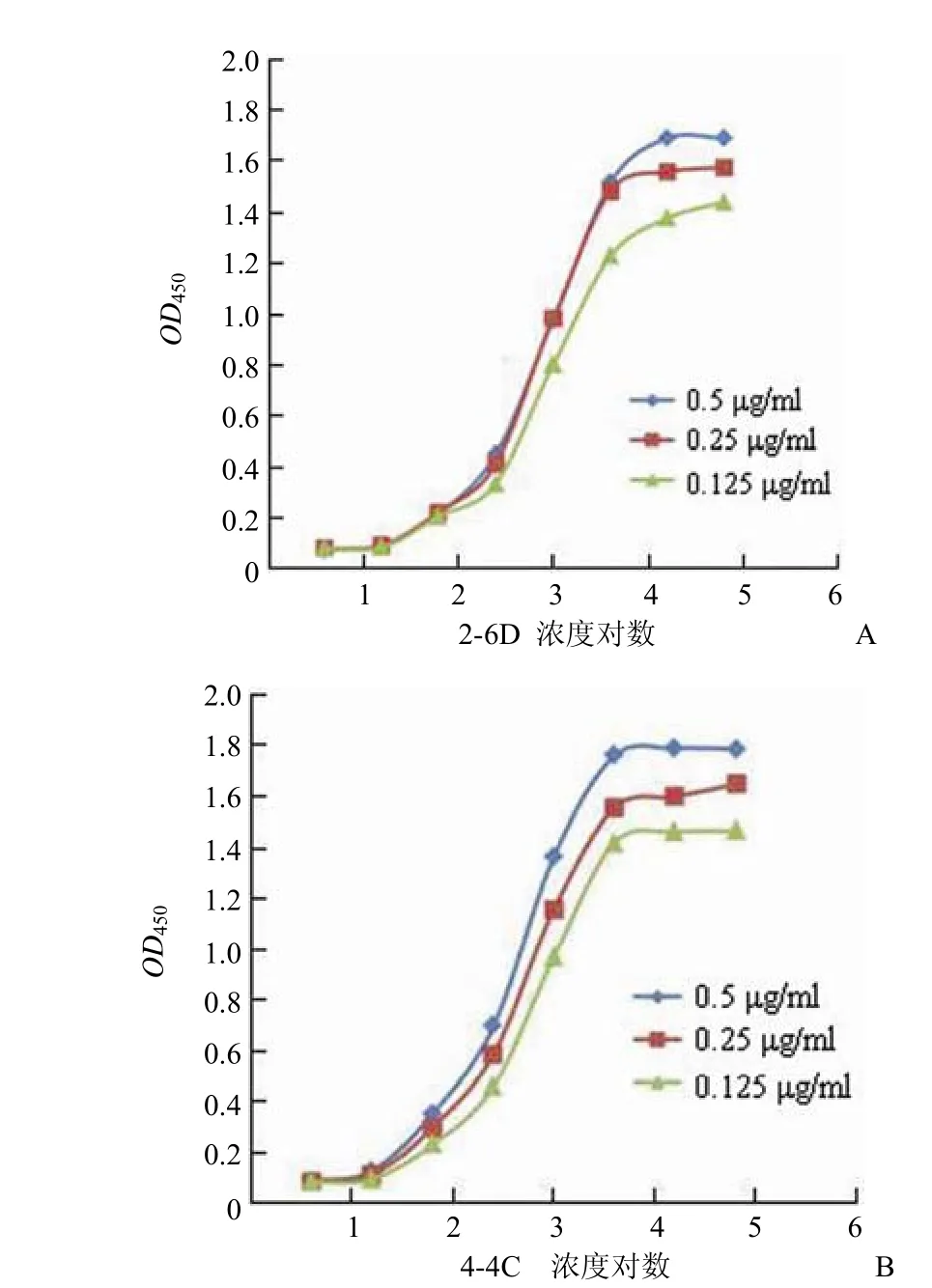
图 2 2-6D(A)与 4-4C(B)亲和常数测定
2.3.2 临床初步应用 将 2-6D 作为包被抗体,4-4C 为标记抗体,采用双抗体夹心法,检测临床样本荧光信号,结果如图 4。将测得的荧光值代入方程,反求出样本实际浓度,根据临床检测标准,大于 0.5 μg/ml 判为阳性。将样本测得的浓度与医院检测浓度对比,绘制散点图,见图 5。得出方程 y = 0.7199x + 0.0379。计算出r² = 0.9596,P> 0.05,两种方法无显著差异。

图 4 ACL TOP 血凝仪与免疫荧光定量仪(2-6D/4-4C)测定 106 份临床样品 D-D 值
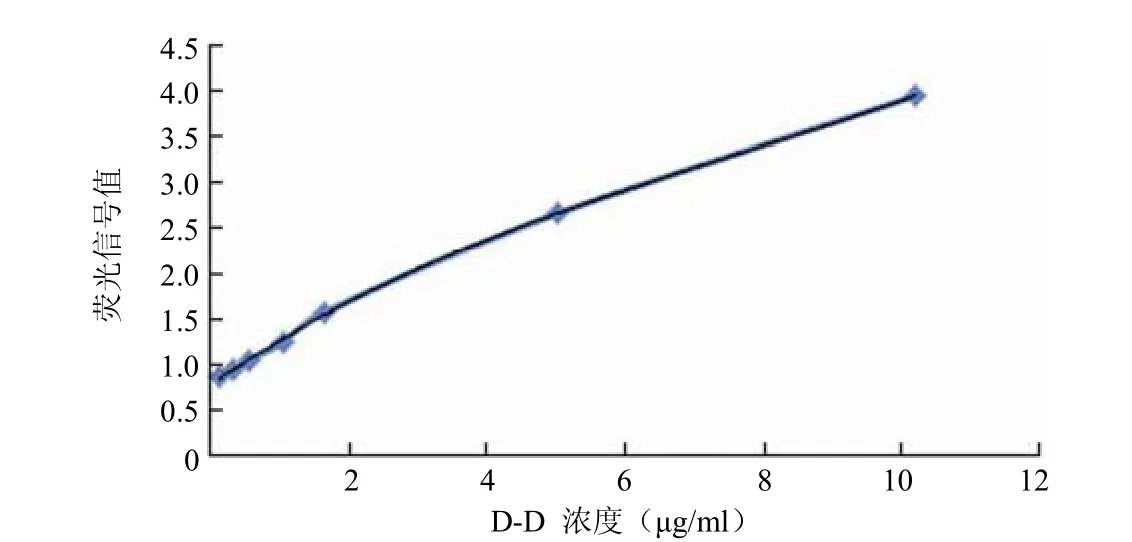
图 3 应用配对抗体 2-6D/4-4C 建立的标准曲线
3 讨论
人体纤溶系统是最重要的抗凝系统,它对保持血管壁的正常通透性,维持血液的流动状态和组织修复起着重要作用。D-D 是纤溶过程中纤维蛋白降解产物的重要成分,纤溶酶不仅使非交联的纤维蛋白单体裂解成肽段,还可使交联纤维蛋白降解,释放出 D、E 碎片,并生成 DD、DD/E、YD/DY、YY/DD 等复合物,这些碎片进一步降解为最小的片段 D-D[1]。
D-D 是交联纤维蛋白特异性降解产物,其生成和增高反映了纤溶系统的激活,因此 D-D 交联碎片可反映血栓形成后的溶栓活性。在临床上已作为血液高凝状态和继发性纤溶亢进的特异性指标应用[2-9]。如 D-D 检测阴性,可以排除急性静脉血栓栓塞症,D-D 阳性结合临床表现可诊断急性 VTE。此外,D-D 的监测还可反映急性静脉血栓栓塞症药物抗凝溶栓治疗的效果以及评价复发的危险程度及预后。在严重感染、恶性肿瘤、糖尿病、贫血等疾病进展中,均可出现血浆 D-D 水平变化。
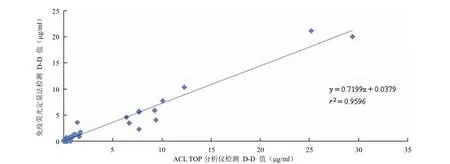
图 5 ACL TOP 法与免疫荧光定量法(2-6D/4-4C)测定结果相关性分析
临床将 D-D 检测指标作为体内血栓前状态及血栓形成的指标之一,应用越来越广泛。但是到目前为止,商品化的 D-D 检测手段尚存在一定局限性,试剂质量参差不齐,主要以 ELISA 方法和胶乳凝集法为主,市面上的主流产品均以进口为主,而其主要生物原材料,即单克隆抗体基本依靠国外进口[14]。本研究采用血浆提取的 D-D 蛋白为免疫原,利用杂交瘤技术制备筛选出稳定分泌特异性抗体的细胞株,获得 7 株稳定分泌特异性抗 D-D 抗体的细胞株,经鉴定,其中两株抗体 2-6D 和 4-4C 配对效果好,其抗体亲和力分别为 9.84 × 10-7和 1.46 × 10-6,说明其应用于诊断试剂的可行性。在特异性鉴定方面,两株单抗经免疫印迹检测,与非还原的 D-D 呈阳性反应,与其他蛋白均无交叉,提示应用于诊断试剂中,两株抗体满足灵敏度前提下,能较好地实现 D-D 指标检测的特异性。
荧光免疫定量检测技术,属于 POCT 检验领域新兴技术,能快速、灵敏、简便地实现指标的定量检测。POCT 在20 世纪 90年代得到快速发展,随着各种检测技术的兴起及检测仪器的创新,POCT 的应用日益广泛。免疫荧光技术属于以微粒为载体的精确定量免疫分析方法,国外已有一些公司开发了适用于此平台的检测试剂及仪器,如 Response公司的 RAMP 检测仪,Biosite 公司的 Triage 检测仪。开展的项目包括心肌梗死,感染类标志物等。鉴于这些仪器及试剂售价昂贵,在中国实际需要检测的项目不一定有产品,因此其应用受到一定限制。目前,国内自主研发的免疫荧光定量检测方法的试剂及配套仪器为数不多,检测指标则更为局限,目前应用较为普遍的是“飞测”免疫荧光检测仪,该系统是由一个荧光读数仪和检测板组成,检测板使用的是层析法,样本中的目标物在移动过程中与标记抗体形成免疫复合物,通过检测区域、质控区域的值与目标物不同的浓度获得定标曲线,检测样本中的浓度,现阶段尚未有成功应用于临床的 D-D 免疫荧光定量检测试剂上市。本研究利用国内已上市的飞测荧光免疫定量检测仪器平台基础,研制 D-D免疫荧光定量检测试剂。本研究尝试建立 D-D 的免疫荧光定量检测方法,其一,可实现关键生物原材料自主提供,其二,也是更为关键的,可填补国内免疫荧光定量检测 D-D方法学的空白,为临床相关疾病的诊断、治疗、监测提供有效工具与手段。
本研究筛选的 2 株单抗具有灵敏度高,特异性强的特点,可以用于免疫荧光定量方法学及 ELISA、Western blot中。通过检测临床样品发现我们开发的 D-D 检测试剂分析灵敏度可达到 0.1 μg/ml,与对照方法比较,r2= 0.95,两者相关性好。在检测 106 例临床样品中,我们建立的免疫荧光定量方法与对照方法(比浊法)比较,存在高值偏低现象,考虑是与胶乳标记工艺相关,因此在后续实验中,将调整胶乳标记蛋白的工艺,期望获得改善。
[1]Medved L, Nieuwenhuizen W.Molecular mechanisms of initiation of fibrinolysis by fibrin.Thromb Haemost, 2003, 89(3):409-419.
[2]Castro DJ, Pérez-Rodríguez E, Montaner L, et al.Diagnostic value of D dimer in pulmonary embolism and pneumonia.Respiration, 2001,68(4):371-375.
[3]Kesieme E, Kesieme C, Jebbin N, et al.Deep vein thrombosis: a clinical review.J Blood Med, 2011, 2:59-69.
[4]Thachil J, Fitzmaurice DA, Toh CH.Appropriate use of D-dimer in hospital patients.Am J Med, 2010, 123(1):17-19.
[5]Dempfle CE.Validation, calibration, and specificity of quantitative D-dimer assays.Semin Vasc Med, 2005, 5(4):315-320.
[6]Geske JB, Smith SB, Morgenthaler TI, et al.Care of patients with acute pulmonary emboli a clinical review with cardiovascular focus.Expert Rev Cardiovasc Ther, 2012, 10(2):235-250.
[7]Mytnik M, Stasko J.D-dimer, plasminogen activator inhibitor-1,prothrombin fragments and protein C - role in prothrombotic state of colorectal cancer.Neoplasma, 2011, 58(3):235-238.
[8]Sarig G, Klil-Drori AJ, Chap-Marshak D, et al.Activation of coagulation in amniotic fluid during normal human pregnancy.Thromb Res, 2011, 128(5):490-495.
[9]Tomonaga Y, Gutzwiller F, Lüscher TF, et al.Diagnostic accuracy of point-of-care testing for acute coronary syndromes, heart failure and thromboembolic events in primary care: a cluster-randomised controlled trial.BMC Fam Pract, 2011, 12:12.
[10]Tripodi A.D-dimer testing in laboratory practice.Clin Chem, 2011,57(9):1256-1262.
[11]Geersing GJ, Janssen KJ, Oudega R, et al.Excluding venous thromboembolism using point of care D-dimer tests in outpatients: a diagnostic meta-analysis.BMJ, 2009, 339:b2990.
[12]Liu XG, Fang C, Liu Z, et al.Principle and practice of POCT.Beijing:China Medical Science Press, 2006.刘锡光, 方成, 刘忠, 等.POCT 基本理论和临床医学实践.北京:中国医药科技出版社, 2006.
[13]Beatty JD, Beatty BG, Vlahos WG.Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay.J Immunol Methods, 1987, 100(1-2):173-179.
[14]Fukuda T, Kasai H, Kusano T, et al.A rapid and quantitative D-Dimer assay in whole blood and plasma on the point-of-care PATHFAST analyzer.Thromb Res, 2007, 120(5):695-701.
10.3969/cmba.j.issn.1673-713X.2012.03.013
“重大新药创制”科技重大专项(2011ZX09506-001)
510640 广州,华南理工大学生物科学与工程学院(康可人、卢艳华);510663 广州万孚生物技术有限公司国家地方联合自检型快速检测工程实验室(康可人、吴培钿、张健、唐时幸、王继华)
康可人,Email:keren_kang@hotmail.com
2012-02-16
