胶乳增强免疫透射比浊法检测胱抑素C的技术性能评价*
2012-01-30郑春苏黄湘宁黄清松
郑春苏 邹 燕 黄湘宁 黄清松
肾小球滤过率(glomerular filtration rate,GFR)是检测肾功能最直接指标,常用肌酐清除率(Ccr)来评价[1]。由于其测量方法复杂,临床上常用血尿素氮(BUN)和肌酐(Cr)来间接反映肾功能[2],这两个指标容易受年龄、性别、体重、饮食摄入等因素的影响,并且其评价肾功能不全的敏感度较低,有报道当肾小球滤过率下降超过50%时才能导致血Cr轻微上升[3]。胱抑素C(Cystatin C,Cys-C)是一种小分子蛋白[4],又称半胱氨酸蛋白酶抑制剂C[5],由体内有核细胞产生,速率较稳定,不受个体、肌肉量、性别、年龄、肾前因素和慢性炎症的影响[6]。近年来文献报道,循环血液中的Cys-C几乎仅经肾小球过滤而被清除,其血液中的浓度能够较准确地反映GFR[7],它可以自由通过肾小球滤过,并且肾小管不分泌排泄,几乎全部在肾小管重吸收后被分解代谢[8];血清Cys-C比Cr和Ccr对反映GFR的变化具有更高的敏感性和特异性,能够替代Cr和Ccr而作为GFR变化的理想的内源性标志物指标[9-13]。
由于血清中Cys-C浓度较低,故其测定方法需较高的分析灵敏度及特异性。Cys-C的测定方法很多,如最早由Lofberg使用的单向免疫扩散法(RID)和酶免疫测定法(EIA),以及后来的放射免疫法(RIA)和荧光免疫法(FIA)[14]。前两种方法不仅费时,检测限也较差;后两种方法简单、灵敏,但需要特定仪器,仪器价格昂贵,并且测定时间较长,无法满足常规、快速检测要求。同时,RIA还对环境有污染,对操作人员有伤害。以上各种测定方法均属非均相测定方法,很难自动化,因此,限制了Cys-C广泛的临床应用。目前国内外已经有很多公司能够生产胶乳增强免疫透射比浊法(PETIA)Cys-C测定试剂盒。由于这种方法是一种均相测定方法,不需要特殊的仪器,在普通的生化分析仪上就能检测[15],自动化程度高,耗时少、操作简便,所以成为理想的临床常规检测方法。
建立一个新的分析方法,或引进新的方法、试剂和仪器,都应对它们的技术性能如精密度、方法比较、线性范围以及干扰等作出评价[16-17]。美国国家临床实验室标准化委员会(NCCLS)制定了一套评价方案(EP5-A、EP9-A、EP6-A和EP7-A文件)能客观而正确地对上述技术性能作出评价。
本临床实验准备使用现成的HITACHI 7100全自动生化分析仪将胶乳增强免疫透射比浊法引进到Cys-C的日常检测工作中,在常规应用之前对其技术性能在实验室条件下进行了严格的评价,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
(1)HITACHI 7100全自动生化分析仪(日本日立公司);Sysmex KX-21全自动血细胞分析仪(日本东亚公司)。
(2)胶乳增强免疫透射比浊法试剂、校准品和室内质控品,由浙江省金华市强盛生物科技有限公司提供。
1.1.2 标本
实验标本来源于本院门诊或住院患者、体检者。①血红蛋白液(100 g/L);②收集体检者的用EDTA抗凝的新鲜全血标本,用生理盐水洗涤红细胞5次,离心去除上清液,加入适量蒸馏水溶解红细胞,测定血红蛋白浓度,选取100 g/L备用。
1.2 方法
1.2.1 胶乳增强免疫透射比浊法的检测原理
血清中的Cys-C与试剂中的抗人Cys-C抗体胶乳颗粒发生凝集反应,使反应溶液浊度增加。其浊度的增加值与血清中Cys-C的浓度呈正比,在波长546 nm处检测吸光度的变化,并与标准品对照,可计算出Cys-C的浓度。
1.2.2 主要分析参数
样本体积4.0 μl;R1体积120 μl;R2体积30 μl;主波长546 nm;副波长800 nm;两点终点法;反应方向为向上;反应温度为37 ℃;第16个读光点读取A1;第34个读光点读取A2;待测标本吸光度A=A2-A1。
1.2.3 操作方法
先定期请厂家进行仪器校准,检测参数和程序均按照胶乳增强免疫透射比浊法试剂盒与仪器说明书进行设置,然后用试剂相配套的校准品进行项目定标,每天检测高、中值室内质控品,共20 d,计算均值±标准差(x±s)表示,确认本仪器本项目的质控允许范围。检测高、中值室内质控品,确认在控后进行准确度、精密度、线性范围和干扰因素4项评价试验。
2 结果
2.1 准确度回收试验
参考第3版全国临床检验操作规程[16]。制备2份不同Cys-C浓度的患者混合血清作为基线标本,向每一份1.8 ml的混合基线标本中分别加入0 μl、100 μl、200 μl Cys-C高值校准品(8.90 mg/L),再分别加入200 μl、100 μl、0 μl生理盐水。将上述6份体积均为2.0 ml的标本,用(胶乳增强)免疫透射比浊法进行4次重复检测并计算平均值。通过测量值减去各自基线值确定回收量,回收率为回收量除以加入量乘以100获得。计算4个回收率的平均值为97.1%。
2.2 精密度试验
参考NCCLS评价方案(EP5-A文件)[17]。选择2例患者混合血清标本(正常值1例,高值1例),每天测定2次(2次测定间隔2 h以上),每次测定均做双份,连续测定20 d,所有双份数据未发现离群点,精密度结果见表1。
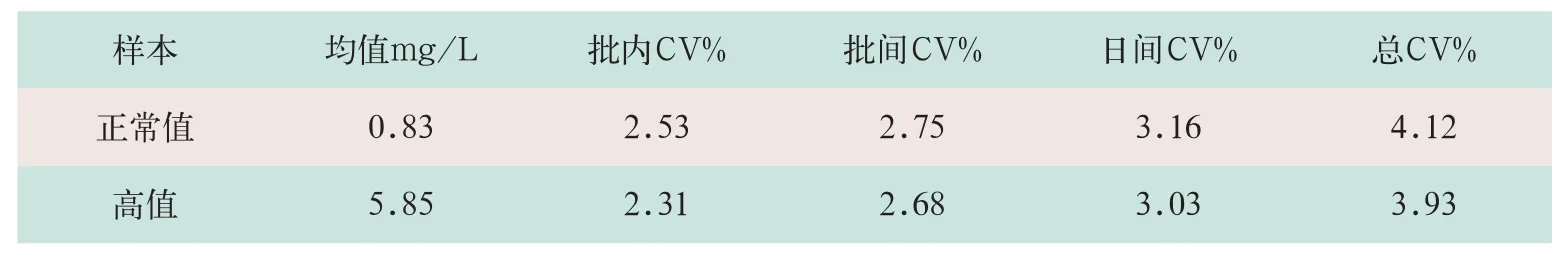
表1 胶乳增强免疫透射比浊法测定血清Cys-C的精密度结果(n=20)
2.3 线性试验
参考NCCLS评价方案(EP6-A文件)[18]。取Cys-C最低值(0.00 mg/L)校准品为低值标本1号,取最高值(8.90 mg/L)校准品为高值标本5号,低高值3∶1混匀为2号,等量混匀为3号,1∶3混匀为4号,5个标本均测定4次;取其均值为测得值(Y)与设定的理论值(X)的直线回归方程和相关系数如下:Y=1.0241X-0.0502,r=0.9996,本试验测定数据均未发现离群点, 稀释变异为可接受(P=0.55,界限值P0.05=0.6841;现P<P0.05),线性失控检查结果说明线性良好(F=2.93,界限值F0.05=3.29;现F<F0.05)。上述结果表明:Cys-C线性范围为0.00~8.90 mg/L。
2.4 干扰试验
参考NCCLS评价方案(EP7-A文件)[18]。采用“配对差异”试验方法,将新鲜无溶血、无黄疸、无脂浊的混合血清分成2份,其中一份加入1/10体积的100 g/L血红蛋白液、8840 umol/L胆红素标准液或1/2体积的含甘油三酯18 mmol/L的脂肪乳作为测定(高值)标本5号;另一份则加入同等体积的生理盐水作为对照(低值)标本1号,低高值3∶1混匀为2号,等量混匀为3号,1∶3混匀为4号,4~5号标本分别重复测定4次, 1号标本重复测定20次,计算1~5号标本平均值和1号标本标准差(s),干扰值(2~5号)=2~5号平均值-1号平均值,干扰值大小在1号对照标本95%可信限(±1.96 s)范围内判断为无显著性干扰,否则为有显著性干扰。
试验结果表明:血红蛋白(负干扰)浓度水平≤5 g/L、胆红素(正干扰)浓度水平≤442 umol/L和三酰甘油(负干扰)≤9 mmol/L时对Cys-C测定均无显著性干扰。
3 讨论
临床检验所选用或所引进的分析方法,应具备两个重要的特性:①实用性:检测速度快、标本用量少、费用低廉和安全可行;②可靠性:方法学的各项技术性能指标必须达到要求,这是方法选择或引用中最重要的原则[19]。为了保证检验质量,临床实验室在使用新的分析方法进行患者标本检测前,必须用实验去评价它的基本性能。NCCLS评价方案文件对于检验医学的标准化具有重要的指导意义[20]。
上述研究结果显示,胶乳增强免疫透射比浊法测定血清Cys-C的平均回收率为97.1%,说明准确度符合要求[19];批内、批间、日间和总变异系数(CV)符合常规实验CV<5%的要求,说明精密度符合要求;线性范围较宽(0.00~8.90 mg/L);干扰因素少。该法采用现成的生化分析仪进行检测,与以前的其他检测方法相比,有自动化程度高、操作简便、检测速度快、标本用量少、成本低和因人工操作步骤少而引起的误差大大减少等优点,而且本法所用的试剂本身和反应产物对环境无污染,对操作人员无伤害。总之,胶乳增强免疫透射比浊法是目前临床实验室常规测定血清Cys-C的首选方法。
[1]邢延芳,谷秀娟,李慧.颗粒增强免疫比浊法测定胱抑素C干扰因素分析[J].延安大学学报(医学科学版),2010,8(4):38.
[2]刘莲琴.胱抑素C评价肾小球滤过率作用的研究[J].中国医药导报,2010,7(32):23.
[3]府伟灵.肾脏疾病标志物的研究概况[J].国外医学:生物化学与检验学分册,2004,25(2):97.
[4]蔡钢强,垢敬.胱抑素C的生物学特性及临床应用评价[J].国际检验医学杂志,2006,27(5):457-458.
[5]胡勤辛,王强,于小妹,等.近红外颗粒速率免疫透射法测定血胱抑素C的性能评价[J].实验与检验医学,2008,26(3):291.
[6]王永卿,李春芸,杨瑶.血清RBP、CysC测定在肝、肾疾病诊断中的应用[J].海南医学,2010,21(22):49.
[7]Le Bricon T,Thervet E,Froissart M,et al.Plasma cystatin C is superior to 24-h creatinine clearance and plasma creatinine for estimation of glomerular filtration rate 3 months after kidney transplantation[J].Clin Chem,2000,46(8):1206-1207.
[8]Tenstad O, Roald AB,Grubb A, et al.Renal handling of radiolabelled human cystatin C in the rat[J].Scand J Clin Lab Invest,1996,56(5):409-414.
[9]Newman DJ,Thakkar H,Edwards RG,et al.Serum cystatin C measured by automated immunoassay: a more sensitive marker of changes in GFR than serum creatinine[J].Kidney Int,1995,47(1):312-318.
[10]Finney H,Newman DJ, Gruber W, et al.Initial evaluation of cystatin C measurement by particle enhanced immunonephelometry on the Behring nephelometer systems BNA, BNII[J].Clin Chem,1997,43(6):1016-1022.
[11]Fanos V,Mussap M,Plebani M,et al.Cystatin C in paediatric nephrology.Present situation and prospects[J].Minerva Pediatr,1999,51(5):167-177.
[12]忻鼎广,石娟娟,黄亚.血清胱蛋白抑制剂C的初步临床应用[J].上海医学检验杂志,2001,16(5):283-284.
[13]Mussap M,Dalla Vestra M,Fioretto P,et al.Cystatin C is a more sensitive marker than creatinine for the estimation of GFR in type 2 diabetic patients[J].Kidney Int,2002,61(4):1453-1461.
[14]单立新.血清胱抑素C测定的临床意义及方法学进展[J].吉林医学,2011,32(6):1195.
[15]周天龙.血清胱抑素C的检测及临床意义[J].咸宁学院学报:医学版,2007,21(6):565.
[16]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:72,470.
[17]杨昌国,许叶,张抗.精密度评价和方法比较中NCCLS评价方案的应用[J].临床检验杂志,1999,17(1):47-49.
[18]杨昌国,许叶,张抗.线性评价和干扰试验中NCCLS评价方案的应用[J].临床检验杂志,1999,17(1):184-186.
[19]李影林.中华医学检验全书(上卷)[M].北京:人民卫生出版社,1996:617,628-629.
[20]Laverdiere M,Restieri C,Habel F.Evaluation of the in vitro activity of caspofungin against bloodstream isolates of Candida species from cancer patients:comparison of Etest and NCCLS reference methods[J].Int J Antimicrob Agents,2002,20(6):468-471.
