三七总皂苷对大鼠血管平滑肌细胞增殖模型细胞周期相关蛋白表达的影响
2012-01-29黄小平邓常清
黄小平,陈 刚,邓常清*
(湖南中医药大学,湖南 长沙 410208)
三七总皂苷对大鼠血管平滑肌细胞增殖模型细胞周期相关蛋白表达的影响
黄小平,陈 刚,邓常清*
(湖南中医药大学,湖南 长沙 410208)
目的 研究三七总皂苷(TPNS)对大鼠血管平滑肌细胞(VSMC)增殖细胞周期相关蛋白表达的影响。方法以血小板衍生生长因子-BB(PDGF-BB)诱导大鼠VSMC,观察含药血浆对VSMC增殖的影响,以免疫荧光流式细胞术测定增殖细胞核抗原(PCNA)及细胞周期相关蛋白的表达。结果 血小板衍生生长因子(PDGF)剌激VSMC后,VSMC PCNA、VSMC细胞周期蛋白D1(cyclinD1)、细胞周期蛋白依赖性激酶4(CDK4)蛋白表达增强,细胞周期抑制因子P21蛋白表达下调。阿托伐他汀含药血浆和TPNS含药血浆均可抑制PDGF诱导的VSMC PCNA、cyclinD1和CDK4蛋白表达增强及P21蛋白表达下调。TPNS与阿托伐他汀比较差异无统计学意义(P>0.05)。结论 PDGF剌激VSMC后,可促进细胞周期转化,细胞增殖加快。阿托伐他汀、TPNS可抑制PDGF诱导的VSMC增殖,其作用可能是通过抑制了细胞周期相关调节蛋白的表达,从而抑制了VSMC细胞周期转化和增殖。
三七总皂苷;血管平滑肌细胞;大鼠;增殖细胞核抗原;细胞周期蛋白D1;细胞周期蛋白依赖性激酶4
三七总皂苷(Total Panax Notoginseng Saponin,TPNS)是从中药五加科植物三七panax notoginseng(Burk.)F.H.Chen干燥根中提取的皂苷类有效组分,其主要有效成分为人参皂苷Rg1、人参皂苷Rb1和三七皂苷R1等。Lin等[1]的研究表明,TPNS可显著抑制高脂血清对VSMC的促增殖作用。研究表明,在大鼠主动脉球囊损伤血管内膜增生模型,TPNS可抑制血管内膜增生,抑制VSMC过度增殖,具有抗血管再狭窄的作用[2-3]。但TPNS抗血管再狭窄的机制还不清楚。由于VSMC在血管增殖性病变中具有重要的地位,为进一步阐明其作用机制,本研究采用血小板衍生生长因子(PDGF)诱导的VSMC增殖模型,研究TPNS抗VSMC增殖的作用及其细胞周期调控机制。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague-Dawley大鼠由湖南省卫生防疫站实验动物中心提供。体质量120~150 g,雌雄各半。合格证号:医动字第20-010号。饲养环境:室温18~20℃,湿度65%~70%,自由饮水进食。
1.1.2 药物 TPNS购自广西梧州制药(集团)股份有限公司,批号:071119。TPNS系从三七(panax notoginsen)中提取的皂苷类活性成分[3]。以高效液相色谱法测定TPNS主要有效成分的含量[3],含人参皂苷Rg150.4%,人参皂苷Rb130.9%,三七皂苷R112.5%。阿托伐他汀(atorvastatin),规格 10 mg/片,Godecke GmbH生产,辉瑞制药有限公司分装,批号:080117。临用时以去离子蒸馏水配成2 mg/mL混悬液。
1.1.3 试剂 杜尔伯科改良伊格尔(DMEM)培养基、胰蛋白酶(1∶250)购自美国Gibico公司;DMEM培养基以超纯水配制,过滤除菌,-20℃保存;胎牛血清(FCS)购自杭州四季青试剂公司,56℃灭活补体30 min,过滤除菌后分装,-20℃保存。血小板衍生生长因子-BB(PDGF-BB)、碘化丙啶(Propidium iodide,PI)、二甲基亚砜(DMSO)等均购自 Sigma 公司;其余试剂均为分析纯。抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 抗体和抗 p21蛋白抗体,为小鼠抗大鼠单克隆抗体,购自Santa Cruz公司;抗CDK4抗体和抗β-actin抗体为小鼠抗大鼠多克隆抗体,购自北京博奥森生物试剂公司;第二抗体异硫氰酸荧光素(FITC)标记的羊抗小鼠抗体用于 PCNA、cyclinD1、P21、CDK4 的测定,第二抗体HRP标记的兔抗小鼠抗体用于β-actin的测定。以上二抗均购自Amersham公司。
1.1.4 仪器 CO2培养箱(产地:美国,型号:SHEL-LAB2300);流式细胞仪(美国产,型号:FACSCalibur)。
1.2 方法
1.2.1 大鼠主动脉平滑肌细胞培养和鉴定 原代细胞培养:采用组织贴块法培养[4]。传代培养取原代生长的 VSMC,以 Hank’s液洗涤后,以 0.25%胰蛋白酶消化,以 FCS终止反应,DMEM 培养基洗涤后,以含20%FCS的DMEM培养基制成1×106/mL细胞悬液进行传代培养。细胞鉴定:倒置显微镜下,培养的VSMC贴壁生长,细胞呈长梭形,放射性生长,细胞质透明,相互融合在一起。成束的细胞平行排列,呈铺路石样“峰-谷”状生长。用免疫细胞化学法测定VSMC的SMα-actin表达,可见到VSMC胞浆中SMα-actin呈阳性表达。实验用VSMC 4-6代传代细胞。
1.2.2 含药血浆的制备 按文献方法[5],将大鼠随机分为空白组、TPNS(200 mg/kg)组和阿托伐他汀(20 mg/kg)组。每组10~12只。空白组灌胃等量蒸馏水(给药体积为10 mL/kg),各给药组分别灌胃药物。每天给药2次,分别在上午9时和下午4时。连续灌胃7次后,于末次给药2 h后,腹腔注射10%水合氯醛麻醉,颈总动脉取血,以1.5%乙二胺四乙酸(EDTA)-Na2 抗凝(血液∶抗凝剂=9∶1),在 4 ℃3 000 r/min离心15 min,取血浆,将各给药组各鼠血浆等量混合即为含药血浆,空白组各鼠血浆等量混合即为空白血浆,除菌后分装,-70℃保存。
1.2.3 VSMC细胞周期及相关蛋白表达的测定 根据以往研究[6],空白血浆浓度为10%,细胞培养24 h,对VSMC增殖的抑制率为8%,TPNS含药血浆和阿托伐他汀含药血浆对PDGF-BB诱导的VSMC增殖的半数抑制浓度(IC50)均为(13±3)%,故设定空白血浆和含药血浆的终浓度均为10%。将培养细胞分为无血浆空白对照组、PDGF刺激组、空白血浆组、TPNS含药血浆组、阿托伐他汀含药血浆组,用无血清培养基培养24 h使细胞生长同步化于G0期,然后分别加入各含药血浆(终浓度10%),3 h后加入PDGF-BB(终浓度 10 ng/mL),培养 24 h后测定。运用免疫荧光流式细胞分析术测定细胞周期相关蛋白CyclinD1、CDK4、P21和增殖相关蛋白 PCNA的表达。 取 1×106/mL细胞悬液 1mL, 加入 80%乙醇1 mL-20℃放置2 h,用PBS液洗涤后加入0.25%Triton X-100冰浴5 min, 样品管加一抗(1∶100)20 μL,避光4℃过夜,PBS洗涤后加入FITC标记的羊抗小鼠多克隆抗体(1∶40),37℃避光30 min后加入含PI(10 g/L)和0.1%核糖核酸酶A的PBS缓冲液 1 mL避光37℃ 30 min。采用流式细胞仪检测,激发光波长为506 nm,发射光波长为526 nm,以平均荧光强度值(MFI)反映所测蛋白表达的相对量。
1.3 统计学分析
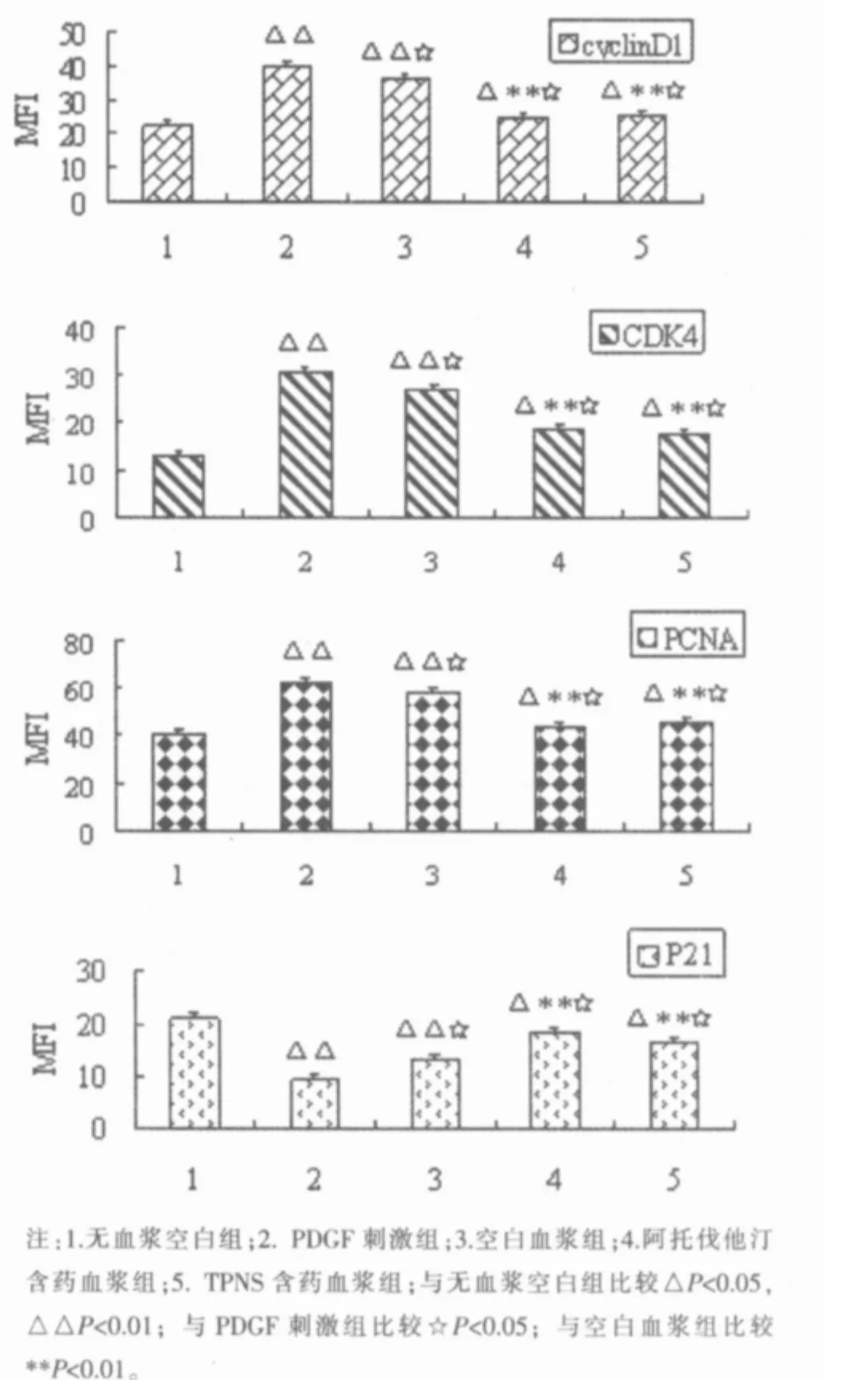
图1 各组细胞周期相关蛋白表达比较的柱状图(,n=5)
2 结果
与无血浆空白组比较,PDGF刺激组CyclinD1、CDK4、PCNA 蛋白表达均显著增强(P<0.01),P21 蛋白表达显著降低(P<0.01)。空白血浆组CyclinD1、CDK4、PCNA表达均显著高于无血浆空白组(P<0.01),但表达均低于 PDGF 刺激组(P<0.05);空白血浆组P21表达也显著低于无血浆空白组(P<0.01),但略高于 PDGF 刺激组(P<0.05)。 TPNS含药血浆组和阿托伐他汀含药血浆组与空白血浆组比较,CyclinD1、CDK4、PCNA 表达均显著降低(P<0.01),P21 表达均显著增高(P<0.01)。但各含药血浆组与无血浆空白组比较,CyclinD1、CDK4、PCNA 表达均升高(P<0.05),P21 表达降低(P<0.05)。 而两个含药血浆组之间比较差异均无统计学意义。(P>0.05)。见图 1。
3 讨论
VSMC的异常增殖是血管增殖性疾病发生的重要因素。已有研究表明,血管紧张素受体拮抗剂、降血脂药羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂等可对抗VSMC增殖,延缓血管增生性病变的发生[7-8]。进一步开展中药及其有效成分抗血管再狭窄的研究,从中寻找确有效应的中药及其成分,这对于提高血管增殖性病变防治的疗效具有重要的意
生长因子作用于VSMC膜受体,激活细胞内信号传导通路,导致核内基因表达,从而调控VSMC的增殖。血小板衍生生长因子(PDGF)等为刺激VSMC增殖的主要生长因子。PDGF家族成员有PDGF-A、B、C、D。 PDGF-BB 能刺激多种细胞如VSMC、成纤维细胞、胶质细胞的分裂增生,促进DNA合成和细胞分裂、增殖[9],常作为促VSMC增殖的生长因子使用。故在本研究中,以PDGF-BB刺激VSMC增殖为本研究的模型。
PCNA是一种与细胞增殖有关的参与DNA合成的核蛋白,仅能在增殖细胞中合成和表达,是S期的特异性标记,其表达水平与细胞增殖程度成正比[10]。本研究表明,PDGF剌激后,PCNA表达增强。表明在PDGF剌激后,VSMC增殖增快。与PDGF剌激组比较,空白血浆可使PCNA表达降低,这可能是血浆中含有的抗凝剂EDTA-Na2对细胞的影响所致。阳性对照药阿托伐他汀含药血浆和TPNS含药血浆均可抑制PDGF诱导的VSMC PCNA表达,表明二者对PDGF诱导的VSMC增殖具有抑制作用。
细胞增殖取决于细胞在细胞外信号的作用下,细胞周期的有序进展。细胞周期主要依次由G1、S、G2和M 4个期组成。其存在两个限制点,决定细胞是否继续增殖或进入静止状态:一个限制点在DNA合成的开始即G1-S限制点,另一个在有丝分裂开始,即G2-M限制点,其中G1-S限制点更为重要,是生长因子及细胞外刺激作用的位点。G1-S限制点主要被一系列细胞周期蛋白(Cyclins)和细胞周期蛋白依赖激酶(CDK)调控,其中主要为Cyclin D/CDK4、CDK6 和 Cyclin E/CDK2 等[11-12], 它 们 在VSMC由非增殖状态向增殖状态的转变过程中起决定性作用。cyclin D包括D1、D2、D3,作用类似于生长因子传感器,将细胞外的信号与细胞周期的进行连接在一起,是CDK的活性辅助因子,cyclinD/CDK4(或 CDK6)对 G1/S转换是必需的[13]。P21和P27蛋白属细胞周期蛋白依赖激酶抑制剂(CKI)家族,主要抑制G1-S限制点中的各种周期蛋白及CDK,使细胞停滞于G0-G1期。研究表明,P21、P27蛋白与VSMC增殖呈负相关[14]。
本实验结果表明,PDGF剌激后,培养VSMC cyclin D1和CDK4蛋白表达增强,P21蛋白表达下调,提示促进细胞周期转换的调节因子活性增强,抑制因子活性降低,从而促进了细胞周期转化。空白血浆也可使cyclinD1和CDK4蛋白表达轻度下调,P21蛋白表达轻度上调,可能与血浆中的抗凝剂EDTANa2的影响有关。阿托伐他汀含药血浆和TPNS含药血浆均可抑制PDGF诱导的VSMC cyclinD1和CDK4蛋白表达增强及P21蛋白表达下调,表明二者对细胞周期转化的抑制作用与下调cyclinD1和CDK4蛋白表达及上调P21蛋白表达有关。
[1]Lin S G, Zheng X L, Chen QY, et al.Effect of Panax notoginseng saponins on increased proliferation of cultured aortic smooth muscle cells stimulated by hypercholesterolemic serum[J].Acta pharmacologica Sinica, 1993,14(4):314-316.
[2]陈瑞芬,邓常清.三七总皂苷对大鼠血管内膜增生细胞周期蛋白表达的影响[J].湖南中医药大学学报,2009,29(4):11-14.
[3]Wu L,Zhang W,Tang YH,et al.Effect of Total Saponins of “Panax Notoginseng root” on aortic intimal hyperplasia and the expressions of cell cycle protein and extracellular matrix in rats[J].Phytomedicine, 2010,17(3-4):233-240.
[4]Rodríguez A, Fortuo A, Gómez-Ambrosi J, et al.The inhibitory effect of leptin on angiotensinⅡ-induced vasoconstriction in vascular smooth muscle cells is mediated via a nitric oxide-dependent mechanism[J].Endocrinology, 2007,148(1):324-331.
[5]Ma Q L, Sun M, Yang T L, et al.Effects of Tongxinluo on cell viability and tissue factor in AngⅡinduced vascular endothelial cell[J].Journal of Central South University(Medical Sciences), 2007,32(3):485-488.
[6]李 花,陈 刚,邓常清.补阳还五汤及其有效组分和三七总皂苷含药血浆抗血小板衍生生长因子诱导的血管平滑肌细胞增殖的作用[J].中西医结合学报,2009,7(11):1 078-1 085.
[7]Walter D H,Schchinger V,Elsner M,et al.Effect of statin therapy on restenosis after coronary stent implantation[J].The American Journal of Cardiology, 2000,85(8):962-968.
[8]Peters S, Götting B, Trümmel M, et al.Valsartan for prevention of restenosis after stenting of type B2/C lesions:the VALPREST trial[J].The Journal of Invasive Cardiology, 2001,13(2):93-97.
[9]Dandré F, Owens G K.Platelet-derived growth factor-BB and Ets-1 transcription factor negatively regulate transcription of multiple smooth muscle cell differentiation marker genes[J].American Journal of Physiology.Heart and Circulatory Physiology, 2004,286(6):2 042-2 051.
[10]Miniati D N, Hoyt E G, Feeley B T, et al.Ex vivo antisense oligonucleotides to proliferating cell nuclear antigen and Cdc2 kinase inhibit graft coronary artery disease[J].Circulation, 2000,102(19 Suppl 3):Ⅲ 237-Ⅲ 242.
[11]Pines J.Cyclins and cyclin-dependent kinases:a biochemical view[J].The Biochemical Journal, 1995,308(Pt3):697-711.
[12]Cheng Y, Liu P, Chen H, et al.Antiproliferative effects of trapidil in vascular smooth muscle cells are associated by inhibition of MAPK and P34(cdc2)activity[J].Journal of Cardiovascular Pharmacology, 2000,35(1):1-6.
[13]Braun-Dullaeus R C, Mann M J, Dzau V J.Cell cycle progression: new therapeutic target for vascular proliferative disease[J].Circulation, 1998,98(1):82-89.
[14]Coats S, Flanagan W M, Nourse J, et al.Requirement of p27Kip1 for restriction point control of the fibroblast cell cycle[J].Science, 1996,272(5263):877-880.
(本文编辑 彭芝配)
Effects of total Panax notoginseng saponins on the expression of cell cycle-related proteins of rat vascular smooth muscle cells proliferation model
HUANG Xiao-ping, CHEN gang, DENG Chang-qing
(TCM University of Hunan, Changsha, Hunan 410208, China)
Objective To discuss the impacts of total Panax notoginseng saponin(TPNS)on the cell cycle-related protein in the proliferation of vascular smooth muscle cells(VSMCs)proliferating model induced by platelet-derived growth factor(PDGF).Methods A VSMC proliferating model was established induced by PDGF-BB and the effects of rat plasma containing drugs on the VSMC proliferation were observed. The expressions of proliferating cell nuclear antigen(PCNA)and cell cycle-related proteins were determined with flow cytometry.Results After being stimulated by PDGF,up-regulation of PCNA,cyclinD1,cyclin-dependent kinase-4(CDK4)and down-regulation of p21 protein in VSMCs were observed.These changes were inhibited by atorvastatin and TPNS drug-containing plasma,and these effects in both groups were not significant(P>0.05).Conclusion PDGF can promote cell cycle conversion and quicken proliferation of VSMCs.Atorvastatin and TPNS maybe inhibit effectively the VSMC proliferation induced by PDGF with suppressing the expression of cell cycle-related proteins.
Total Panax notoginseng saponin;vascular smooth muscle cell;rat;proliferating cell nuclear antigen;cyclin D1;cyclin-dependent kinase 4
*邓常清,男,教授,博士研究生导师,E-mail:dchangq@yahoo.cn。
R285.5
A
10.3969/j.issn.1674-070X.2012.05.004.021.04
2012-02-19
国家自然科学基金资助项目(30572301)。
黄小平(1974-),女,湖南常德人,医学硕士,讲师,主要从事心脑血管疾病的研究。
