磁共振成像在大鼠脑出血模型制作中的初步应用研究
2012-01-26付怀栋潘永进王秀彬林福军杜守云
付怀栋,潘永进,王秀彬,林福军,杜守云
(1.江苏省灌云县人民医院神经内科 222200;2.江苏省南通大学附属医院神经内科 226001)
磁共振成像在大鼠脑出血模型制作中的初步应用研究
付怀栋1,潘永进2,王秀彬2,林福军1,杜守云1
(1.江苏省灌云县人民医院神经内科 222200;2.江苏省南通大学附属医院神经内科 226001)
目的探讨磁共振成像(MRI)在大鼠脑出血(ICH)模型制作中的应用。方法 采用自体血立体定向注入大鼠尾状核建立脑出血模型,术后24h进行神经功能评分,同时应用研制的串联线圈对大鼠进行头颅MRI,比较两种方法对判断大鼠脑出血模型制作中模型成功与否的可靠性。结果经过神经功能评分判断为模型成功的30只大鼠,头颅MRI显示有10只大鼠血液反流入皮质、破入脑室或蛛网膜下腔,其余20只大鼠在右侧基底节区可见大小一致的血肿。结论应用3.0TMRI结合串联线圈可以获得高质量的图像,准确判断大鼠脑出血模型制作是否成功。
磁共振成像;脑出血;大鼠;神经功能缺损评分
脑出血(intracerebral hemorrhage,ICH)是威胁人类健康及生活质量的重要事件之一。目前,对脑出血组织学和病理生理学过程的研究越来越深入,但是,基础研究除了要有稳定的动物模型,而且需要有可靠的用于检测模型是否成功的方法和手段,以便得出的数据更有可比性,结果更可靠。
1 材料与方法
1.1 实验动物 选取健康成年雄性SD大鼠36只,体质量250~280g,由南通大学实验动物中心提供,分为假手术组6只大鼠[用于磁共振成像(magnetic resonance imaging,MRI)],模型组30只。
1.2 主要试剂及仪器 GE Signa Excite HD 3.0TMR机、鼠头立体定位仪(上海江湾I型C)、微量进样器(100μL,上海安亭微量进样器厂)、医用骨蜡(上海强生公司)、水合氯醛(广州汕头西陇化工厂)。
1.3 动物模型的制备 参照Rosenberg等[1]报道的方法制备大鼠脑出血模型,用10%水合氯醛腹腔麻醉大鼠(350mg/kg),将其俯卧位固定在立体定位仪上,调节门齿托的高度,使大鼠前囟、后囟处于同一水平,沿头皮正中切一长约10mm切口,用30%双氧水腐蚀颅骨上腱膜及颅骨外膜,无菌操作暴露前囟,定位于前囟前0.2mm,中线向右旁开3mm处钻一直径为1mm的小孔,进针深度为5.5mm(即尾壳核位置)。用40℃水温浴大鼠尾巴约5min后取出擦干,乙醇消毒后,在距离大鼠尾巴末端约2~3mm处剪断鼠尾,断尾取血50μL,用微量进样器在3~4min内缓慢注入,注血结束后留针10min后缓慢退针,局部用骨蜡封闭后缝合皮肤。所有操作均在无菌条件下进行,术毕将大鼠放回笼中饲养,自由活动进食进水。假手术组只刺针,不向脑内注血。
1.4 神经功能检测 术后24h,参照Longa评分标准[2]对所有大鼠进行神经功能评分:无神经功能缺损为0分;左侧前爪不能完全伸展为1分;行走时,大鼠身体向左侧转圈记为2分;行走时,大鼠身体向左侧(瘫痪侧)倾倒为3分;不能自发行走,有意识丧失记为4分。神经功能评分大于1分者说明模型制备成功纳入实验,不满足要求者排除本实验。得分越高说明神经功能受损越严重。
1.5 头颅磁共振扫描 对神经功能检测发现有功能缺损的大鼠,在脑出血模型制备24h后,进行头颅MRI,观察有无形成大小一致血肿,血肿有无破入脑室及蛛网膜下腔。线圈设计:采用4个表面线圈串联,线圈应用串联RLC谐振电路,根据1H在外加均匀磁场中进动拉莫尔定理,在3.0T磁共振机1H的进动频率为127.74MHz,应用网络分析仪测量反射系数S11为-21dB,f0为127.74MHz,△f为反射系数S11在-3dB时的带宽,测量其空载和负载时的品质因素Q分别为98和94。扫描序列为,轴位 T2WI:FRFSE-XL/90,TR 5000ms,TE 85ms,FOV 9.0cm×5.4cm,层厚1mm,间隔0.1mm,NEX 320/224/2。冠状位T2WI:FRFSE-XL/90,TR 2000ms,TE 85ms,FOV 8.0cm×8.0cm,层厚1mm,间隔0.1mm,NEX 320/192/2。
1.6 统计学处理 采用SPSS17.0统计软件进行统计分析。计量数据以±s表示,应用独立样本t检验进行组间比较,P0.05为差异有统计学意义。图像处理采用efilm图像处理软件。
2 结 果
2.1 神经行为学检测 术前所有大鼠神经功能评分正常,术后24h,模型组所有大鼠神经行为学评分明显增高,均达到Longa评分方法判断大鼠脑出血模型制作成功的标准,见表1。
表1 神经功能评分比较(±s)
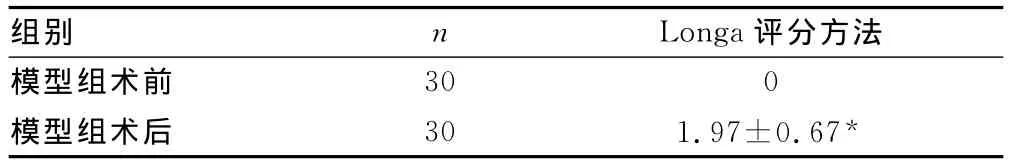
表1 神经功能评分比较(±s)
*:P 0.01,与术前比较。
组别 n Longa 评分方法模型组术前30 0模型组术后 30 1.97±0.67*
2.2 头颅MRI 对经过神经功能评分,达到入选标准的30只大鼠以及假手术组大鼠进行头颅MRI显示,头颅MRI机结合串联线圈可清楚地分辨灰质及白质结构,显示脑室的结构及颅内血肿的大小。假手术组大鼠颅内无异常信号,模型组发现有20只大鼠在右侧基底节区形成大小一致的血肿,另外10只大鼠血液反流入皮质、破入脑室或蛛网膜下腔,没有形成大小一致血肿。见图1。
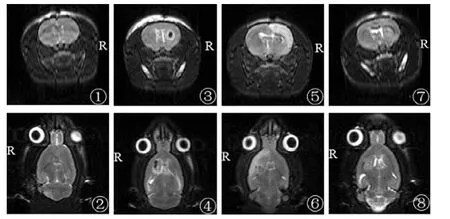
图1 大鼠脑出血模型MRI结果(冠状面与轴面T2WI图像,俯卧位扫描)
3 讨 论
出血性中风是临床常见的神经系统疾病,其较高的致死率和致残率仍是神经科学亟待攻克的难题。有关脑出血组织学和病理生理学的研究越来越深入,目前,用于研究脑出血组织学和病理生理学过程时的实验动物以大鼠最为常用,常用的实验性脑出血模型有以下4种:(1)自发性脑出血模型;(2)微球囊充胀脑出血模型;(3)胶原酶诱导法;(4)自体血立体定向注入的血肿制备方法。其中,自体血注入法应用了非肝素化自体血,较接近人类脑出血,适合研究脑出血的自然过程和病理形态学特点,更好地观察凝固过程中各种因子对脑组织代谢和血流的影响,从而为临床治疗提供依据。但自体血注入方法用于大鼠时的重复性差,并且注血量、血肿大小与部位难以掌握,其原因主要是注血速度稍快,血流往往顺针道溢出,进入蛛网膜下腔和硬脑膜下腔,且易破入脑室[3]。在本研究中,本组发现自体血注入方法制作模型时,30只经神经行为学检测判断为模型制作成功的大鼠,经头颅MRI显示只有20只大鼠在右侧基底节区形成大小一致的血肿,其余10只大鼠血液破入脑室、蛛网膜下腔和硬脑膜下腔,形成的血肿大小不等。这与操作者的熟练程度,采血、注血的时间,注血的部位、大鼠个体差异、仪器设备等有关,任何一个环节的问题均可导致模型制作的失败,有些是可以克服的,有些是无法避免的,因此,要判断制作的大鼠脑出血模型是否成功(即形成的血肿大小是否一致、部位是否相同、有没有破入脑室及蛛网膜下腔),就必须要有可靠的检测方法。
以往,用神经行为学检测来判断大鼠脑出血后神经功能缺损,同时用于判断大鼠脑出血模型是否成功,如Longa[2]评分方法、Corner Turnt试验[4]、Narrow-Alley Corner试验[5]等方法。本研究中,用Longa评分方法进行检测,发现所有模型组大鼠均有神经功能缺损表现,按照评分标准,说明脑出血模型是成功的,可以进行下一步相关研究,如测定脑含水量、免疫学检测、酶学方面、组织学方面等实验。但是,经过MRI发现,30只大鼠中,只有20只大鼠(占66.67%)在右侧基底节区形成了大小一致的血肿,这说明神经功能评分虽能判断有无神经功能缺损,但是用来判断脑出血模型是否成功具有不确定性,利用这些大鼠得到的实验结果可靠性差,这就需要一种稳定、可靠的检测方法来帮助判断脑出血模型是否成功。
大鼠模型MRI的研究常应用检查人体的各种线圈进行扫描,这些线圈均得不到很清晰的图像[6-7],因大鼠的各器官组织体积小,用扫描人体线圈扫描大鼠,成像的难度大,无法清楚显示内部结构,图像模糊。张海琴等[8]应用3.0T临床 MRI设备及正交腕关节线圈可以获得大鼠脑和脊髓高质量MRI图像,但扫描时间长,并需要用工作站进行图像后处理。MRI的质量主要看图像信噪比(signal to noise ratio,SNR),在 MR机不变的情况下,主要影响因素为射频线圈的性能。王秀彬等[9]研究结果显示,串联线圈的SNR比SNR最好的膝关节线圈高出6倍以上。本研究用3.0TMR机,结合研制的串联线圈对大鼠脑组织进行扫描发现,大鼠脑出血模型的T2WI能清楚地分辨灰质和白质,很好地显示脑室的结构和血肿的位置及大小,准确判断大鼠脑出血模型制作是否成功,得出的结果直观、可靠,克服了以往神经行为学检测方法的不确定性、人为干扰因素大等缺点。
应用临床型MRI机结合研制的串联线圈能够得到清晰、分辨率高和对比度好的图像,能直观地判断制作的大鼠脑出血模型是否成功,而且,还可以进一步进行大鼠脑出血药物治疗后血肿和水肿的演变等方面的研究。
[1] Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801-807.
[2] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without cramectomy in rats[J].Stroke,1989,20(1):84-91.
[3] 李俐涛,杨燚,尹静,等.脑出血模型[J].河北医科大学学报,2006,27(5):496-498.
[4] Hua Y,Schallert T,Keep RF,et al.Behavioral tests after intracerebral hemorrhage in the rat[J].Stroke,2002,33(10):2478-2484.
[5] 陈绍春,潘伟生,李明,等.神经行为学实验Narrow-Alley Test及 Corner Test改良:Narrow-Alley Corner Test[J].中国实验动物学报,2007,15(6):406-409.
[6] Broekmann MA,Ulmer S,Leppert J,et al.Analysis of mouse brain using a clinical 1.5Tscanner and a standard small loop surface coil[J].Brain Res,2006,1068(1):138-142.
[7] Ulmer S,Reeh M,Krause J,et al.Dynamic contrast-en
hanced susceptibility-weighted perfusion MRI(DSC-MRI)in a glioma model of the rat brain using a conventional receive-only surface coil with a inner diameter of 47mm at a clinical 1.5Tscanner[J].J Neurosci Methods,2008,172(2):168-172.
[8] 张海琴,李坤成,于春水,等.临床应用型MR大鼠中枢神经系统成像的初步研究[J].中国医学影像技术,2008,24(9):1352-1355.
[9] 王秀彬,曹和涛,李敏,等.串联线圈大鼠MR成像的初步应用研究[J].中华放射学杂志,2010,44(9):991-994.
Preliminary study of MR imaging in making intracerebral hemorrhagemodelofrats
ObjectiveTo investigate the application of MR imaging in making the intracerebral hemorrhage(ICH)model of rats.MethodsThe ICH model was established by infusing autologous blood 50μl into the right caudate nucleus in rats.At 24hafter operation,the behavioral tests were tested,and then MR scanning was performed on the self-made aqueous solution phantom with the series coil.The reliability of the twoMethodswas compared for the evaluation of the success of the rat ICH model.Results30rats showed significant neurological deficits in the behavioral tests were judged as the successful models.MR scanning showed that the blood of 10rats was broken into the ventricles or subarachnoid,the same size of hematoma was seen in the basal ganglia of the other 20rats.ConclusionThe high quality MR images can be obtained by 3.0TMR combined with series coils.MR imaging can be used as a method judging the success of the rat ICH model.
magnetic resonance imaging;cerebral hemorrhage;rats;neurological behavior
10.3969/j.issn.1671-8348.2012.16.017
A
1671-8348(2012)16-1607-02
2011-11-08
2011-12-27)
•经验交流•
