便携式游离血红蛋白检测仪的研制
2012-01-26赵鹏吴太虎孙建军
【作 者】赵鹏,吴太虎,*,孙建军
1 南方医科大学生物医学工程学院,广州,510515
2 军事医学科学院卫生装备研究所,天津,300161
0 引言
全血或血液制品在采集、处理、保存和运输过程中,由于各种原因,尤其是冷链保障过程中保存条件不当,会引起红细胞破裂。溶血是红细胞膜的完整性受到裂解或破损并释放血红蛋白的过程[1-2]。溶血后,游离血红蛋白将裂解成二聚体与结合珠蛋白结合,进而通过网状内皮系统清除,但一旦超出结合珠蛋白的结合能力,病人输血时将会发生血红蛋白血症[3]。因此,溶血程度是评价红细胞质量的重要参数。虽然已有多种措施用于提高红细胞在血液处理、保存、运输和输注过程中的稳定性,但红细胞在离体后仍将有溶血的危险。目前,通常以游离血红蛋白浓度划分溶血程度[1~3],即采用不大于0.8% 或1% 溶血(相对应的游离血红蛋白浓度至少不大于200 mg/dl)作为评估输注血液制品的标准[1]。游离血红蛋白浓度的测定对评价红细胞溶血的程度具有重要的价值。本系统按照可见分光光度法的设计原理,使用500 nm波长的蓝绿光作为光源,照射经联苯胺法配制的样本,通过的光信号经放大处理后,利用朗伯-比尔定律计算出吸光度。在浓度0~200 mg/dl范围进行了大量的检测试验,将试验数据的统计平均值应用最小二乘法拟合,得到了较理想的吸光度和浓度线性关系曲线,实现对游离血红蛋白浓度的测定。
1 测量原理
游离血红蛋白的定量分析方法,分直接光谱法和化学法两种。由于血浆(清)对本底测定存在干扰,临床检验普遍采用化学法。其中,国际血液学标准化委员会推荐氰化高铁血红蛋白法作为全血测定的标准方法,但是血红蛋白转化为氰化高铁血红蛋白后,有类似过氧化物酶的作用会影响测量的结果[4],所以,本文采用了测定血浆(清)游离血红蛋白的经典方法—联苯胺比色法。
1.1 分光光度法
光谱法测量就是定量检测游离血红蛋白对特定波长的光吸收。每一种物质根据特定的内部结构和能级状态,都有其特定的吸收光谱。所以,可根据物质的吸收光谱来分析物质的结构和含量。根据血红蛋白吸收光谱的特性,测定的光谱法主要包括:近红外光谱法(760、850 nm),三波长(560、576、592 nm)法和紫外分光光度法(414 nm)等[5~7]。
入射光源的波长选择至关重要,应该选择游离血红蛋白吸收率较高,或者与除游离血红蛋白外的物质吸收率差异显著的波段,从而提高信噪比,降低干扰因素。一般输注的血液按常规可保存35 ~ 42 d,在保存期中红细胞的膜完整性和流动性有很大改变。红细胞破裂后,游离的血红蛋白浓度明显上升。此时,根据溶血的程度呈现粉红色、红色,而红色对光的吸收范围在490 nm~530 nm[8]。本文选用500 nm的波长为光源,并使用PerkinElmer的LAMBDA35紫外分光光度计,在300~600 nm波长范围内同时对游离血红蛋白标准液、胆红素、胆固醇和总蛋白等进行了光谱扫描,分析了血浆中各种成分对测量结果的影响程度,结果胆红素和胆固醇影响较大(如图1所示)。当将血浆样本经联苯胺试剂比色后,干扰减弱。

图1 . 胆红素和胆固醇的吸收光谱图Fig.1 Absorption spectra of bilirubin and cholesterol
1.2 朗伯-比尔定律
光与介质发生作用时,除发生反射现象和折射现象外,还将发生吸收现象。物质对光的吸收作用即为分子俘获光子的过程,既与分子内部能态结构有关,又与分子同光子的碰撞几率有关。对于均匀分布的连续体系,光的吸收满足朗伯-比尔定律,其数学表达式为:
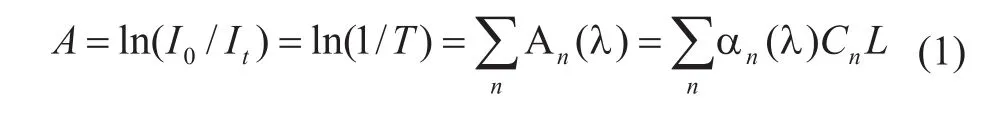
其中,A为吸光度,I0为入射辐射强度,It为透过辐射强度,T为透过率,Cn为成分n的浓度(mg/dl),L为光程长(m),αn为成分n的吸收系数(mg/dl*m)。吸收系数α是物质本身的固有性质,不同浓度的同一物质在相同波长处吸收系数相同。
公式(1)的适用条件为:
(1) 吸收过程中各物质间无相互作用,但各物质的吸收度具有可加合性;
(2)辐射与物质的作用仅限于吸收过程,无荧光、散射光等现象;
(3)吸收物是一种均匀分布的连续体系。
除以上条件外,在实际应用过程中会受到诸多因素的干扰。
2 系统设计
游离血红蛋白检测仪由采集模块、微控制处理模块和人机交互模块组成。其中,采集模块按照分光光度法设计;微控制处理模块主要由AVR系列单片机ATmega88以及外围电路组成;人机交互模块包括键盘控制和液晶显示。
2.1 硬件设计
系统硬件设计由采集电路模块、微控制处理器模块、液晶显示模块、键盘控制模块和电源管理模块组成,如图2所示。
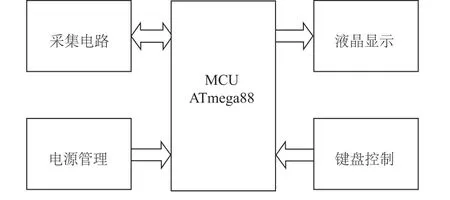
图2 系统硬件框图Fig.2 Block diagram of the system hardware
其中,信号的采集、处理电路主要按照分光光度法设计[8],由光源、吸收池、光敏探测器、放大电路、滤波电路和微处理器等6部分构成,如图3所示。
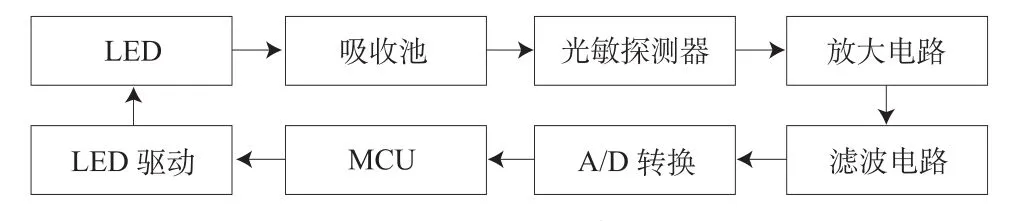
图3 信号采集、处理电路框图Fig.3 Circuit diagram of signal acquisition and processing
(1) 光源 光源除了波长的选择外,光辐射的强度和稳定性也是至关重要的。由于发光二极管(Laser Emission Diode,LED)作为一种新型光源正快速进入光谱分析领域,所以选用主波长为505 nm的LED作为光源,并采用MAX1916l的经典电路来驱动LED,以满足光源在特定的测量区域内光辐射强度和稳定性的要求。
(2) 吸收池 吸收池是指盛放液体样品或与样品作用的器件,又称比色皿。吸收池的材料因光谱区而异,在可见光区使用玻璃吸收池,在紫外区使用石英吸收池。本文实验使用常规的10 ml的玻璃或石英样品池。
(3) 光敏探测器 光敏探测器主要由光敏二极管及其电路构成。其作用是当光经过吸收池与样品作用后,检测携带样品信息的光信号,并将光信号转变为电信号,通过放大和滤波后,进行模数转换,以数字信号的形式输出。
(4) 信号处理和分析 一般信号的处理和分析由微处理器实现。主要通过控制光源驱动,将采集来的空白、样品光谱信号进行分析处理,实现对样品中游离血红蛋白的测定。具体功能的实现,除电路连接外,由软件完成,可见系统的软件设计。
(5) 其他外围电路 液晶显示采用MC141模块,主要进行了与ATmega88外围接口电路的设计。键盘控制模块共有4个按键,分别通过与单片机的I/O口连接。电源管理模块采用可替换的9 V电池供电和直流电源供电两种方式。由于游离血红蛋白浓度的测量不需要连续长时间的检测,只需在测量时驱动光源定时测量即可,因此采用正常——休眠的工作模式,有效地利用电能,大大降低功耗。
2.2 软件设计
系统软件设计在AVRStudio4平台下,通过对ATmega88编程实现了按键扫描、信号采集、计算分析、存储显示和电源管理等功能。系统软件设计流程图如图4所示。
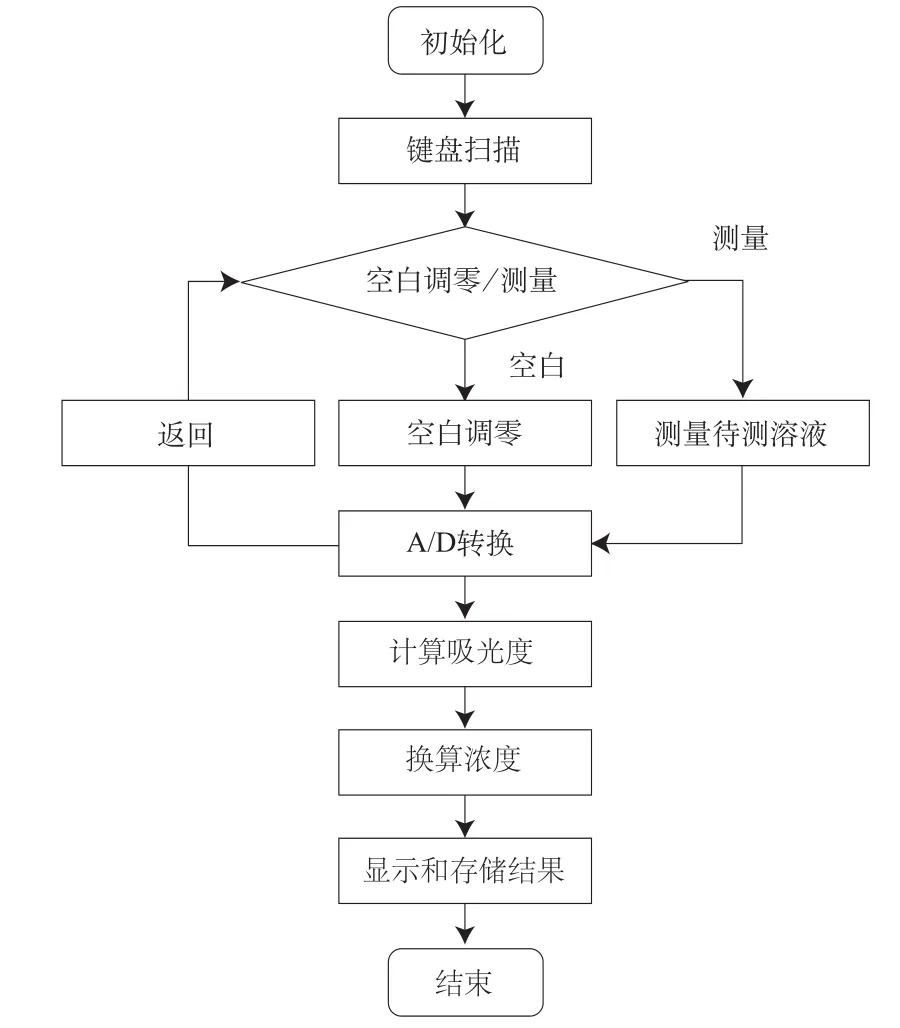
图4 系统软件设计流程图Fig.4 Software fl ow chart of the system
系统初始化后,首先判断各功能键是否按下,共有4个功能键,分别是空白调零、样品测量和历史数据浏览导航(▲和▼分别指示上一条和下一条测量记录)。若空白调零或样品测量功能响应,则MCU使能LED,并定时采集信号。信号经过A/D转换后,将统计平均值利用朗伯-比尔定律(式1),计算出吸光度,再代入最小二乘拟合多项式(如图5所示)得出浓度值,显示于液晶屏。若浏览数据导航功能响应,则可最多浏览最近测量的20条数据结果。单片机存储和液晶显示的结果包括测量序号、浓度、吸光度和溶血程度。最后,系统采用休眠——工作转化的电源管理模式,大大降低了系统功耗。
2.3 主要设计指标
(1)测量波长:500 nm;
(2)测量浓度范围:≤ 200 mg/dl;
(3)测量吸光度范围:≤ 1;
(4)测量溶血程度范围:≤ 1%;
(5)样品皿规格:10 ml。
3 实验与结果
为了光谱定量分析的精确,必须保证实验在相对一致的环境下操作。选用生理盐水作为空白溶液,将400 mg/dl 的FHb标准液稀释为(10~200) mg/dl的20个等级浓度的标准液。配制联苯胺试剂,分别标定(10~200) mg/dl的FHb标准液。使用空白溶液进行调零,分别对FHb标准液进行测定,并对单个FHb标准液进行多次测量,对实验数据结果取平均值(表1)。
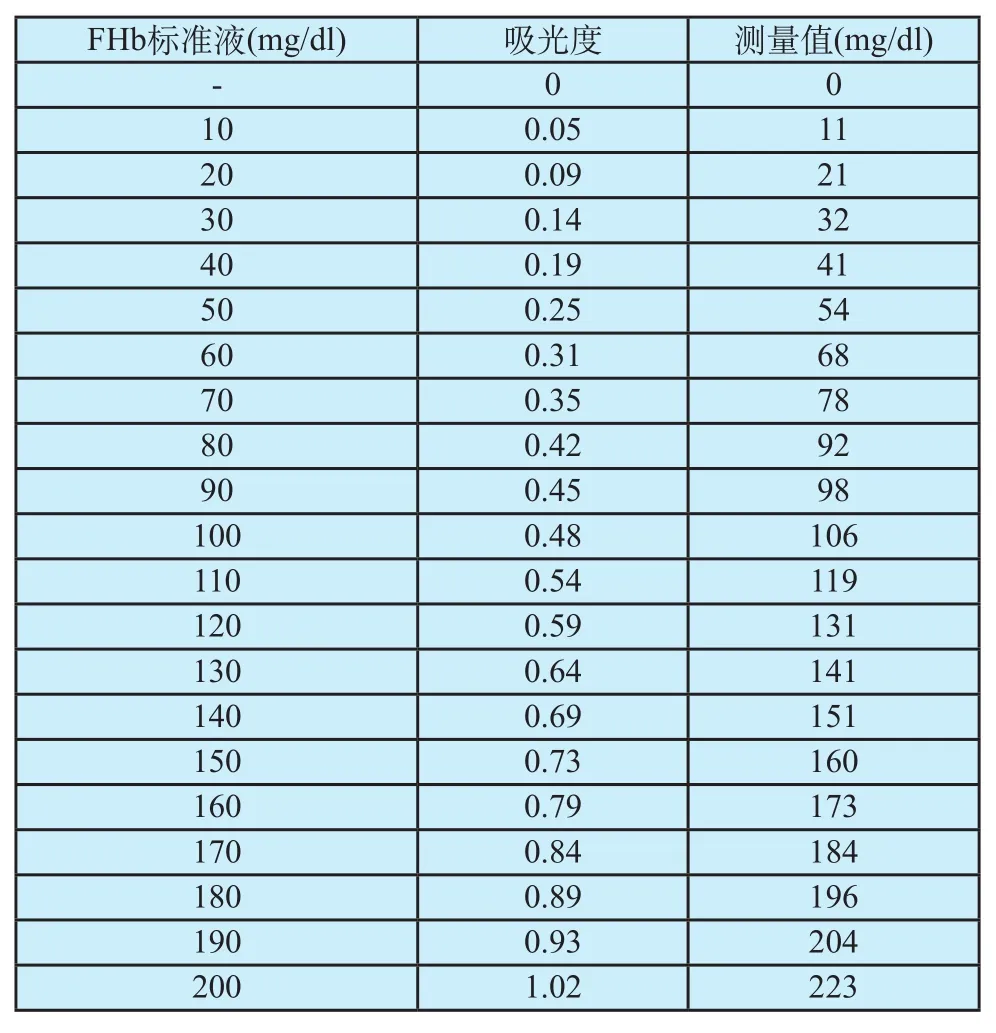
表1 标定测定数据Tab.1 Measurement data of the calibration
然后,利用朗伯-比尔定律,经最小二乘法拟合出吸光度和浓度之间的关系曲线。以下是测量吸光度和浓度关系的最小二乘拟合曲线(如图5所示),相关系数R2= 0.9998。
4 结论
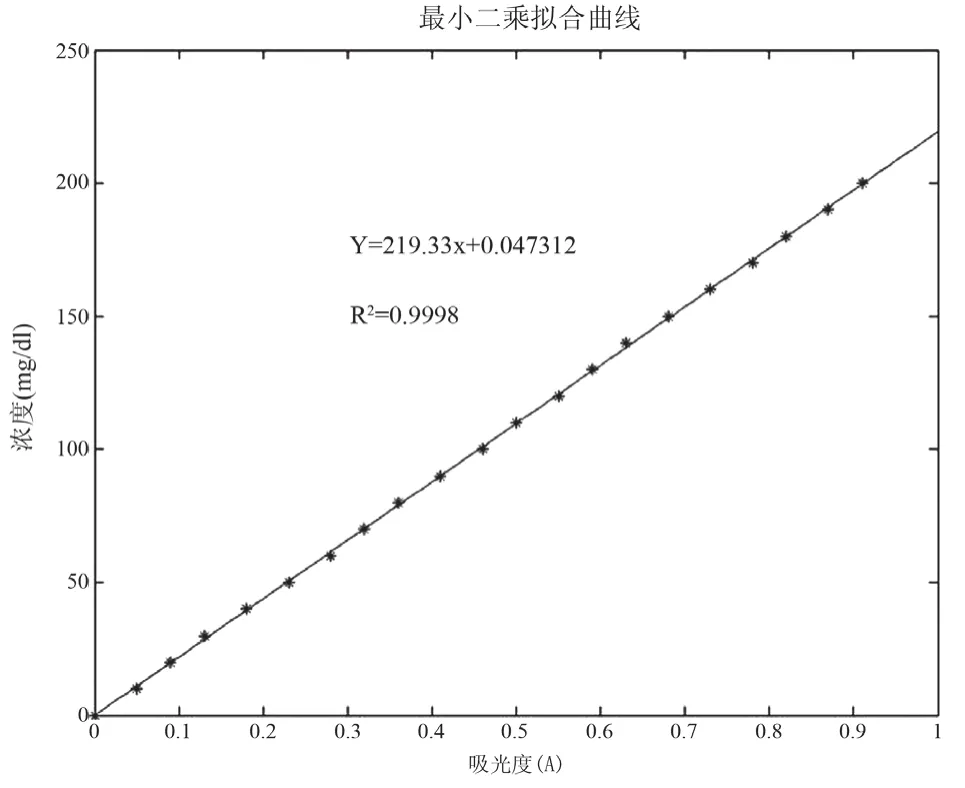
图5 吸光度和浓度关系的最小二乘拟合曲线Fig.5 The extinction-density curve based on Least Squares Fitting
在全血及成分血质量标准中,除悬浮红细胞外,对全血和冰冻解冻红细胞中游离血红蛋白有明确的规定[7],[9~11]。当血液或血液制品发生溶血后,对需要输注的血液进行游离血红蛋白浓度的测定尤为重要。一般采用观察法来判断溶血程度,虽然简便、快速,但是当游离血红蛋白浓度大于50 mg/dl后(呈淡红色和红色),并不能精确而真实地反应浓度大小以及溶血程度。化学法测量也有一定的局限性,在野外急需输血的情况下不易实现。
本文研制的游离血红蛋白检测仪,具有测量精度高、测量时间短、功耗低以及体积小便于携带的特点。目前,系统基本实现了对悬浮红细胞中游离血红蛋白的定量分析,对于全血的测定,由于其中若干干扰因素的存在,以及联苯胺法操作复杂,有稳定性差的缺点,影响了系统测定的准确性。今后,希望通过大量的临床试验,不断地完善系统设计,将测定误差消除。并在此基础之上,针对血液保存质量评估中游离血红蛋白浓度和溶血的关系进行进一步的探讨。
[1] Samuel O. Sowemimo-Coker. Red cell hemolysis in disposal process[J]. Transfusion Medicine Reviews, 2002, 16 (1): 46-60.
[2] 陈彦, 等. 溶血程度的划分及其意义[J]. 现代检验医学杂志, 2003,18(5): 64-65.
[3] 赵绥民. 溶血性输血反应的诊断与治疗[J]. 中国输血杂志, 2000,13 (2): 133-137.
[4] 刘春生, 等. 用氰化高铁血红蛋白液作标准测定血清游离血红蛋白[J], 川北医学院学报, 2000, 15(4): 83-84.
[5] 吴太虎, 等. 近红外光谱法无创测量人体血红蛋白浓度[J]. 激光生物学报, 2006, 15(2): 204~208.
[6] 何小利, 等. 血站型白细胞滤器过滤中溶血原因分析及处理[J].第三军医大学学报, 2004, 26(23): 2176.
[7] 王莉, 等. 紫外分光光度法检测血浆游离血红蛋白[J]. 中国输血杂志2006, 19(6): 478-479.
[8] 王洁. 光电比色计与分光光度计[M]. 北京: 中国计量出版社,1993
[9] 陶涛. SAGM悬浮红细胞中游离血红蛋白含量测定与分析[J]. 临床输血与检验, 2003, 5(4): 286.
[10] 王培华. 输血技术学[M]. 北京: 人民卫生出版社, 第2版, 2002
[11] GB18469-2001. 全血及成分血质量标准[S].
[12] 中华人民共和国卫生部医政司. 全国临床检验操作规程[M]. 南京: 东南大学出版社, 第2版. 1997.
