附子与甘草配伍前后乌头碱和甘草次酸在大鼠体内的药动学比较
2012-01-26王志琪曾嵘谭志荣陈尧田育望王蓓李鑫陈立峰
王志琪,曾嵘,谭志荣,陈尧,田育望,王蓓,李鑫,陈立峰
(1.湖南中医药大学干细胞中药调控与应用实验室湖南长沙410208;2.湖南中医药研究院中药新药研究与开发省重点实验室湖南长沙410013;3.中南大学临床药理研究所湖南长沙410078)
附子是毛茛科乌头属植物乌头Aconitum carmichaeliDebx.的干燥子根加工品[1]。附子味大辛,性大热,有大毒。中医常将配伍做为附子临床应用的主要减毒方法之一,正如《景岳全书》所云:“附子之性毒,得甘草而后解”。经《中药方剂数据库》[2]查询,含川乌、草乌或附子的方剂共10 480条,其中含甘草的共10 090条。目前附子配伍甘草减毒作用的研究主要从配伍前后毒性作用改变和煎液中毒性成分溶出量变化等方面进行,而从药动学角度考虑附子配伍甘草前后指标成分的体内行为比较研究报道较少[3]。
乌头碱是附子的主要有毒成分,治疗剂量和中毒剂量接近,容易引起中毒,但由于乌头碱煎煮过程中易于水解且代谢迅速,往往难以检测。实验研究[4-6]提示在进行甘草及有效成分的药动学研究时,大鼠是适宜的实验动物,甘草次酸是适宜的指标成分。本研究采用LC-MS/MS法测定大鼠血浆中乌头碱量,以LC-MS法测定大鼠血浆中甘草次酸量,并利用DAS2.1软件计算药动学参数,通过考察附子配伍甘草前后乌头碱和甘草次酸的体内药动学行为来探讨附子与甘草配伍的物质基础。
1 材料
1.1 药品与试剂附子(批号:20110716),甘草(批号:2011021805)均购自湖南三湘中药饮片有限公司(经湖南中医药大学炮制教研室杨梓懿教授鉴定)。乌头碱(纯度:98.5%,批号:MUST-11031101)购自成都曼思特生物科技有限公司;甘草次酸(纯度:100%,批号:110723-200612),维拉帕米(纯度:99.7%,批号:100223-200102)和熊果酸(纯度:100%,批号:110742-200516)均购自中国食品药品检定研究院;空白血浆购自长沙血液中心;色谱纯甲基叔丁基醚、乙腈、甲酸铵等购自CNW technologies GmbH公司;试验用水为娃哈哈纯净水;其余试剂均为分析纯。
1.2 仪器液相色谱系统:Waters AcQurity型超高效液相色谱仪带自动进样器和柱温箱,美国Waters公司;MS/MS系统:API4000型三重四级杆质谱仪,带电喷雾离子化源(ESI),美国生物应用公司;数据采集:Analyst软件,美国生物应用公司。分析天平:AB-265S型精密天平(日本梅特勒公司);混合器:漩涡混合器(上海沪西分析仪器厂);打印机:HP LaserJet 1020(HP公司,美国);数据处理:Analyst定量处理软件(美国生物应用公司),Microsoft Office XP(Excel)软件(美国微软公司),DAS2.1药代动力学软件。
1.3 动物与分组SD雄性大鼠156只,SPF级,体质量237~292 g,由长沙市开福区东创实验动物科技服务部提供,实验动物为大鼠,生产许可证号为SCXK(湘)2009-0012,实验动物合格证号为HNACSDC20101436。实验动物分为3个药物组,即附子单煎液组、甘草单煎液组和附子甘草合煎液组,每组各52只。
2 方法
2.1 药液的制备参考文献[7-8]的试验结果,称取生附子80 g,加水30倍(2 400 mL),浸渍30 min,回流提取,加热至沸腾,保持沸腾1 h,纱布过滤,滤液70℃减压浓缩,冷却后定容至1 000 mL,得附子单煎液;称取甘草80 g,按上述方法制备,得甘草单煎液;称取生附子和甘草各80 g,同法制备,得附子甘草合煎液。3种药液分别置于玻璃容器中,-4℃冰箱冷藏保存,待用。上述各药液中的乌头碱的定量采用LC-MS/MS法测定,甘草次酸的定量采用LC-MS法测定,以此计算给药量。
2.2 给药方案与血样的采集实验动物给药前禁食12 h,自由饮水。3个药物组分别灌胃给予附子单煎液、甘草单煎液和附子甘草合煎液,给药体积为2.5 mL/100 g。每药物组动物按体质量分层随机分为13个采血点:给药前和给药后5、15、30、60、120、180、300、480、600、720、1 440、1 680 min,每个采血点4只动物。给药后动物按时间点断头取血,每次采血2.0 mL,置于肝素化的玻璃管中,4 000 r/min,离心10 min,取上清血浆,-20℃冰箱冷冻保存,待测。
2.3 血药浓度测定血浆样品中乌头碱的测定采用前期实验已建立的LC-MS/MS法[9]。选择维拉帕米为内标,采用MTBE液-液萃取法处理血浆样品。样品采用HyPURITY Cyano(150 mm×2.1 mm,5 μm)柱分离,流动相为乙腈-10 mmol/L甲酸铵(70∶30,V/V),体积流量为0.3 mL/min。然后采用ESI源+MRM扫描分析。乌头碱和维拉帕米在ESI+源电离方式下主要生成[M+H]+峰,分别为m/z646.4和m/z455.2,选择此离子作为母离子,对母离子进行碰撞碎裂,碎裂后的子离子分别为m/z586.4和m/z164.9,以这两个子离子作为定量分析时监测的离子。经方法学考察,没有内源性物质干扰乌头碱和内标的测定,乌头碱在9.3~2 390 pg/mL范围内线性关系良好,最低检测质量浓度为9.3 pg/mL,低、中、高3个浓度质控样品的日内和日间变异均<15%,提取回收率均>85%,相对回收率在97.94%~101.14%,符合生物样品药物浓度测定方法学要求。所采集血样乌头碱浓度根据随行标准曲线计算,并随行测定低、中、高3个浓度的质控样品,超出标准曲线范围上限的样品用空白血浆稀释后测定。
血浆样品中甘草次酸的测定参考文献[10-11]建立的LC-MS法。选择熊果酸为内标,采用乙酸乙酯液-液萃取法处理血浆样品。样品采用HyPURITY Cyano(150 mm×2.1 mm,5 μm)柱分离,流动相为乙腈-10 mmol/L甲酸铵(85∶15,V/V),体积流量为0.3 mL/min。然后采用ESI源-MRM扫描分析。甘草次酸和熊果酸在ESI-源电离方式下碎裂后的子离子分别为m/z469.4和m/z455.4,以这两个子离子作为定量分析时监测的离子。经方法学考察,没有内源性物质干扰甘草次酸和内标的测定,甘草次酸在1.99~1019.2 ng/mL范围内线性关系良好,最低检测质量浓度为1.99 ng/mL,低、中、高3个浓度质控样品的日内和日间变异均<15%,提取回收率均>85%,相对回收率在100.04%~111.29%,符合生物样品药物浓度测定方法学要求。所采集血样甘草次酸浓度根据随行标准曲线计算,并随行测定低、中、高3个质量浓度的质控样品,超出标准曲线范围上限的样品用空白血浆稀释后测定。
2.4 数据处理将实验所得血药浓度-时间数据采用DAS2.1药代动力学软件进行智能拟合处理,以拟合血药浓度值与实验测定值的AIC最小作为判断标准,获得相关药动学参数。
3 结果
3.1 血浆中乌头碱和甘草次酸的测定按照2.5 mL/100 g大鼠体质量规格单次灌胃给药,用随行标准曲线法测得附子单煎液和附子甘草合煎液中乌头碱的给药量分别为0.14 mg/kg和0.13 mg/kg;甘草单煎液和附子甘草合煎液中甘草次酸的给药量分别为15.46 mg/kg和15.45 mg/kg。定量测定结果提示,按水煎法制备药液时,单煎与合煎对乌头碱和甘草次酸的定量影响不大。
大鼠单次灌胃给予单煎液和合煎液后乌头碱的平均血药浓度-时间曲线见图1。
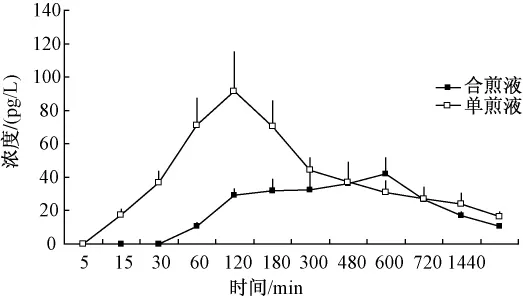
图1 大鼠单次ig后乌头碱的血药浓度-时间曲线图(±s,n=4)Fig.1 Concentration-time curve of aconitine in rat after oral adm inistration by single-dose(±s,n=4)
结果可知附子单煎液灌胃给药后,乌头碱吸收较快,给药后5 min即可检测到一定浓度的乌头碱;灌胃附子甘草合煎液后,乌头碱达峰时间后延。大鼠单次灌胃给予单煎液和合煎液后甘草次酸的平均血药浓度-时间曲线见图2。甘草单煎液灌胃给药后,药物吸收较慢,给药后2 h可检测到一定浓度的甘草次酸;灌胃附子甘草合煎液后,甘草次酸达峰时间后延。
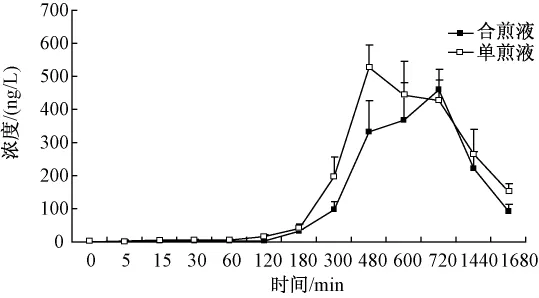
图2 大鼠单次灌胃后甘草次酸的血药浓度-时间曲线图(±s,n=4)Fig.2 Concentration-time curve of glycyrrhetic acid in rat after oral adm inistration by single-dose(±s,n=4)
3.2 药动学参数血药浓度-时间数据经DAS软件拟合表明,乌头碱和甘草次酸的药动学为非房室模型,故提供统计矩参数。大鼠单次分别灌胃给予药材单煎液和合煎液后乌头碱和甘草次酸的主要药动学参数见表1和表2。附子单煎液给药后乌头碱Cmax和AUC均较高,且达峰时间Tmax短而t1/2较长,表明附子单煎液中的乌头碱口服吸收快消除较缓慢。附子甘草合煎液中乌头碱Cmax和AUC均明显降低,Tmax明显延长,t1/2缩短,表明附子与甘草配伍后乌头碱的吸收收到明显抑制,吸收速度变慢,吸收的量减少,且消除加快。
表1 大鼠单次灌胃后乌头碱的主要药动学参数(±s,n=52)Tab.1 M ain pharmacokinetic parameters for aconitine of rat after single ingastric adm inistration(±s,n=52)
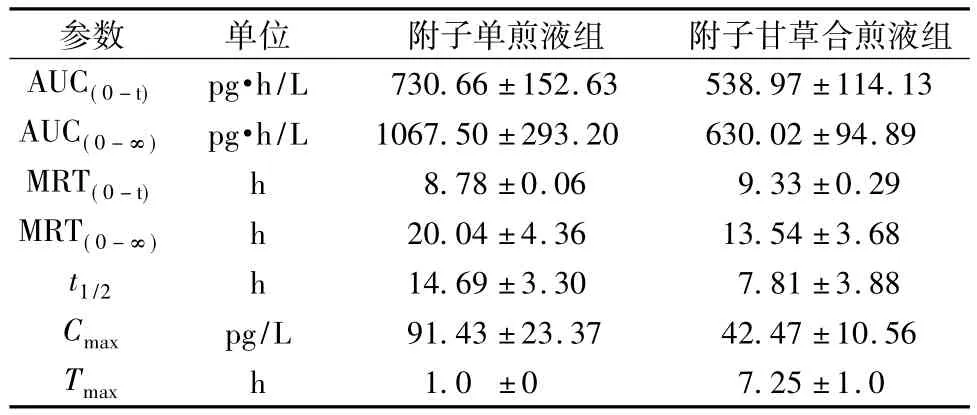
表1 大鼠单次灌胃后乌头碱的主要药动学参数(±s,n=52)Tab.1 M ain pharmacokinetic parameters for aconitine of rat after single ingastric adm inistration(±s,n=52)
h/L 730.66±152.63 538.97±114.13 AUC(0-∞)pg·h/L 1067.50±293.20 630.02±94.89 MRT(0-t)h 8.78±0.06 9.33±0.29 MRT(0-∞)h 20.04±4.36 13.54±3.68 t1/2 h 14.69±3.30 7.81±3.88 Cmax pg/L 91.43±23.37 42.47±10.56 AUC(0-t)pg·Tmax h 1.0±0 7.25±1.0
表2 大鼠单次灌胃后甘草次酸的主要药动学参数(±s,n=52)Tab.2 Main pharmacokinetic parameters for glycyrrhetic acid of rat after single ingastric adm inistration(±s,n=52)
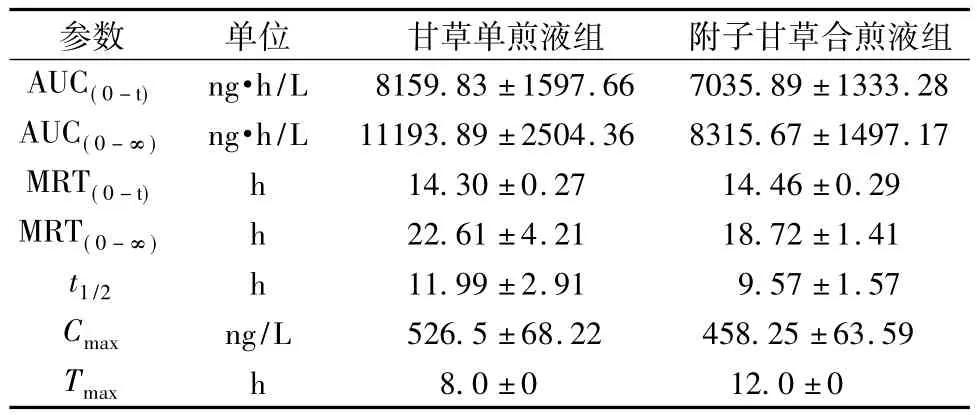
表2 大鼠单次灌胃后甘草次酸的主要药动学参数(±s,n=52)Tab.2 Main pharmacokinetic parameters for glycyrrhetic acid of rat after single ingastric adm inistration(±s,n=52)
h/L 8159.83±1597.66 7035.89±1333.28 AUC(0-∞)ng·h/L 11193.89±2504.36 8315.67±1497.17 MRT(0-t)h 14.30±0.27 14.46±0.29 MRT(0-∞)h 22.61±4.21 18.72±1.41 t1/2 h 11.99±2.91 9.57±1.57 Cmax ng/L 526.5±68.22 458.25±63.59参数单位甘草单煎液组附子甘草合煎液组AUC(0-t)ng·Tmax h 8.0±0 12.0±0
4 讨论
附子中主要含乌头类生物碱,甘草中主要含有甘草酸、甘草次酸等酸性皂苷类成分,附子和甘草是一对酸碱药对。附子和甘草配伍使用时甘草可降低附子的毒性作用,这一观点已被多数人认识,但具体的解毒环节和机理不甚清楚。药动学参数可直观反映药物的体内过程特点,故近年来药物特别是天然药物之间的相互作用与药动学特性改变之间的关系成为近年来研究药物相互作用的热点领域[12],尤其是对于治疗窗窄、需要进行用药监测的药物而言此类研究显得尤为重要。
实验中测定了药材单煎液和合煎液中乌头碱和甘草次酸的含量,结果显示甘草与附子配伍对毒性成分乌头碱和甘草主要生物活性成分甘草次酸的溶出并无明显,这一结果与文献[13]一致。实验中对大鼠单次分别灌胃给予药材单煎液和合煎液后乌头碱和甘草次酸的血药浓度进行了测定。结果显示单煎液中乌头碱在大鼠体内吸收迅速,消除需要相对较长时间,这与乌头类生物碱易引起急性中毒的特点吻合;单煎液和合煎液中甘草次酸的在大鼠体内吸收均较为缓慢,且24 h后仍可检测到较高浓度,这与文献[10]的情况相似;两药配伍使用后乌头碱和甘草次酸在大鼠体内的药动学行为均发生了改变:Tmax均推迟,Cmax均降低,吸收均受到抑制,t1/2均缩短。本实验数据提示:甘草与附子配伍的物质基础可能与其体外化学成分含量的变化无关,而是由于乌头碱与甘草次酸在体内发生了结合反应,延缓了其在胃肠道的吸收,加速其消除,从而发挥解毒作用。
[1]中华人民共和国药典委员会.中华人民共和国药典2010年版一部[S].北京:中国医科技出版社,2010.
[2]胡一冰.附子甘草药对组分配伍[D].成都:成都中医药大学,2005.
[3]王志琪,邹龙.甘草与其他药物相互作用的研究概况[J].中南药学,2011,9(11):857-860.
[4]Lin SP,Tsai SY,Hou YC,et al.Glycyrrhizin and licorice significantly affect the pharmacokinetics of methotrexate in rats[J].J Agric Food Chem,2009,57(5):1854-1859.
[5]Mizuhara Yasuharu,Takizawa Yukiho,Ishihara Kazuhisa,et al.The influence of the Sennosides on absorption of glycyrrhetic acid in rats[J].Biol Pharm Bull,2005,28(10):1897-1902.
[6]Hou Y C,Hsiu S L,Ching H,et al.Profound difference of metabolic pharmacokinetics between pure glycyrrhizin and glycyrrhizin in licorice decoction[J].Life Sci,2005,76(10):1167-1176.
[7]张宇燕,杨洁红.附子甘草配伍对乌头碱、甘草酸、甘草苷的动态影响[J].中国药学杂志,2009,44(1):11-14.
[8]裴妙荣,段秀俊,裴香萍.酸碱对药附子与甘草在四逆汤中配伍的化学研究[J].中国中药杂志,2009,34(16):2047-2050.
[9]王志琪,景贤,曾嵘,等.LC-MS/MS测定大鼠血浆中乌头碱的浓度[J].中国临床药理学与治疗学,2012,17(4):371-375.
[10]赵文静,王本杰,魏春敏,等.高效液相色谱-质谱法测定人血浆中甘草次酸浓度及人体药代动力学研究[J].山东大学学报:医学版,2008,46(11):1110-1113.
[11]Zhang Jing,Zhang Rui,Wei Chunmin,et al.A method for the quantitative determination of glycyrrhetic acid in plasma by LCMS/MS and its application in a pharmacokinetic study of ammonium glycyrrhetate[J].J Chin Pharm Sci,2011,20:389-389.
[12]Clemence T,Alvaro M V,Josias H H.Herb-drug pharmacokinetic interactions review[J].Drug Metab Toxicol,2010,6(12):1515-1538.
[13]徐珊珺,陈长勋,高建平.甘草与附子配伍减毒的有效成分及作用环节研究[J].中成药,2006,28(4):526-530.
