AFP在原发性肝癌组织和血清中的表达与临床、病理的相关性研究
2012-01-22刘胜荣黄晓红
刘胜荣, 刁 平,黄晓红
AFP在肝癌患者血清中的阳性率为70%~80%。原发性肝癌(hepatocellular carcinoma,HCC)血清中的AFP水平高低与肝细胞癌分化程度有关,并且其分布曲线呈两头低中间高。AFP的检测不仅有助于原发性肝癌的诊断,而且可以作为原发性肝癌的疗效考核标准,但并不能准确判断预后。原发性肝癌病理切片中的AFP表达与其血清AFP值之间是否存在联系尚不明确,AFP在病理组织中的表达强弱与预后的关系也未见报道。本课题通过对AFP在肝癌组织中的表达与血清AFP值关系以及与病理特点、预后的相关性进行研究,应用免疫组织化学方法检测108例原发性肝细胞癌组织、76例癌旁组织、10例正常肝组织AFP表达情况,结合有术前血清AFP检测值的61例患者进行比较研究,以探讨AFP与原发性肝癌生物学行为的关系及组织和血清AFP表达的相关性对原发性肝细胞癌预后的影响。
1 资料和方法
1.1 一般资料 肝癌组织108例为2000年1月至2004年12月莱阳卫校医院、莱阳中心医院进行肝癌切除术的标本,其中莱阳卫校医院31例,莱阳中心医院77例;男87例,女21例;年龄32~70岁,平均年龄54.56岁。所选病例均经病理证实为原发性肝癌,且术前均未行全身或局部化疗。癌旁肝硬化组织选自76例肝癌旁存在肝硬化的标本,另选择10例同期因胆道手术切除的部分正常肝组织为正常对照组织。所有病例均有完整随访资料,随访手术后存活时间,死亡时间为最后随访日期,即为终点。一直存活的患者,肿瘤未复发者存活时间增加12个月,复发患者存活时间增加6个月计算。
1.2 方法 采用免疫组化S-P法,AFP单克隆抗体、S-P免疫组化试剂盒购自福州迈新公司。将浓缩型AFP单克隆抗体按1∶200最佳稀释度稀释。染色步骤:常规石蜡切片脱蜡逐级乙醇入水;PBS冲洗5 min×3次;擦干切片周围多余液体;3%过氧化氢甲醛溶液处理,室温下于湿盒内作用20 min;PBS冲洗5 min×3次;滴加适当稀释的动物非免疫血清,室温下于湿盒内作用20 min,作用完毕后倾去多余血清液体,不冲洗;滴加AFP单克隆抗体,室温下湿盒内作用60 min;PBS冲洗5 min×3次;滴加生物素标记二抗,室温下于湿盒内作用20 min;PBS冲洗5 min×3次;滴加SP复合物,室温下于湿盒内20 min;PBS冲洗5 min×3次;滴加新配制的DAB显色剂,室温下5 min,镜下观察出现阳性结果且背景清晰时即可终止染色;自来水冲洗,苏木素复染,乙醇脱水,二甲苯透明,中性树胶封片。同时用PBS代替一抗作染色的阴性对照,用已知的阳性染色切片作阳性对照。
1.3 结果判断 光镜下胞浆染为淡黄至棕黄,为AFP阳性细胞表达。综合考虑切片中阳性细胞占所观察同类细胞数的百分比和阳性细胞染色强度两项指标,半定量判定结果。根据细胞染色程度进行4级评分:无色0分,淡黄色1分,棕黄色2分,棕褐色3分。每例随机选取不重复5个视野,计算每个视野中阳性细胞所占计数细胞百分比,根据切片中阳性细胞百分比进行5级评分:阴性0分,0<阳性细胞<25%为1分,25%≤阳性细胞<50%为2分,50%≤阳性细胞<75%为3分,阳性细胞≥75%为4分。采用二次计分法,将染色程度得分与阳性细胞百分比得分相乘,0≤乘积<3为阴性(-),3≤乘积<6为弱阳性(+),6≤乘积<9为中阳性(++),乘积≥9为强阳性(+++),阴性和弱阳性为低表达,中阳性为中表达,强阳性为高表达。
1.4 统计学处理 采用SPSS11.0统计软件进行数据处理。定量资料根据数据的正态分布与否,采用描绘,并行t检验(正态分布)。定性资料采用率或构成比描绘,并行χ2检验或Fisher精确检验。3组生存时间采用Newman-Keuls检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织中AFP的表达情况 AFP定位于细胞质内,阳性细胞的胞质染色为淡黄色至棕褐色。
2.2 AFP在HCC不同病理分级中的表达 根据Ednondson分级,HCCⅠ级50例中,AFP表达76%(38/50);Ⅱ级34例中,AFP表达76.5%(26/34);Ⅲ/Ⅳ级24例中,AFP表达8.3%(2/24)。中分化肿瘤组织AFP表达最强,高分化稍低,低分化肿瘤组织中AFP的表达最低。三者之间,差异有统计学意义(P <0.05),见表1。

表1 HCC组织AFP的表达强度与肿瘤病理分级的关系
2.3 癌组织、癌旁组织与正常肝组织中AFP表达的比较 癌组织中AFP的表达占61.1%(66/108),癌旁组织表达占100%(76/76),正常肝组织表达(0/10),三者之间差异有统计学意义(P<0.05)。
2.4 AFP表达强度与患者预后 108例肝癌组织中AFP的表达强度及对应预后平均生存时间见表2,显示AFP低表达者术后平均生存时间最短,肿瘤组织中AFP中表达者术后平均生存时间最长,肿瘤组织中AFP高表达者术后平均生存时间介于以上两组之间。3组生存时间采用Newman-Keuls检验,AFP低表达组生存时间短于中、高表达组(P<0.05),而中、高表达组间生存时间无明显差异(P>0.05)。
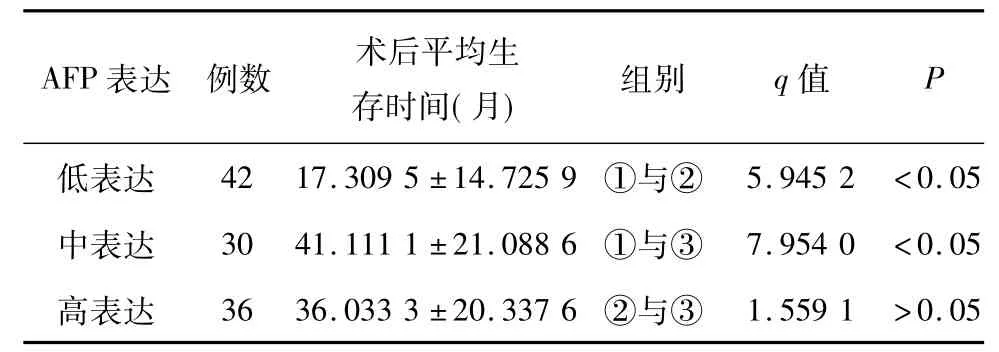
表2 原发性肝细胞癌组织中AFP表达与预后的关系
2.5 肝癌组织与血清中AFP关系 将有术前血清AFP检测值的61例患者癌组织的AFP表达情况和术前血清AFP检测值描记成曲线后发现,癌组织中AFP表达与血清中AFP含量关系基本成正相关,曲线不完全一致,但大体走势相同,呈两头低中间高(见图1)。

图1 HCC组织中AFP表达与血清AFP含量的关系
2.6 肝癌组织AFP表达与肿瘤大小的关系 由表3可见,AFP表达与肿瘤大小无关(P>0.05)。

表3 原发性肝细胞癌的AFP表达与肿瘤大小的关系
3 讨论
血清AFP检测用于HCC的筛查首选已成共识。检测方法有放射免疫法(RIA)和AFP单克隆抗体酶免法(EIA)快速测定法,阳性率为70% ~80%,用电化学发光法测定阳性率平均为76.2%。一般认为AFP>400 μg/L时可对原发性肝癌确定诊断。临床上对于原发性肝癌的高危人群,若血清AFP显著升高,持续时间大于2个月,影像资料无论有无肝内占位病变,都应高度警惕存在原发性肝癌的可能,应给密切观察,因为血清AFP的阳性发现往往早于症状出现8~11个月[1]。肝细胞肝癌血清中的AFP水平高低与肝癌细胞分化程度有关,Ⅰ级肝癌细胞分化接近正常细胞,故AFP含量尚不足以测出,Ⅳ级由于分化极差,已失去类似胚胎细胞的机能,也不能从血清中检出AFP,Ⅱ、Ⅲ级肝癌细胞认为是和胚胎肝细胞相似的幼稚细胞,产生AFP阳性率较高,因此肝细胞癌的分化程度不同,AFP含量存在差异。但有15%左右的原发性肝癌患者血清中AFP始终不高,故AFP不高者并不能排除原发性肝癌。
国外有报道AFP在HCC组织中的阳性率在44%~70%之间,常呈灶状分布。在细胞内的分布以核周型为主,也可表现为胞质型、胞膜型和局限型,其阳性细胞数和免疫组化反应强度大多与AFP血浓度、肝细胞癌的分化程度相关[2-5]。Niwa等[2]报道AFP mRNA水平在30例HCC的癌肿区比非癌区增加大约10~105倍,并且与血清AFP水平和肿瘤的大小均相关。Ohguchi等[3]也报道AFP的血清水平越高,表达它的HCC细胞群越大,在癌周组织中AFP仅有弱表达,而正常肝组织中为阴性。国内的一项研究[6]结果表明,AFP在HCC组织中的表达有以癌巢分布的趋势,虽然在肝硬化和癌周组织的部分细胞也可见AFP表达,但其阳性率和表达强度均低于HCC组织,且多为核阳性,伴不典型增生,提示这些细胞可能是癌前期细胞,它们可能已开始拥有肿瘤样生长能力,但还缺乏恶性转化的表型。AFP的表达可能和肝细胞的恶性转化有关[2]。
囯內李伟等[7]针对40例HCC患者的一项研究证实,AFP在肝癌内的表达率为87.5%,癌旁组织为80.0%,但其强度反应更高,充分说明不仅癌细胞内存在AFP,癌旁非癌性组织中也出现了AFP阳性颗粒。还有研究表明HCC组织内的AFP和癌旁组织的AFP二者的分子结构具有异质性,主要表现为AFP分子中糖基的结构及组成的差异,这种差异与能合成AFP的细胞特征及细胞处于不同的病理状态有关,因此肯定HCC周围病变组织可出现AFP阳性颗粒,从而提示HCC的发生发展与慢性肝病特别是肝硬化密切相关。
本课题发现:(1)肝癌患者的血清AFP检测值的高低与其癌组织 AFP的表达情况基本成正相关关系(曲线均为两头低中间高)。原因可能是:肝癌细胞分两种,一种合成AFP,一种不合成AFP;AFP只在细胞周期的一定时期合成,不处于此期的癌细胞不合成AFP;高分化和明显低分化癌细胞很少合成或不合成AFP;癌细胞严重影响AFP合成;癌组织中纤维间质较多,AFP不易进入血液。(2)HCC组织中AFP表达与预后有关,AFP表达高者预后好,生存时间较长;反之,预后差,生存时间短。现有的研究尚缺乏类似报道,笔者认为,这可能是高表达肿瘤患者在术后随访时血液中AFP再次显著增高往往先于影像学发现肝癌复发而尽早被发现从而得到及时治疗有关。病理分级较差且AFP低或不表达,多提示肿瘤呈显著低或未分化,几乎不分泌AFP,提示预后不良。
[1]Ozer B,Serin E,Yilmaz U,et al.Clinicopathologic features and risk factors for hepatocellular carcinoma:results from a single center in southern Turkey[J].Turk J Gastroenterol,2003,14(2):85-90.
[2]Niwa Y,Matsumura M,Shiratori Y,et al.Quantitation of alpha-fetoprotein and albumin messenger RNA in human hepatocellular carcinoma[J].Hepatology,1996,23(6):1384-1392.
[3]Ohguchi S,Nakatsukasa H,Higashi T,et al.Expression of alphafetoprotein and albumin genes in human hepatocellular carcinomas:limitations in the application of the genes for targeting human hepatocellular carcinoma in gene therapy[J].Hepatology,1998,27(2):599-607.
[4]Tsutsumi T,Ido A,Nakao K,et al.Reciprocal regulation of alpha-fetoprotein and albumin gene expression by butyrate in human hepatoma cells[J].Gastroenterology,1994 ,107(2):499-504.
[5]张新立,史景泉,左声鹤.ras癌基因产物P21与肿瘤胚胎蛋白AFP、CEA在人肝癌中表达的对比研究[J].中华病理学杂志,1994,(3):155-158.
[6]翟守恒,刘俊彬,刘云梅等.HBsAg,HCV-Ag和AFP在肝硬变和肝细胞癌组织中的表达[J].世界华人消化杂志,2000,8(5):524-527.
[7]李伟,王学春,李星,等.肝癌及癌旁组织中 P53基因及 AFP、CEA等表达异常及相关性研究[J].中国肿瘤临床与康复,2002,9(2):3-5.
