早期肠内营养在胃癌患者快速康复外科治疗中的临床应用
2012-01-22尚玉龙刘汝亭
尚玉龙,刘汝亭
胃癌首选手术治疗,但手术破坏了消化道正常的解剖及生理功能,影响患者消化、吸收功能,同时,传统思想上认为术后过早进食将影响吻合口愈合,一般术后早期多采用禁食、静脉补液方法。但丹麦的Henrik Kehlet医生提出并倡导的快速康复外科(fast track surgery,FTS)理念对许多传统围手术期理念提出了挑战,其通过多项积极措施可促进患者术后胃肠道功能快速康复。其中,合理有效的营养支持有积极作用。近几年,术后早期肠内营养(early enteral nutrition,EEN)的临床应用日益广泛。我科自2008年6月至2012年2月对20例胃癌术后患者实施早期肠内营养治疗,评价其对患者术后肠功能恢复、营养状态、肝肾功能及并发症的影响。
1 资料与方法
1.1 一般资料 选取无手术禁忌证的胃癌患者,剔除:(1)姑息手术者;(2)心肺等器官功能不全者;(3)术前存在胸腹水、下肢水肿者;(4)免疫系统疾病者。共入组40例,术前征得患者及家属同意,按入住外科顺序随机分为FTS组和对照组,每组各20例。FTS组,男16例,女4例,年龄(49.8±10.4)岁;对照组,男15 例,女5 例,年龄(54.7 ±12.6)岁。患者均有不同程度上腹隐痛、消瘦、嗳气、反酸等胃癌临床表现,胃镜及病理证实癌变,无幽门梗阻。肿瘤位于胃体近胃窦部22例,胃窦部18例。术后病理均为腺癌,6例呈低分化。
1.2 术前准备 FTS组术前不灌肠,术前不留置胃管、不导尿,带胃管、空肠营养管、导尿管入手术室。术前晚22:00口服10%葡萄糖液1 000 mL,术前3 h饮10%葡萄糖液500 mL后禁饮食。对照组术前晚常规灌肠,术晨保留导尿、置胃管,术前12 h禁饮食。两组均于术前30 min静滴抗生素。
1.3 术中处理 FTS组麻醉后保留导尿,术中保温,控制输液量。手术中在麻醉师帮助下置胃管及空肠营养管,营养管置入空肠起始部,胃管过吻合口至十二指肠,留侧孔于胃内。对照组术中不刻意注重保温及控制输液量。手术方式两组相同。均全麻下行胃癌D2根治术(部分胃切除,毕Ⅰ式吻合)。
1.4 术后处理 FTS组在麻醉清醒后拔除导尿管,床上活动,非阿片类药物镇痛。术后6h经空肠营养管注入温5%葡萄糖盐溶液,50 mL,每2小时1次,共250 mL;术后第1日经空肠营养管注入瑞素(肠内营养乳剂)80 mL/3 h;术后第3日,经空肠营养管注入瑞素180 mL/3 h。不足热量术后第1、2日由卡文注射液静脉补充,第3日起由10%葡萄糖液补充,能量约1 700 kcal/d。同时给予胃复安以促进肠蠕动,肛门排气后拔除胃管,经口进流质,逐步减少空肠营养管注入量,静脉输液仅留抗生素组,至能经口进全量流质后,拔除空肠营养管。对照组于术后第3日经间断夹闭训练后拔除导尿管。静脉应用镇痛泵镇痛。深静脉卡文营养支持,不足液体由10%葡萄糖液和5%葡萄糖盐液补充,能量约1 200 kcal/d。肛门排气后,于术后5~7天拔除胃管,停止静脉营养,经口进流质,逐步加量并过渡至半流食。
1.5 观察指标 (1)一般指标:术后肛门排气时间,首次排便时间,住院时间;(2)营养指标:体重、BMI及血清白蛋白、总蛋白、血红蛋白;(3)肝、肾功能:血肌酐、总胆红素、谷丙转氨酶、谷草转氨酶;(4)并发症:感染、吻合口漏及腹胀、腹痛、腹泻等不良反应。
1.6 统计学方法 采用SPSS 13.0统计软件包进行分析,所有数据用表示,应用t检验。以P<0.05为差异有统计学意义。
2 结果
所有患者手术顺利,术后安返病房。术后FTS组1例发生肺部感染,对症处理后好转;3例在输注营养液早期出现不同程度腹胀、腹痛,减慢滴速后好转。对照组发生感染3例(切口感染、尿路感染、肺部感染各1例),均对症处理好转。术后两组均未发现吻合口漏。FTS组术后首次肛门排气时间、排便时间及住院天数均短于对照组(P<0.05)(表1)。两组体重、BMI术前无区别(P>0.05),术后7d对照组较FTS组下降明显(P<0.05)(表2)。两组血清总蛋白、白蛋白、血红蛋白在术前及术后1d无明显差异(P>0.05),术后7d,FTS组总蛋白、白蛋白、血红蛋白明显高于对照组(P<0.05)(表3)。两组的总胆红素、谷丙转氨酶、谷草转氨酶、肌酐值在术前及术后1d亦无明显差异(P>0.05),而在术后7d,FTS组总胆红素、谷丙转氨酶、谷草转氨酶、肌酐均低于对照组(P<0.05),见表4。
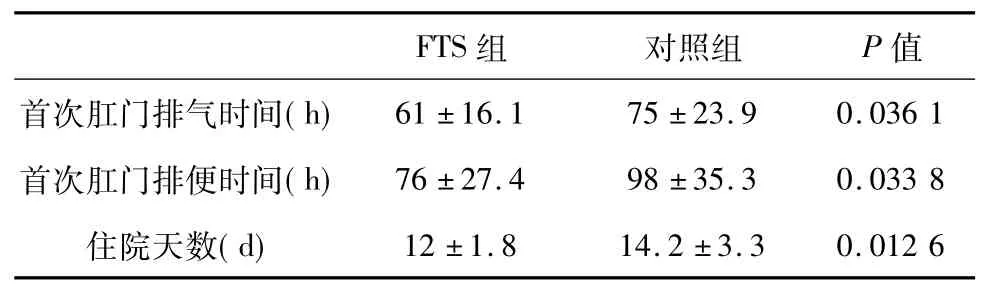
表1 两组一般指标的比较

表2 两组体重、BMI的比较
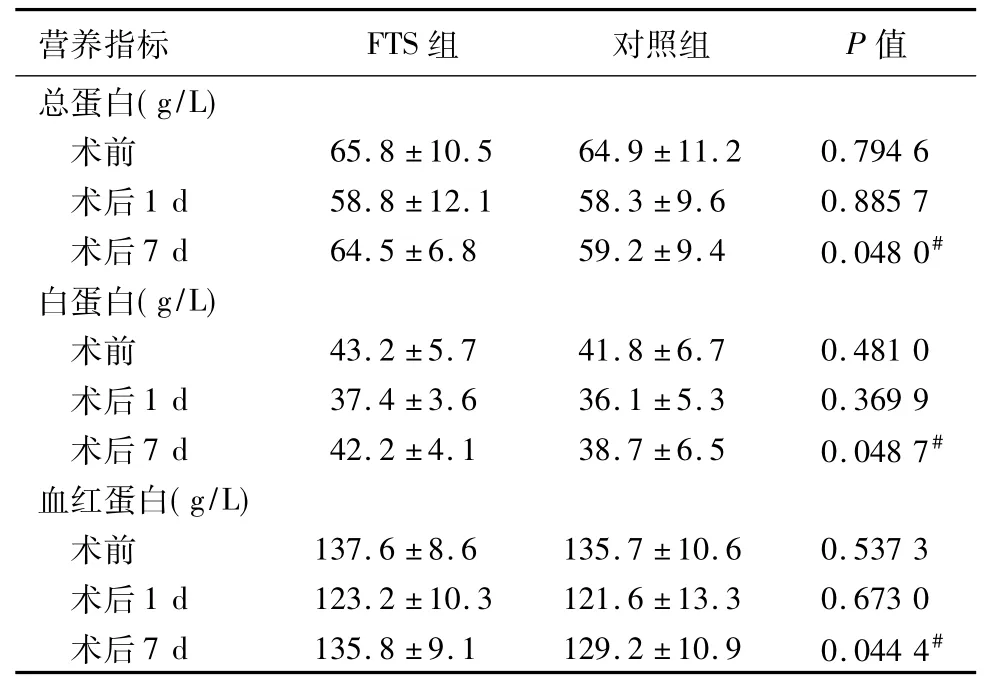
表3 两组营养指标变化的比较

表4 两组肝、肾功能相关指标变化结果
3 讨论
胃癌患者存在高消耗状态,且由于肿瘤对胃生理功能的影响,患者术前即有可能存在营养不良,而手术带来的应激反应及术后较长时间禁食,进一步加重了患者营养不良的状态,使机体免疫力下降,影响康复。有研究表明,营养不良患者术后发生感染、肺功能障碍、胃肠吻合口漏、切口愈合不良等并发症几率明显上升[1],而积极行营养支持治疗可直接或间接降低术后并发症发生率和病死率[2],故营养支持在治疗中占重要地位。
营养支持分肠外营养和肠内营养两种。自1967年美国的Dudrick等证实了肠外营养的有效性[3]以来,静脉营养支持在临床上使用广泛,均遵循“胃肠道手术须待肛门排气后方可进食”这一传统观念。但在应用中发现存在诸多问题:(1)深静脉穿刺置管的并发症较多,导管护理麻烦,一旦感染可致脓毒血症;(2)可出现代谢相关并发症,如淤胆、肝毒性反应、肝脂肪变性;(3)手术应激使患者出现胰岛素抵抗,不能充分利用静脉途径给予的外源性营养物质,特别是其营养成分不经肠道吸收,易致谷氨酰胺缺乏,继而导致肠黏膜萎缩、细菌移位和肠道毒素入血。这些原因能直接导致肠道功能异常和免疫功能受损[4]。
肠道是人体最大免疫器官,拥有人体最大的黏膜相关淋巴样组织,其上皮细胞营养主要靠肠内营养提供[5]。在消化道存在部分功能时,肠内营养即可取得与肠外营养相同的效果。随着临床研究的不断深入,肠内营养的优点越来越明显,其符合生理,使用方便安全,对肠道的机械刺激使消化道激素分泌增加,加速胃肠道功能的恢复。故现多主张只要肠道有功能,即可尽早进行肠内营养。大部分研究者将术后6~24 h内给予肠内营养定义为早期肠内营养(EEN)[6]。同时,研究证实,小肠蠕动和吸收功能在术后数小时即可恢复正常[7]。这为早期肠内营养提供了理论依据。有效的肠内营养支持避免了肠黏膜萎缩、细菌移位、肠道毒素入血等,促进肠功能恢复,增强机体免疫力,同时营养物质经门静脉系统主动吸收,促进肝脏中蛋白合成。
在治疗过程中,为避免过度刺激胃肠道而减慢其术后功能恢复,我们在围手术期中引入快速康复外科处理方法,其理念和实践在胃肠外科领域已被证实安全可行[8]。本研究中FTS组胃癌患者术前不常规灌肠,不置胃管、尿管,同时缩短术前禁食时间,向患者详细宣教,减轻其对手术恐惧心理,提高其对手术麻醉耐受力。我们发现缩短禁食时间及术前不留置胃管并不增加麻醉中呕吐、反流的风险,术中与麻醉师配合经鼻腔置胃管及肠营养管均顺利。术前不灌肠,可避免水电解质紊乱,不增加麻醉风险,术中补液不致过多,避免了肠道水肿及功能受损。同时,术中注重对患者应用保温措施,有助于机体快速恢复。术后患者难免出现疼痛,镇痛药选择非阿片类,避免减慢肠蠕动。
但需注意的是,EEN实施之初,部分病例可出现不同程度的腹胀、腹痛等不良反应,可能与肠内营养液温度低、浓度高、滴速快有关,对症处理症状均消失,故应恒温滴入,滴速由慢至快,浓度由稀渐浓,量由少而多,渐进进行,予患者肠道以适应过程。同时,需严密监测血糖,对血糖升高者,应用胰岛素控制。相信随着经验的积累,早期肠内营养在基层医院临床也将得到广泛应用。
[1]吴国豪.肿瘤患者营养不良的原因与危害[J].中国实用外科杂志,2002,22(11):644-646.
[2]黎介寿.营养与肿瘤治疗[J].中国肿瘤外科杂志,2010,2(1):172-173.
[3]吴孟超,吴在德.黄家驷外科学[M].北京:人民卫生出版社,2008,374.
[4]邓鑫,赵毅,崔钊,等.早期肠内营养在全胃切除术后的应用[J].中国实用外科杂志,2008,28(9):766-767.
[5]曹景玉,吴力群,郭卫东,等.早期肠内营养对肝切除患者术后恢复情况的影响[J].中国普通外科杂志,2009,18(1):103-105.
[6]Brooks AD,Hochwald SN,Eslin MJ,et al.Intestinal permeability after early postoperative enteral nutrition in patients with upper gastro-intestinal malignancy[J].J PEN,1999,23:75-82.
[7]宋延强,吕文平,庞新.老年胃癌患者术后早期肠内营养与肠外营养疗效的比较[J].中华普通外科杂志,2004,19(2):97.
[8]Zausig YA,Weigand MA,Graf BM.Perioperative fluid management an analysis of the present situation [J].Anaesthesist,2006,55(4):371-390.
