Semaphorin 5A基因在胃癌侵袭和转移中的作用
2012-01-19许荣芬潘国庆张翔凌
许荣芬 潘国庆 张翔凌
Semaphorin 5A基因是神经导向分子Semaphorins家族的成员之一,最初的研究资料显示,Semaphorin 5A在中枢神经发育过程中起着重要的作用[1]。最近,Pan[2]等研究发现Semaphorin 5A在胃癌组织中高表达,其表达水平与胃癌侵袭和转移呈正相关。然而,Semaphorin 5A在胃癌侵袭、转移过程中的作用机制,目前尚未被研究。
在我们的研究中,我们运用RNA干扰技术,建立稳定Semaphorin 5A表达抑制的胃癌细胞株,研究Semaphorin 5A对MMP2、MMP9表达的影响;应用抗MMP2、MMP9抗体,检测其对Semaphorin 5A基因介导的胃癌细胞侵袭能力的影响,以探讨Semaphorin 5A在胃癌侵袭和转移过程中的作用机制。
1 材料与方法
1.1 细胞培养
胃癌细胞株SGC7901来源于上海生物研究所,该细胞株被维持在含10%小牛血清的DMEM培养液中,置于37 ℃、5%C02、饱和湿度环境的培养箱中培养。
1.2 小干扰RNA质粒的构建和转染
针对Semaphorin 5A基因,设计有效干扰序列:sense5′-CACCGCATCCAGTCATCTCCTATATTCAAGA CGTATAGGAGATGACTGGATGTTTTTTG-3′;antisense 5′-AGCTCAAAAAACATCCAGTCATCTCCTATACGTCTT GAATAT AGGAGATGACTGGATGC-3′,同时设计与鼠、兔、人基因无同源性列的混杂序5′-AATCGCATAGCGTATGCCGTT-3′,作为阴性对照组。这些寡核苷酸退火后,与载体pGenesil-1.1连接并转入感受态细胞中,应用脂质体2000将干扰质粒转入胃癌细胞株SGC7901中,并进行G418筛选和验证。将pGenesil-siSema5A、pGenesil-siSrcambled表达载体分别转染胃癌细胞株SGC7901,并命名为SGC7901-Sema5A-si和对照组SGC7901-Scram-si。Semaphorin 5A在这些细胞中的表达水平,通过Western blotting检测验证。
1.3 Western 蛋白印迹分析
在培养细胞中加入200 μL 裂解液,置于冰上30 min 后吸出裂解液,于4 ℃、13 000 rpm 离心20 min,吸取上清于-20 ℃保存备用。 制备10%的SDS 聚丙烯酰胺凝胶,取25 μg 蛋白样品与样品缓冲液混合,100℃变性5 min 后点样并电泳; 转膜后用5%的脱脂奶粉封闭2 h;加一抗室温孵育2 h,所用抗体为鼠抗人Semaphorin 5A 抗体(1∶400,Santa Cruz Biotechnology)、兔抗人MMP2和MMP9抗体(1∶400,Santa Cruz Biotechnology)、鼠抗人actin 抗体(1∶1000;Neomarker 公司);TBST洗膜3次后,分别加辣根过氧化物酶标记的羊抗兔IgG 或兔抗鼠IgG(1∶2000 Santa Cruz Biotechnology)室温孵育1 h。按照ECL 检测试剂盒(Pierce,Rockford,美国)说明书进行显色、曝光、X 光片冲洗;将X 光片透视扫描后,印迹的灰度值经Gel-Pro Analyzer 软件分析(United Bio.,美国),并以β-actin 的灰度值作为内参,进行结果的均一化处理,得到Semaphorin 5A的相对灰度值。
1.4 RT-PCR分析
应用Trizol试剂处理胃癌细胞,并进行总mRNA提取,取5 μg RNA,采用随机引物法按试剂盒说明书进行合成cCDA,以β-actin基因作为内参照进行PCR。引物由上海生工生物工程公司合成,MMP2引物序列:上游 5'-GCTACGATGGAGGCCCTAATG-3';下游5'-TCTCCTTGGGGCAGCCAT-3',扩增长度236 bp。MMP9引物序列:上游5'-CACTGTCCACCCCTCAGAGC-3';下游 5'-GCCACTTGTCGGCGATAAGG-3', 扩增长度 178 bp。β-actin引物序列:上游5'-CACGCACGATTTCCCGCTCGG-3';下游 5'-CAGGCTGTGCTATCCTGTAC-3',扩增长度217 bp。PCR扩增条件:①94 ℃预变性4 min;②94 ℃变性20 s,60 ℃退火25 s,72 ℃延伸25 s,共35个循环;③72 ℃延伸10 min;反应体系为50 μl。
1.5 ELISA实验
收集被检测的胃癌细胞株的上清液,4℃超速离心机14 000 rpm 10 min,收集上清液稀释后采用ELISA方法检测,检测步骤严格按ELISA试剂盒说明书进行。
1.6 Transwell细胞迁移实验
在Transwell下室加入10%小牛血清的DMEM培养液,作为迁移诱导因子,在Transwell上室滴加200 μl 1×104胃癌细胞悬液。将上室置于下室之中,在37 ℃温箱孵育24 h后取出上室,经PBS洗涤后,用4%多聚甲醛固定迁移至上室外表面上的细胞,HE 染色,计算迁移细胞数,结果取上、下、左、右、中5 个视野( 400×)细胞计数的平均值。
1.7 Transwell 小室侵袭实验
在Transwell小室滤膜上铺以300 μg matrigel基质胶,于37 ℃下重建基膜,在超净台内风干2 h。收集被检测细胞,用含1%的胎牛血清DMEM配置密度为1×105个/mL的细胞悬液,下室加含10%胎牛血清的DMEM培养基600 μl,上室加入100 μl细胞悬液,37℃培养36 h,侵袭滤膜下面的细胞用结晶紫染色后,随机选择5个200倍显微视野,以穿膜细胞的平均数来表示被检测胃癌细胞的侵袭能力。
1.8 统计学处理
2 结果
2.1 Semaphorin 5A稳定表达抑制胃癌细胞株的建立
采用Western blotting方法,检测Semaphorin 5A在转染胃癌细胞克隆中的表达,结果显示:Semaphorin 5A在pGenesi1-Scrambled转染的细胞克隆(SGC7901-Scram-si)中表达水平,明显高于pGen-1-Sema 5A转染的细胞克隆(SGC7901-Sema5A-si)(P<0.01),表明成功构建了Semaphorin 5A基因稳定表达抑制的胃癌细胞株。
2.2 MMP9、MMP2在胃癌细胞株SGC7901-Sema5A-si、SGC7901-Scram-si中的表达
采用RT-PCR、Western blotting、Elisa等方法,检测MMP9、MMP2在胃癌细胞株SGC7901-Sema5A-si、SGC7901-Scram-si中的表达。RT-PCR、Western blotting检测结果显示: MMP9在胃癌细胞株SGC7901-Sema5A-si中呈低表达,在SGC7901-Scram-si中呈高表达,两者比较差异有统计学意义(P<0.05);MMP2在2种细胞株中均有表达,但差异无统计学意义(P>0.05)。Elisa检测结果与RT-PCR、Western blotting检测结果一致(图1)。
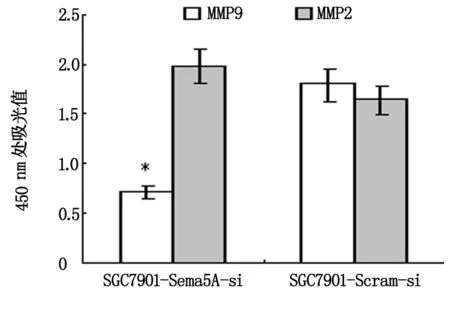
图1 MMP9、MMP2在SGC7901-Scram-si 、SGC
2.3 MMP2、MMP9表达对Semaphorin 5A介导的胃癌细胞侵袭、转移能力的影响
SGC7901-Sema5A-si侵袭和转移能力明显低于SGC7901-Scram-si胃癌细胞株(P<0.05);MMP9抗体能够降低SGC7901-Sema5A-si、SGC7901-Scram-si胃癌细胞的侵袭和转移能力,MMP9抗体处理后SGC7901-Scram-si细胞侵袭和迁移能力分别降低了61%和64%(P<0.01),而SGC7901-Sema5A-si胃癌细胞的侵袭和迁移能力仅降低了44%和41%(P<0.05)(图2,3);MMP2抗体对2种细胞的侵袭和迁移能力无影响(实验结果未显示)。结果表明,MMP9抗体能够抑制SGC7901-Sema5A-si、SGC7901-Scram-si胃癌细胞的侵袭和转移能力,且其抑制力与Semaphorin 5A表达水平相关。
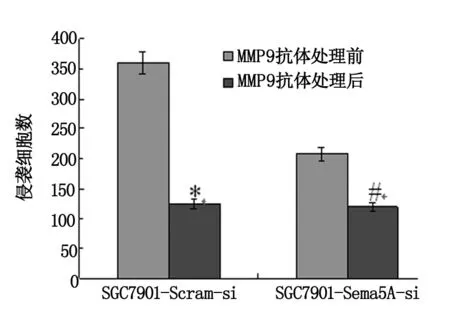
图2 MMP9抗体对Semaphorin 5A介导的胃癌细胞侵袭能力的影响
3 讨论
胃癌是最常见的恶性肿瘤之一,在世界范围内每年大约有876000胃癌患者被确诊,它是导致癌症患者
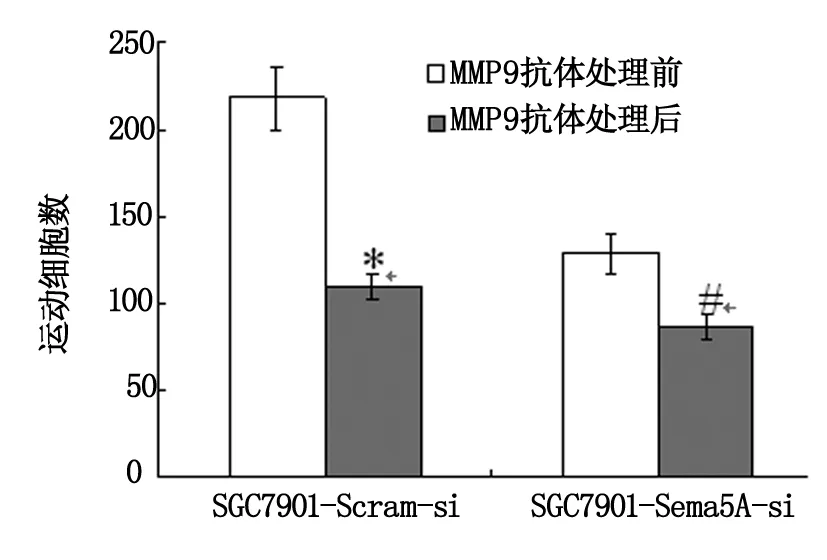
图3 MMP9抗体对Semaphorin 5A介导的胃癌细胞迁移能力的影响
死亡的第二大主要原因,仅次肺癌[3]。尽管目前医疗和诊断水平取得较大的进步,然而胃癌患者的预后依然不很乐观,究其原因,主要因为胃癌的发病因素和分子机制目前尚还十分清楚。因此,识别和寻找与胃癌发生、发展相关新的癌基因以及研究胃癌的发病机制,都将有重大的临床意义。
Semaphorins是1个神经轴突导向分子大家族,包括30多个成员,它们在结构上具有一定的相似性,即在N-端含有一个高度保守的、富含半胱氨酸残基的"Sema"域,长度约400~500氨基酸。根据种属不同、结构的相似性,将Semaphorins分为8个亚家族[4]。最初的研究认为,Semaphorins家族成员与神经系统发育过程密切相关,调控轴突的生长方向,抑制轴突分支,诱导轴突进入某些特定的靶区[5]。然而,目前越来越多的研究资料表明,部分Semaphorin家族成员在神经系统以外不同组织中表达,参与了中枢神经系统以外的多种活动,其中最令人注意的是这些成员在人类多种肿瘤组织中表达,调控肿瘤的发生和影响肿瘤的形成进程[6,7]。Semaphorin 5A是Semaphorin家族成员之一,Pan等研究发现Semaphorin 5A在胃癌组织中高表达,其表达水平与胃癌的侵袭和转移呈正相关。然而,Semaphorin 5A在过程中的分子机制目前还不清楚。MMPs是体内重要的一类蛋白水解酶,在肿瘤侵袭转移中几乎能降解ECM的所有成分,而且还对肿瘤微环境的维持和促进肿瘤生长起着重要作用[8]。为了探讨Semaphorin 5A在胃癌侵袭和转移过程中的分子机制,我们初步研究MMP2、MMP9与Semaphorin 5A的关系。我们的研究发现, MMP9在Semaphorin 5A表达抑制的胃癌细胞株SGC7901-Sema5A-si中呈低表达,在对照组胃癌细胞株SGC7901-Scram-si中呈高表达,并且其表达差异具有统计学意义,而MMP2在2种细胞中的表达水平无明显差异。为了更进一步探讨MMP2、MMP9表达与Semaphorin 5A在胃癌发展中的关系,我们使用MMP2、MMP9抗体处理SGC7901-Sema5A-si、SGC7901-Scram-si胃癌细胞,观察其对Semaphorin 5A介导的胃癌细胞侵袭和转移能力的影响,结果显示MMP9抗体能够抑制SGC7901-Sema5A-si、SGC7901-Scram-si胃癌细胞的侵袭和转移能力,并且抑制效果与Semaphorin 5A的表达水平相关,而MMP2抗体不能阻止SGC7901-Sema5A-si、SGC7901-Scram-si的侵袭和迁移能力。
总之,我们研究结果显示,Semaphorin 5A通过MMP9的表达促进胃癌细胞的运动和侵袭能力,在胃癌的发展过程中发挥着重要的作用,这不但增加了对Semaphorin 5A基因在神经系统外功能的更多了解,而且揭示了其在胃癌发生、发展的作用机制,为胃癌诊断和基因靶向治疗提供了理论依据,为胃癌临床进展分期提供可靠的分子标志物。
[1] Hilario JD,Rodino-Klapac LR,Wang C,et al.Semaphorin 5A is a bifunctional axon guidance cue for axial motoneurons in vivo〔J〕.Dev Biology,2009,326:190.
[2] Pan GQ,Ren HZ,Wang XM,et al.Expression of semaphorin 5A and its receptor plexin B3 contributes to invasion and metastasis of gastric carcinoma〔J〕.World J Gastroenterol,2009,15:2800.
[3] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002〔J〕.CA Cancer J Clinic,2005,55:74.
[4] Yazdani U,Terman JR.The semaphorins〔J〕.Genome Biology,2006,7:211.
[5] Casazza A,Fazzari P,Tamagnone L.Semaphorin signals in cell adhesion and cell migration:functional role and molecular mechanisms〔J〕.Adv Exp Med Biology,2007,600:90.
[6] Roth L,Koncina E,Satkauskas S,et al.The many faces of semaphorins:from development to pathology〔J〕.Cell Mol Life Science,2009,66:649.
[7] Neufeld G,Shraga-Heled N,Lange T,et al.Semaphorins in cancer〔J〕.Front Bioscience,2005,10:751.
[8] Parsons SL,Watson SA,Collins HM,et al.Gelatinase (MMP-2 and -9) expression in gastrointestinal malignancy〔J〕.Br J Cancer,1998,78:1495.
