SO42-/Bi2O3-Al2O3催化水合肼还原硝基苯制备苯胺
2012-01-15蔡可迎张伟伟
蔡可迎,张伟伟
(徐州工程学院化学化工学院,江苏,徐州 221018)
SO42-/Bi2O3-Al2O3催化水合肼还原硝基苯制备苯胺
*蔡可迎,张伟伟
(徐州工程学院化学化工学院,江苏,徐州 221018)
以 Bi(NO3)3和 AlCl3为原料,采用共沉淀法制备了固体酸催化剂 SO42-/Bi2O3-Al2O3。探讨了SO42-/Bi2O3-Al2O3催化水合肼还原硝基苯的催化活性。结果表明:催化剂中n(Bi):n(Al) = 1:15,以10%的(NH4)2SO4浸渍所得的催化剂具有较高活性。红外光谱表明,催化剂中存在B酸中心,能有效地提高催化剂的性能。此还原方法反应条件温和,催化剂制备简单。
苯胺;硝基苯,水合肼;还原
水合肼还原芳香族硝基化合物制备芳胺具有选择性高、操作简单、无污染等优点,此法在精细化工行业的应用日益增多。用于该反应的催化剂有多种,其中Pd/C和Raney Ni[1]的价格较高;FeCl3/C[2]和Bi(NO3)3/C[3]不便于重复使用;Fe沸石[4]和一些复合氧化物[5,6]也具有较高催化活性,但制备较麻烦。由于无定形FeO(OH)具有较高活性,廉价且易制备而受到关注,但FeO(OH)的催化活性在反应温度高于70℃时迅速下降[7]。本研究以硝酸铋和三氯化铝为原料共沉淀,并用(NH4)2SO4溶液浸渍沉淀、焙烧得到SO42-/Bi2O3-Al2O3固体酸催化剂,并以硝基苯为底物考察了其催化活性,反应如下:
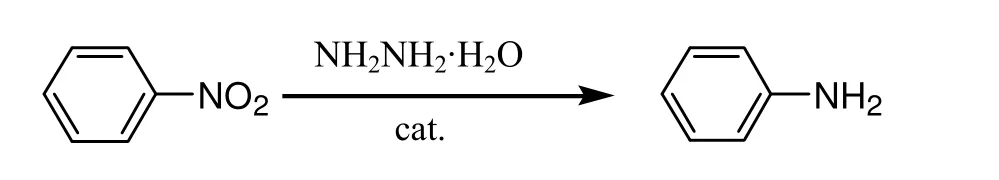
1 实验部分
1.1 主要仪器与试剂
日本理学公司的 D/Max-3B型 X-射线衍射仪(XRD);美国Nicolet公司的Magna-IR 560 型傅立叶变换红外光谱仪(FTIR);美国安捷伦公司的HP 6890型气相色谱仪(GC);美国KEM公司的KEM型平行合成反应器。
水合肼(质量分数 ≥ 85%),AR,上海联试化工试剂有限公司;自制蒸馏水;其余试剂均为分析纯。
1.2 催化剂的制备和表征
分别配制10%(质量分数,下同)的Bi(NO3)3溶液和AlCl3溶液,将二者混合均匀后,滴加至5%的Na2CO3溶液中。滴加过程中保持溶液的pH始终大于7,沉淀完成后,溶液的pH约为7。静置过夜后,离心分离,用蒸馏水洗涤沉淀至中性。将所得沉淀于110 ℃干燥4 h后,冷却,得催化剂前驱体。将催化剂前驱体分别用浓度为10%、20%、30%和40%的(NH4)2SO4溶液,以15 mL/g的量浸渍12 h,然后于110℃干燥4 h、在450℃焙烧5 h,得SO42-/Bi2O3-Al2O3固体酸催化剂,保存在干燥器中,备用。
催化剂的XRD测定采用CuKa辐射,管流25 mA,工作电压35 kV,扫描范围2θ = 5~70°。采用KBr压片测定催化剂的FTIR谱,扫描范围400~4000 cm-1。
1.3 催化剂活性测试
将10 mmol硝基苯,0.1 g催化剂和10 mL溶剂加入平行合成仪。开动磁力搅拌,加热至设定温度。在0.5 h内滴加完20 mmol水合肼,用GC监测反应进程。反应完成后,冷却,过滤,用无水乙醇洗涤催化剂,滤液合并后用GC对产物定量。
2 结果与讨论
2.1 催化剂的表征
用 20%的(NH4)2SO4溶液浸渍不同比例的Bi2O3-Al2O3(记作 20% SO42-/Bi2O3-Al2O3),并测定XRD谱。由图1可知,当n(Bi):n(Al) = 1:7时出现Bi2O3的吸收峰,说明Bi的含量较多,未能很好地分散在氧化铝中;当n(Bi):n(Al) = 1:15和1:30时未出现Bi2O3的吸收峰,Bi很好地分散在氧化铝中。因此,催化剂中铋的含量不宜过多,n(Bi)/n(Al) 应小于1/7。
图2是在450℃焙烧5 h后的催化剂FTIR谱,在1380 cm-1处出现新的吸收峰。随着(NH4)2SO4浓度的增大,峰强度渐弱,(4)中几乎没有吸收峰。但(4)中在1260 cm-1处出现吸收峰,其余三个则没有吸收。据文献报道[8],固体超强酸的1240~1310 cm-1和1352~1390 cm-1处的两吸收带可分别归属于无机双齿螯合物结构(I)和有机硫酸酯结构(II)如图3所示。结构(I)中的S=O键主要是离子型的,但含部分共价键性质;结构(II)中的S=O键基本上属于共价键,这种高度共价双键的性质有可能诱导催化剂产生超强酸的性质。对比 1380 cm-1处吸收峰强度的变化可以说明,(NH4)2SO4用量较少有利于配合物(II)的形成,即有利于产生超强酸中心。而(NH4)2SO4用量较多,主要形成了硫酸盐,不利于形成酸中心。
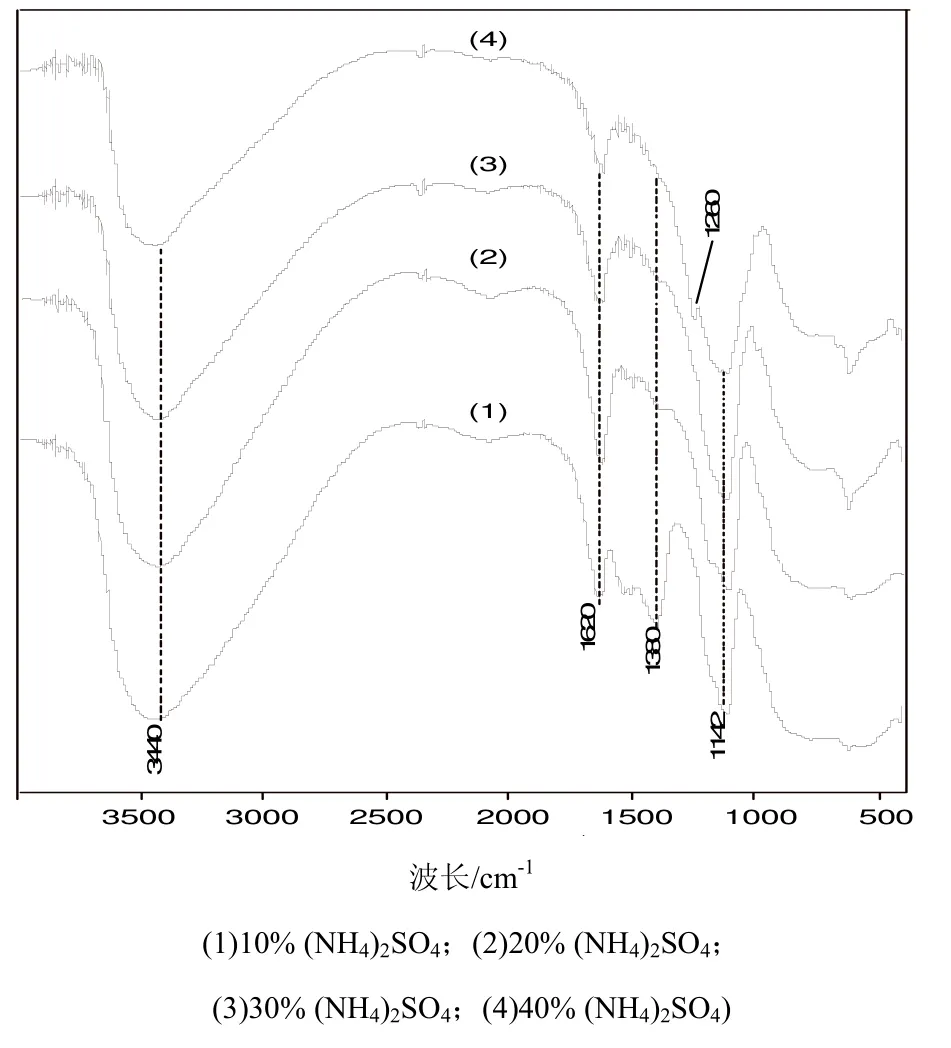
图2 不同浓度(NH4)2SO4浸渍的催化剂的FTIR谱Fig.2 FTIR spectra of catalysts treated by (NH4)2SO4 with different concentration

图3 两种配合物的结构Fig. 3 Schemes for two compositions
在Al2O3-Bi2O3中,由于Al是缺电子原子,可以提供空轨道与SO42-配位形成配合物,在催化剂表面形成如图4所示的a,b两种酸中心[9]。
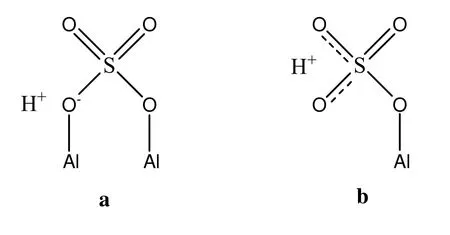
图4 两种酸中心的结构Fig.4 Schemes for centers of two acids
2.2 反应条件的优化
影响催化剂活性的主要因素是催化剂中 Bi与Al的摩尔比和酸含量。因此主要调整这两个因素,以提高催化剂活性,同时考察了温度对反应的影响。
2.2.1 n(Bi)/n(Al)对催化活性的影响
首先考察了n(Bi)/n(Al)对催化剂活性的影响。用 20%的(NH4)2SO4浸渍不同n(Bi)/n(Al)的Al2O3-Bi2O3,在450 ℃焙烧后得到几种催化剂。以硝基苯为底物考察了几种催化剂的活性。由表1(反应条件:10 mmol硝基苯,20 mmol水合肼,0.1 g 催化剂,10 mL乙醇,反应温度75oC,反应时间2.5 h)可知,催化剂中n(Bi):n(Al) = 1:30时,活性中心较少,导致催化活性较低;催化剂中铋的含量增多可提高催化剂的活性;但铋的含量太多时(n(Bi):n(Al) = 1:7),会聚集在一起,不能与载体起到协同作用,导致催化剂活性降低。因此,n(Bi):n(Al) = 1:15是适宜的。

表1 不同n(Bi)/n(Al)催化剂的催化活性Table 1 Catalytic activity of catalyst with different n(Bi)/n(Al)
2.2.2 (NH4)2SO4溶液浓度对催化活性的影响
保持n(Bi):n(Al) = 1:15不变,制备了几种酸含量不同的 SO42-/Bi2O3-Al2O3,以硝基苯为底物考察了酸中心对催化活性的影响。由图 5(反应条件:10 mmol硝基苯,20 mmol水合肼,0.1 g 催化剂,10 mL乙醇,反应温度75℃,反应时间2.5 h)可知,未经(NH4)2SO4浸渍的催化剂活性较低,以 10%的(NH4)2SO4浸渍催化剂的活性较高。继续增加(NH4)2SO4的浓度,催化剂的活性反而降低,这与催化剂中强酸中心数量减少是一致的。
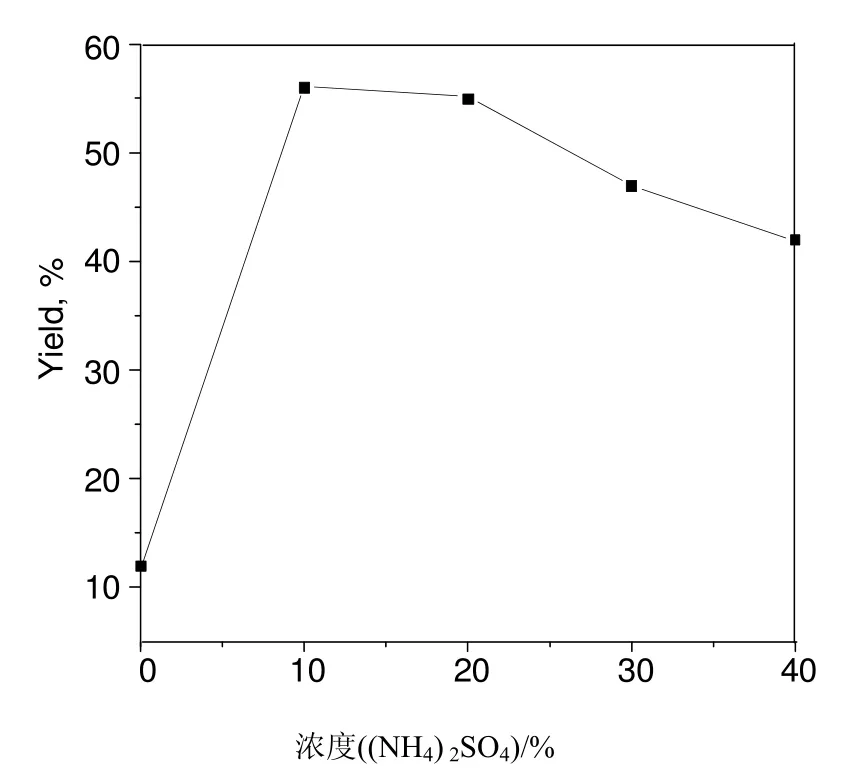
图5 (NH4)2SO4溶液浓度对催化活性的影响Fig.5 Effect of concentration of (NH4)2SO4 solution on catalytic activity
2.2.3 温度对反应的影响
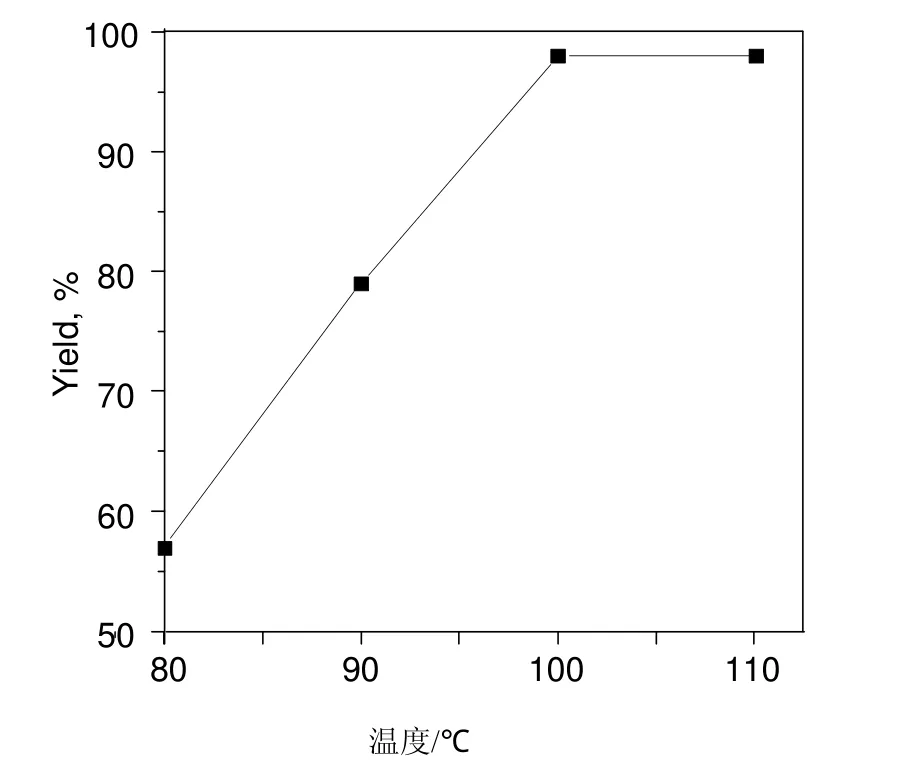
图6 温度对反应的影响Fig.6 Effect of temperature on reaction
由于以乙醇作溶剂的反应温度较低,导致苯胺的收率较低。为此,以正丁醇为溶剂,以 10%SO42-/Bi2O3-Al2O3(n(Bi):n(Al) = 1:15)为催化剂,考察了温度对反应的影响(反应条件:10 mmol硝基苯,20 mmol水合肼,0.1 g 催化剂,10 mL正丁醇,反应时间2.0 h)。由图6可知,随温度的升高,苯胺的收率有较大的提高。在100 ℃反应2.0 h,苯胺的收率达98%,再提高反应温度,苯胺的收率变化不大。因此,适宜的反应温度为100 ℃。
3 结论
用(NH4)2SO4溶液浸渍Bi2O3-Al2O3制备的催化剂能够生成B-酸中心,B-酸中心能够与水合肼形成配合物,可显著提高催化剂的活性。实验结果表明,当催化剂中n(Bi):n(Al) = 1:15时,以 10%的(NH4)2SO4溶液浸渍制备的催化剂活性较高。另外,在 100℃范围内,提高反应温度可显著提高反应收率,最佳反应温度为 100℃。该法反应条件温和,产物收率高,且催化剂制备简单,易于实现工业化。
[1]Johnstone R A W, Wilby A H, Entwistle I D.Heterogeneous catalytic transfer hydrogenation and its relation to other methods for reduction of organic compounds[J]. Chemical Review, 1985, 85(2): 129-170.
[2]Hirashima T, Manabe O. Catalytic reduction of aromatic nitro compounds with hydrazine in the presence of iron(III) chloride and active carbon[J], Chemical Letters,1975, 4(3): 259-260.
[3]蔡可迎, 岳玮, 周颖梅, 等.硝酸铋和活性炭催化的水合肼还原芳香族硝基化合物制芳胺[J].化学试剂, 2009,31(11): 945-947.
[4]Kumarraja M, Pitchumani K. Simple and efficient reduction of nitroarenes by hydrazine in faujasite zeolites[J]. Applied Catalysis A, 2004, 265(2): 135-139.
[5]石奇勋.芳硝基化合物温和条件下催化氢转移还原研究[D].大连:大连理工大学, 2007.
[6]黄 琪.不同催化体系下芳硝基化合物氢转移还原研究[D].大连:大连理工大学, 2008.
[7]Benz M, Kraan A M, Prins R. Reduction of aromatic nitro compounds with hydrazine hydrate in the presence of an iron oxide hydroxide catalyst. II. Activity,X-ray diffraction and Mössbauer study of the iron oxide hydroxide catalyst[J]. Applied Catalysis A, 1998, 172(1):149-157.
[8]管国峰, 谭强, 万辉.SO42-/TiO2-Al2O3固体酸催化剂的表征及其催化合成均苯四甲酸四异辛酯[J].石油化工,2005, 34(7): 643-647.
[9]姚瑞平, 张铭金, 杨俊, 等.SO42-/γ-Al2O3固体酸催化剂的制备、结构与酸性表征[J].化学学报, 2005, 63(4):269-273.
SO42-/Bi2O3-Al2O3-CATALYZED REDUCTION OF NITROBENZENE TO ANILINE WITH HYDRAZINE HYDRATE
*CAI Ke-ying , ZHANG Wei-wei
(School of Chemistry and Chemical Engineering, Xuzhou Institute of Technology, Xuzhou, Jiangsu 221008, China)
The catalyst SO42-/Bi2O3-Al2O3was prepared by coprecipitation from bismuth nitrate and aluminum chloride. The activity of the catalyst was investigated in the reduction of nitrobenzene with hydrazine hydrate. The results showed that the catalyst with the mole ratio of Bi and Al being 1:15, impregnated in 10% ammonium sulfate solution, has higher activity. The FTIR spectra of the catalyst showed that B-acid centers in catalyst can improve the activity of the catalysts. The reaction conditions of the reduction are mild, and the catalyst can be prepared conveniently.
aniline; nitrobenzene; hydrazine hydrate; reduction
TQ246.3
A
10.3969/j.issn.1674-8085.2012.04.008
1674-8085(2012)04-0034-04
2012-02-07;修改日期:2012-04-27
*蔡可迎(1970-),男,江苏沛县人,副教授,博士,主要从事有机合成研究(E-mail: caohuichem@163.com);
张伟伟(1990-),男,江苏丰县人,徐州工程学院化学化工学院2009级本科生(E-mail: 819767319@qq.com).
