胃癌临床综合治疗模式初探
2012-01-13朱信强管小青
朱信强,张 明,丁 闯,管小青,陈 焰
南京鼓楼医院集团宿迁市人民医院普外科,江苏宿迁 223800
胃癌临床综合治疗模式初探
朱信强,张 明,丁 闯,管小青,陈 焰
南京鼓楼医院集团宿迁市人民医院普外科,江苏宿迁 223800
目的探讨规范化治疗方案在胃癌临床治疗中的作用和意义。方法收集2010年2月-2011年3月所诊治的52例胃癌患者,采用临床规范化治疗,总结其临床病理资料、治疗过程。结果3例术前证实转移的未作手术,行姑息治疗;1例术前分期T1直接行手术;48例治疗前预行腹腔镜探查,15例探查发现腹膜转移,证实为M1,行热灌注化疗,然后姑息化疗,后期可耐受姑息手术10例,其余33例患者根据术前拟定程序行直接手术15例,先行新辅助化疗、评效后再手术18例,所有手术均达D2标准。手术住院时间7~70 d,平均11 d。手术时间120~190 min,平均145 min。术中出血约50~200 mL,平均125 mL。结论重视胃癌临床综合治疗模式,对于规范胃癌治疗,为患者选择合理有效的治疗方式具有重要的临床意义。
胃癌;临床综合治疗;模式
胃癌是我国最常见的消化道恶性肿瘤[1],目前虽然对胃癌采取手术、化疗等综合治疗,但疗效仍差强人意,其中一个重要的原因就是因术前分期不准确而使患者未得到适合的治疗措施。我们选取2010年-2011年间的52例胃癌患者采用综合治疗模式,术前行腹腔镜探查和腹腔灌洗对胃癌患者进行术前分期,根据更准确的分期对患者采取新辅助化疗和手术,收到较好的疗效,报道如下:
1 资料与方法
1.1 一般资料 选取我院2010年2月-2011年3月期间的52例胃癌患者,男42例,女10例,年龄34~76岁,中位年龄54岁。术前病理均证实为腺癌,其中胃食管接合部癌12例、胃底体癌9例、胃角处20例、胃窦处11例。术前行超声胃镜和增强CT检查,发现2例患者存在腹水、3例发现肝转移,其余患者肿瘤无明显远处转移,术前T分期在T1~T4a,合并症:高血压5例、糖尿病的患者3例、冠心病2例,术前都调整在能耐受手术水平。
1.2 治疗方法 术前准备:患者门诊完善检查,结合腹部CT、超声胃镜和电子胃镜,进行多学科会诊,术前临床分期。经讨论后拟定治疗方案,然后安排患者入院。早期胃癌直接行D1根治术,进展期胃癌,术前腹腔镜探查和腹腔灌洗后,然后分组治疗。探查有腹膜转移或脱落细胞阳性的直接行术中的热灌注化疗,术后再行辅助化疗。探查阴性的分为两组,一组行术前新辅助化疗,方案为氟尿嘧啶为基础的加铂类,两周期后,再次查CT和超声胃镜,对化疗效果评效,再次入院准备手术治疗。另一组探查后直接行根治术,分组意义本次不做讨论,只总结治疗流程,详见流程图。
所有进展期胃癌患者在全麻下行胃癌D2根治术,具体术式根据肿瘤位置决定,其中位于胃角和胃窦的患者,可考虑行远端根治性切除。近端进展期的行全胃切除,靠近大弯的肿瘤要加行脾门淋巴结的清扫,将脾脏拖出切口,直视下清扫第10组淋巴结。重建,选择食管空场的Roux-en-Y吻合或毕I式吻合或毕II式吻合加布朗吻合,并吻合口浆肌层加强,放置腹腔引流,右侧为双套管引流,放于文氏孔处,左侧放置脾门处。
2 结果
52例患者3例术前证实转移的未作手术,行辅助化疗。1例术前T分期在T1行直接手术,其余均经腹腔镜探查。15例探查阳性,证实为M1,行热灌注化疗加辅助化疗,后期姑息手术治疗10例,5例远处转移,身体无法耐受手术,予以维持治疗。探查阴性的18例先行术前化疗,两周期后在行手术,术后病理分期在T2-4aN0-2M0。17例病理显示肿瘤细胞变性坏死,1例无明显变化。15例直接行手术治疗,病理分期在T2-4aN0-3aM0,术后严重并发症见表。手术时间120~190 min,平均145 min。术中出血约50~200 mL,平均125 mL。术后第1天下床活动,最早术后第3天流质饮食,术后第7天出院。出现吻合口瘘的患者住院时间延长,其中1例吻合口瘘的患者住院时间70 d,患者平均住院日为11 d。

术后并发症表
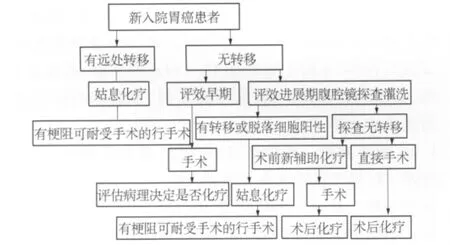
治疗流程图
3 讨论
3.1 重视胃癌术前分期的临床意义 通过准确分期,我们可以对处于不同时期的胃癌患者选择更合理的治疗方案,正确的分期是胃癌综合治疗方案实施的前提和基础[2]。在胃癌术前评估的基础上,不同分期可选择相应的治疗方案,日本《胃癌治疗指南》(第3版)[3]中根据胃癌的临床分期确定如下治疗方案:部分胃黏膜癌因其淋巴结转移率极低可行局限性切除术,如内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)等;在严格选择适应证的情况下,开腹手术和内镜手术的5年生存率差异无统计学意义,均在90%以上[4-5]。因此,学者们目前达成共识:确定无淋巴结转移的早期胃癌,条件适宜,可选择内镜治疗。而部分胃黏膜癌和黏膜下癌无法行ESD的患者可行D1或D1+淋巴结清扫;对于进展期胃癌或术前判断为有淋巴结转移的早期胃癌均需行D2淋巴结清扫。对于临床分期为M1期(有远处转移)的胃癌仅行姑息性治疗。本组患者入院均行增强CT和超声胃镜检查,术前已经发现远处转移3例,治疗方案予以化疗为主,后期评效好行姑息性手术治疗。此外,部分局部进展期胃癌,单纯手术难以达到根治的目的,常存在肉眼或镜下残留灶,所以多为姑息性切除且不能明显改善预后,对于这部分病例有必要行新辅助化疗等术前治疗,待肿瘤体积或转移灶得以适当控制后再考虑手。对于术前判断为进展期或伴有淋巴结转移(无远处转移)的可切除胃癌患者,除行手术治疗外,可考虑选择术前化疗或放化疗后再手术。对于无远处转移,但肿瘤无法切除的局部晚期胃癌可选择45.0~50.4 Gy放疗同时予以氟尿嘧啶类(5-FU、卡培他滨)为基础的放疗增敏剂或化疗,治疗后重新分期,如达到完全缓解或明显缓解,适当时可行手术治疗,所以准确的术前分期对选择合理的治疗方案至关重要[6]。3.2 术前新辅助化疗意义 对胃癌患者行术前的辅助化疗其概念由来已久,主要目的是使肿瘤缩小,提高手术切除率,改善治疗效果。既往较多应用,终因效果差而废弃,近年来由于新型化疗药物使用,又为进展期胃癌的治疗带来希望。本组中进展期胃癌探查阴性的行术前的新辅助化疗,两周期后行进行评效。评效选择对比超声胃镜和CT,比较胃壁在化疗前后的厚度以及周围淋巴结情况。新近一项由英国医学研究委员会主持的术前化疗Ⅲ期临床研究MAGIC(Medical Research Council Adjuvant Gastric Infusional Chemotherapy trial)[7]表明,以 ECF(表柔比星、顺铂和 5-FU)方案进行围手术期化疗可以显著改善可切除胃癌的无进展生存和总生存,从而奠定了围手术期化疗在可切除胃癌患者中的标准治疗地位。胃癌新辅助化疗的优点:①防止术后肿瘤血供改变影响化疗效果;② 防止切除原发肿瘤刺激剩余肿瘤的生长;③ 使肿瘤降期,提高手术切成率;④减少术中播散,消除潜在的微转移灶,降低术后转移、复发;⑤ 化疗敏感性试验,了解肿瘤对化疗药物的敏感性,合理选择敏感药物;⑥剔除不宜手术治疗的患者[8]。部分生物学行为差的胃癌,肿瘤进展迅速,化疗期间出现局部广泛浸润和远处转移,这类患者即使手术切除也会很快复发。
3.3 术后快速康复的意义 快速康复外科是指采用有循证医学证据的围术期处理的系列优化措施,以减少或降低患者的生理及心理创伤应激,促进术后快速康复[9],也有人称之为术后促进快速康复程序(enhanced recovery after surgery program,ERAS program)。在临床上最早成功应用于结直肠的择期手术治疗。近年来,胃癌患者应用的有效性和安全性也得到进一步证实[10]。在这44例手术患者中,我们也真正予以实施,不常规留置胃管,术后第1天下床活动,第2天开始饮水,第3天饮食,第7天出院。有文献报道[11-13],术后早期经口进食并不增加吻合口瘘发生的风险,本组中患者消化道瘘的发生率为3/44(6.8%),与文献报道结果基本一致[14]。而且术后腹胀缓解和胃肠功能恢复正常的时间大约提早48 h。这样不仅能改善患者的营养状况,增强抗感染能力,而且还可减少静脉营养和抗生素的使用,由此可节省医疗费用和减轻患者的经济负担。
总之,通过对胃癌患者实行综合治疗模式,使胃癌治疗模式化、规范化,重视术前分期,选择合理的治疗方案,加速患者康复。
[1] Zhu YH,Wu YL,Li C,et al.10 years early gastric cancer surgery rate evolution and experience [J].Chin J Gastroenterol Hepatol,2012,21(1):9-12.
朱燕华,吴云林,李晨,等.10年间早期胃癌手术率演变及经验.胃肠病学和肝病学杂志,2012,21(1):9-12.
[2] Ji JF,Ji X.The new progress of gastric cancer[J].The Journal of Evidence-based Medicine,2011,1(2):82-86.
季加孚,季鑫.胃癌治疗的新进展[J].循证医学,2011,11(2):82-86.
[3] Hu X.Japan the stomach cancer treatment guidelines(third edition)reading[J].Chinese Journal of Practical Surgery,2010,30(1):25-30.
胡祥.日本《胃癌治疗指南》(第3版)解读[J].中国实用外科杂志,2010,30(1):25-30.
[4] Youn JC,Youn YH,Kim TI,et al.Factors affecting long-term clinical outcomes of endoscopic mucosal resection of early gastric cancer[J].Hepatogastroenterology,2006,53(70):643-647.
[5] Uedo N,Iishi H,Tatsuta M,et al.Longterm outcomes after endoscopic mucosal resection for early gastric cancer[J].Gastric Cancer,2006,9(2):88-92.
[6] Zhong H,Yan C,Yan M,et al.Recent advances in preoperative staging of gastric cancer[J].World Chinese Journal of Digestology,2011,19(1):48-56.
仲海,严超,燕敏,等.胃癌术前分期的研究现状[J].世界华人消化杂志,2011,19(1):48-56.
[7] Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.
[8] Ji JF .Gastric cancer prevention and control of new ideas[M].People’s Military Medical University Press,2006,35.
季加孚.胃癌防治新观念[M].人民军医出版社,2006,35.
[9] Kehlet H,Wilmore DW.Evidence-based surgical care and the evolution of fast-track surgery[J].Ann Surg,2008,248(2):189-198.
[10] Jiang ZW,Li JS,Wang ZM,et al.Gastric cancer patients application accelerated rehabilitation surgical treatment of safety and effectiveness research [J].Chinese Journal of Surgery,2007,45(19):1314-1317.
江志伟,黎介寿,汪志明,等.胃癌患者应用加速康复外科治疗的安全性及有效性研究[J].中华外科杂志,2007,45(19):1314-1317.
[11] Correia MI,da Silva RG.The impact of early nutrition on metabolic response and postoperative ileus[J].Curr Opin Clin Nutr Metab Care,2004,7(5):577-583.
[12] de Aguilar-Nascimento JE,Göelzer J.Early feeding after intestinal anastomoses:risks or benefits?[J].Rev Assoc Med Bras,2002,48(4):348-352.
[13] Watters JM,Kirkpatrick SM,Norris SB,et al.Immediate postoperative enteral feeding results in impaired respiratory mechanics and decreased mobility[J].Ann Surg,1997,226(3):369-377.
[14] Christensen HK,Thaysen HV,Rodt S,et al.Short hospital stay and low complication rate are possible with a fully implemented fast-track model after elective colonic surgery[J].Eur Surg Res,2011,46(3):156-161.
Model of comprehensive treatment of gastric cancer
ZHU Xinqiang,ZHANG Ming,DING Chuang,GUAN Xiaoqing,CHEN Yan
Department of General Surgery,Nanjing Gulou Hospital Group,Suqian People’s Hospital,Suqian 223800,China
ObjectiveTo explore the role and significance of the standardized treatment program in the clinical treatment of gastric cancer.MethodsCollected from Feb.2010 to Mar.2011,52 cases of gastric cancer patients with clinical standardization of treatment,and summarized the clinical,pathological data and the treatment process.Results3 cases were confirmed transfer,palliative treatment was used.1 cases of preoperative staging T1 directly treated by surgery.Pre-laparoscopic exploration in 48 cases before treatment,15 cases of exploratory peritoneal metastasis,confirmed that the M1 line and perfusion chemotherapy was applied,and palliative chemotherapy,post-tolerated palliative surgery in 10 cases.The remaining 33 patients according to preoperative procedure for drawing up of direct surgery in 15 cases,the first new adjuvant chemotherapy,efficiency ratings 18 cases after surgery,all surgery reached the D2 standards.Length of stay was 7 ~70 days,average 11 days.Operative time was 120 ~190 min,and average of 145 min.Blood loss of about 50~200 mL,125 mL average.ConclusionEmphasis on the comprehensive treatment of gastric cancer mode,reasonable and effective treatment for patients have important clinical implications for standardizing treatment of gastric cancer.
Gastric cancer;Clinical comprehensive treatment;Modality
R735.2
A
1006-5709(2012)11-1027-03
2012-05-29
10.3969/j.issn.1006-5709.2012.11.013
朱信强,E-mail:zhuxinqiang2009@126.com
陈焰,E-mail:2277325244@qq.com
