肝癌微波消融联合免疫治疗现状及前景
2012-01-13李鑫,梁萍
李 鑫,梁 萍
1.南开大学医学院,天津 300071;2.解放军总医院介入超声科
肝癌微波消融联合免疫治疗现状及前景
李 鑫1,梁 萍2
1.南开大学医学院,天津 300071;2.解放军总医院介入超声科
肝细胞肝癌在全球范围内的发生率呈逐年上升的趋势,在我国其死亡率已位居第3位。早期精准的诊断技术、各种手术治疗手段及放化疗等治疗方法的应用使得肝细胞肝癌的术后生存率得到显著的提高,但术后的高复发率及转移率成为制约其疗效的瓶颈。自从发现肝细胞肝癌具有免疫原性,微波消融能促进抗原释放,免疫治疗能激发特异性抗肿瘤免疫,微波消融联合免疫治疗很快被认为是治疗肝细胞肝癌最有前景的方法之一。现就目前研究的关于微波消融对机体免疫状态的影响、肿瘤相关抗原的释放及其作用机制和过继免疫治疗现状及前景作简要总结,为临床开展新型免疫治疗方法提供有力依据。
肝细胞肝癌;肿瘤相关抗原;微波消融;T细胞反应;过继免疫治疗
肝细胞肝癌(hepatocellular carcinoma,HCC)位居全球恶性肿瘤发病率第5位,死因第3位,在我国已成为恶性肿瘤继肺癌之后的第2位杀手,每年新发病呈逐年上升趋势,并且其发病率与死亡率几乎相同[1]。目前对于肝癌的治疗,肝移植及手术切除是有效的治疗方法[2]。经皮微波或射频等消融及经动脉栓塞治疗为失去手术机会的患者提供治疗机会,在一定程度上达到了与外科手术切除相媲美的疗效[3]。然而,由于肝癌细胞特有的生物学行为,无论是肝移植、手术切除及多种微创治疗方法,肝癌的高复发、高转移特征仍然是影响其远期疗效的瓶颈[4]。同时,肝癌对放化疗均不敏感,迫切需要开发新的治疗方法[5]。
鉴于这种现状,肿瘤的免疫治疗是近年来兴起的最有前景的新疗法,能激发机体免疫反应,增强免疫系统的自我调节能力,从而达到延缓和降低肿瘤复发转移的目的。基于以上原理,具有肿瘤特异性侵润T细胞免疫治疗可降低肝移植后的复发风险[6],同时,抗CD3和IL-2刺激的自体单克隆T淋巴细胞注入肝癌患者,可显著改善术后无复发生存率[7]。这些充分说明免疫治疗在调节肿瘤进展中的核心作用,为肿瘤免疫治疗提供充分依据。同时,已有相关研究证实微波消融肝细胞肝癌能促进肝癌肿瘤相关抗原的释放,为临床开展肿瘤特异性过继免疫治疗提供临床依据,并取得有效临床疗效[8]。现就目前关于微波消融对机体免疫状态的影响,肿瘤相关抗原的释放情况及其作用机制和过继免疫治疗的现状及前景作简要总结。
1 微波消融对机体免疫状态的影响
微波消融(microwave ablation,MWA)治疗不仅能直接使肿瘤细胞凝固坏死,原位彻底灭活肝癌组织,而且还能提高肿瘤局部和外周血中免疫细胞数量及其抗肿瘤功能,增加肿瘤相关抗原表达及释放。
肝癌患者外周血中和肿瘤局部,特别是癌组织内的免疫状态明显低于正常人[9]。微波消融治疗3d后,病灶内 CD3+、CD45RO+、CD56+、CD68+免疫细胞的体积明显增大,CD4+/CD8+明显升高,T淋巴细胞CD95阳性率明显增加,这些变化能持续30 d以上[10]。同时,微波消融治疗后患者的slL-2R下降,与治疗前相比显著降低[11];可以使患者外周血中的TGF-b在短期升高,但1周后,已明显低于治疗前的水平。微波消融原位彻底灭活了所有肿瘤组织,能消除肿瘤对免疫系统功能的抑制,同时增加抗原呈递细胞数量,进一步提高抗原提呈效率[12]。
2 肿瘤相关抗原介导的T细胞反应
基于T细胞免疫治疗成功的先决条件是肿瘤相关抗原(tumor associated antigens,TAAs)特异识别的免疫反应。目前已有6种肝细胞肝癌的TAAs,现总结如下:
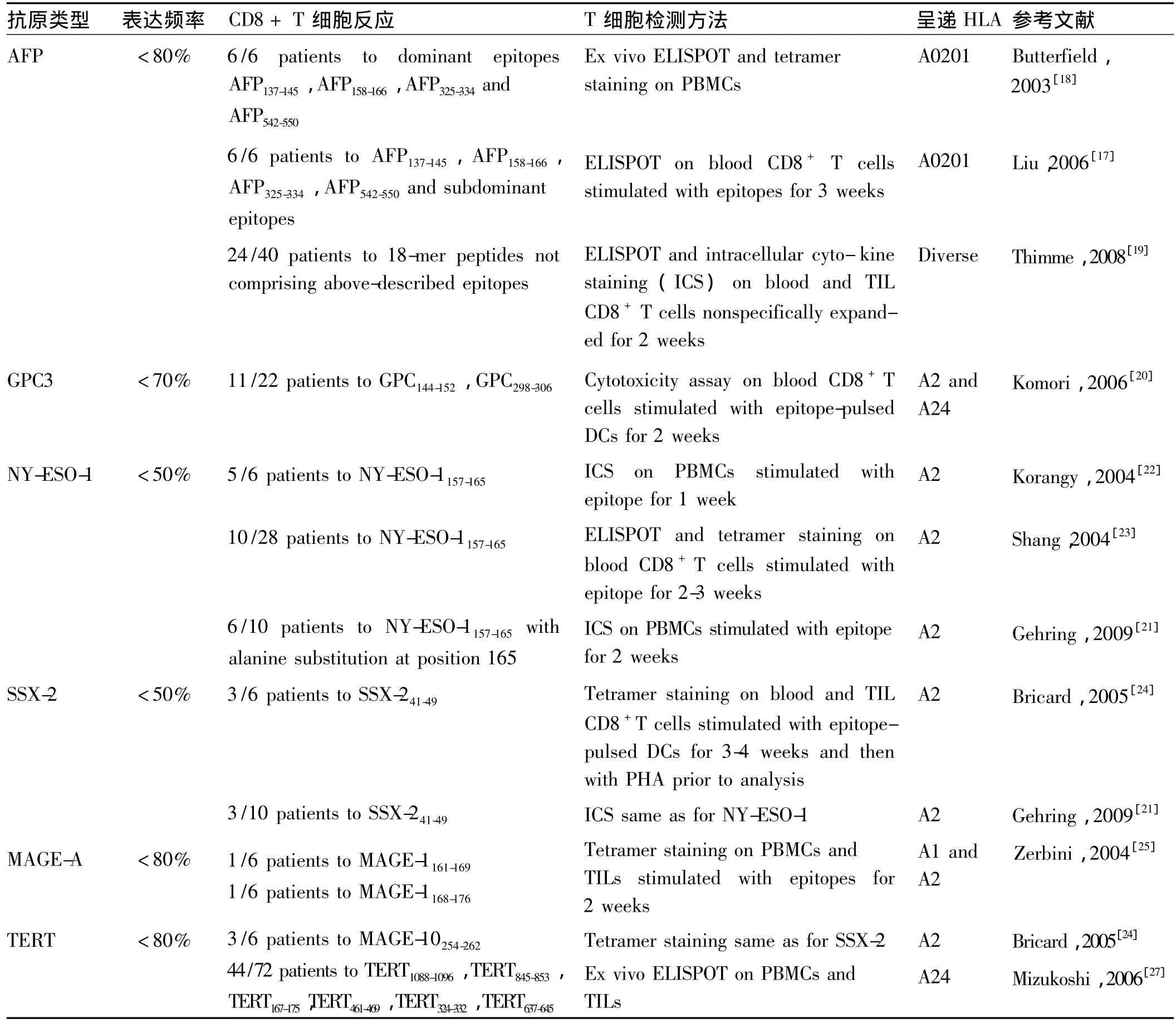
表1 诱导肝癌患者T细胞免疫反应肿瘤相关抗原Tab 1 TTAs triggering T cell responses in HCC patients
2.1 甲胎蛋白(a-Fetoprotein,AFP)AFP主要是在胎儿发育时表达,但在出生后就被转录抑制。AFP是一种肿瘤相关抗原,在大多数肝癌都过度表达,是肝癌细胞上的一种标志物,可作为免疫治疗的潜在靶点。基于生物进化过程中形成的异种同源基因可用来打破免疫耐受、诱导抗肿瘤自身免疫反应的设想,有研究者在荷瘤小鼠的动物模型中通过基因工程纯化得到AFP和HSP70基因重组的DNA疫苗,可在小鼠体内诱导出CTL的抗肿瘤效应,能延长荷瘤小鼠的生存期并使肿瘤消退[13]。已有研究证实特异性AFP具有CD8+T细胞抗原表位,并证实在人类淋巴细胞和HLA-A2转基因小鼠均能产生CD8+T细胞反应,进一步明确了4个主要特异性抗原表位和10个次要特异性抗原表位(见表1)[14-16],均可在肝癌患者外周血PBMC中产生低至中等的CD8+T细胞反应[17-18]。最近发现对一些以前未知的AFP特异的抗原表位表现出明显优势的T细胞反应,这些优势抗原表位可成为免疫治疗研究的热点[19]。
2.2 磷脂酰肌醇蛋白多糖-3(Glypican-3,GPC3)
GPC3是一种胎儿癌蛋白,属于硫酸类肝素糖蛋白聚糖家族中的一员,可以结合生长因子(如Wnt信号,FGF1/2和VEGF),从而促进肿瘤的生长。GPC3在肝癌组织中过度表达,被认为是一个潜在的靶抗原。对小鼠GPC3表达的HLA-A2和HLA-24限制性CD8+T细胞表位的描述,证实了在体外长期刺激后的肝癌患者外周血PBMC可引起的T细胞反应[20]。
2.3 NY-ESO-1 NY-ESO-1在正常组织中仅表达于睾丸,由于睾丸缺乏人白细胞抗原分子,它所表达的肿瘤/睾丸(cancer tesis,CT)抗原不引起机体免疫反应,而肿瘤组织因含CT抗原的表位,能引起针对肿瘤的特异性免疫反应,因此,NY-ESO-1具有很强的激发肿瘤特异性细胞免疫和体液免疫的能力。有报道称,通过不同方法证实,在肝癌患者外周血中发现了对已确定的在黑色素瘤中表达的特异性NY-ESO-1抗原的CD8+T 细胞反应[21-23](见表1)。
2.4 SSX-2 SSX-2是另一种肿瘤/睾丸(cancer tesis,CT)癌抗原,在肝癌患者中过度表达。通过使用在黑色素瘤患者中已确定CD8 T细胞抗原表位,经过体外扩增PBMCs和TILs,可检测到在肝癌患者中CD8+T 细胞反应[24]。
2.5 黑色素瘤抗原基因A(MAGE-A)MAGE-A家族抗原最初是色素瘤的特有性标志,但是仍广泛表达于乳腺癌、胶质瘤、结直肠癌及肝癌等肿瘤组织中。有研究证实,MAGE-A1和MAGE-A3抗原表位可对体外肿瘤侵润淋巴细胞上引起CD8+细胞反应,而在肝癌患者外周血中无此反应[24-25](见表1)。
2.6 端粒酶逆转录酶(telomerase reverse transcriptase,TERT)TERT是细胞端粒酶活性的限速组分,其表达与端粒酶活性的出现呈平行关系,TERT的变化可较准确的反映细胞中端粒酶活性的变化[26]。端粒酶和肿瘤细胞的永生化有着极为密切的关系,其在肝癌等肿瘤组织中保持85% 以上的活性,因此,TERT被认为是肿瘤免疫治疗的重要肿瘤相关抗原。更有学者证实在肝癌患者外周血中检测到对TRET抗原表位较弱的CD8+T细胞反应[27](见表1)。
总之,尽管在肝癌患者体内检测到特异性T细胞反应的肿瘤相关抗原,但其诱导的T细胞反应仍较低,因此需要进一步研究其机制。
3 T细胞负性调节机制
3.1 调节性T细胞(Tregs) 现已证实Tregs具有免疫抑制作用,肝癌患者外周血和肿瘤微环境中的Tregs细胞明显增多,并且随着肿瘤临床分期的进展,Tregs细胞数量增多[28]。当受到抗CD3单抗和抗CD28单抗刺激时,Tregs细胞产生免疫抑制因子IL-10及表达Foxp3,并抑制CD3/CD28激活CD8+增殖、活化及产生颗粒酶和穿孔素[29]。调节性T细胞在肝癌患者中抑制肿瘤特异性T细胞的反应发挥了重要作用,同时证实Tregs细胞的减少能引起肿瘤特异性CD4+T细胞的增加[30]。但是抗原特异性Tregs的功能及其机制有待于进一步的研究。
3.2 骨髓来源的抑制性细胞(MDSCs)MDSCs是一群异质性细胞,来源于骨髓祖细胞和幼稚髓细胞,是树突状细胞、单核/巨噬细胞和/或粒细胞的前体。在肝癌患者外周血中,MDSC通过精氨酸酶作用在CD4+细胞中表达Fox3和IL-10[31]。目前,未发现特异性靶点于MDSC的药物或抗体,由于抑制精氨酸酶活性将引起副反应,因此,需寻找MDSCs的特异性标志物。
3.3 肿瘤相关抗原的处理及提呈 有研究证实了肝癌患者中HLA-1及B7共刺激分子表达降低,这将影响到对肿瘤相关抗原的提呈[32]。同时,肝癌患者外周血中骨髓源DCs数量降低和细胞因子产生减少[33],将进一步降低DCs对肿瘤相关抗原的提呈,需进一步研究引起这种降低的程度和机制。
3.4 抑制性受体 肿瘤组织中表达的程序性细胞死亡1(PD1)可诱导效应T细胞凋亡,从而有助于肿瘤细胞的免疫逃逸。在肝癌患者中,肿瘤侵润CD8+细胞表达PD1增加[34],并且 MDSCs细胞也可增加 PD1的表达,共同抑制效应T细胞的活性。因此,抑制PD1的表达可称为激活肝癌患者机体特异性免疫的有效方法。在肝癌患者体内还观察到其他抑制性因子的表达,如 CTLA-4、BTLA 及 Tim3[35-36]。
3.5 CD4 T细胞反应缺失 事实上,CD4 T细胞的缺乏会导致CD8 T细胞的减少,在肝癌患者中,AFP特异性CD4 T细胞反应仅发生于疾病早期,并随着疾病的进展而减少[37]。因此,激活细胞毒性T淋巴细胞识别肿瘤抗原特异性CD4 T细胞在肿瘤免疫中发挥重要作用。肿瘤患者机体内肿瘤特异性T细胞反应降低的机制是复杂的,但进一步的明确其机制将有助于免疫疫苗的发展。然而,在临床研究中已有肿瘤相关性免疫疫苗的研究。
4 免疫治疗种类
4.1 甲胎蛋白(AFP)疫苗 AFP作为肝癌特异性肿瘤抗原,有学者应用多肽疫苗诱导抗肝癌特异性免疫反应作用于肝癌,从而达到治疗的目的。Butterfield等[38]在血清AFP较高的 Ⅳ 期肝癌患者中应用AFP多肽疫苗刺激抗原特异性T细胞,但没有观察到明显的临床疗效。而后其又应用AFP多肽冲击的自体疫苗治疗Ⅲ-Ⅳ期肝癌患者,显示合成INF-r的AFP特异性T细胞比例增加,提示以AFP为靶点的疫苗具有免疫活性。
4.2 树突状细胞(DC)疫苗 DC是体内功能最强的专职抗原递呈细胞(APC),也是唯一能诱导初次免疫应答的APC,在机体抗肿瘤免疫反应中发挥着重要作用。研究发现,提取肿瘤细胞的裂解物或提纯肿瘤抗原,将提取物与DC共同培育。在此过程中有效抗原即被DC摄取呈递,用这种已致敏的疫苗进行接种,可诱导出特异性较强的免疫应答[39]。目前DC疫苗多应用于黑色素瘤、肺癌、乳腺癌和淋巴瘤等。DC疫苗用于肝癌治疗的临床试验也取得一定疗效。
4.3 过继性T细胞免疫治疗 过继免疫治疗(adoptive immunotherapy)以输注自身或同种特异性发挥抗肿瘤作用。包括:淋巴因子激活的杀伤细胞(LAK)、肿瘤浸润的淋巴细胞(TIL)、细胞毒性T细胞(CTL)、细胞因子诱导的杀伤细胞(CIK)及NK样 T细胞(NKT)等。有临床研究者经过肝动脉栓塞联合射频消融治疗肝癌患者进行研究,证实CIK细胞治疗组1年及1.5年复发率均比对照组明显降低,治疗组1.5年无复发生存率为68.3% 较对照组(20%)增高,说明CIK细胞回输治疗可以降低肝癌术后复发率及提高无复发生存率[40]。Hui等[41]对肝癌切除术 127 例患者进行不同CIK细胞治疗研究,显示CIKⅠ组(3次CIK细胞回输)、CIKⅡ组(6次CIK细胞回输)的1、3、5年无瘤生存率较对照组提高,但是CIKⅠ组及Ⅱ之间无统计学差异。说明肝癌术后进行3次CIK细胞回输治疗可达到预防复发的疗效。以上研究证实,过继免疫治疗能降低肝癌根治术后复发率,并提高其无复发生存率,但还需要更长时间及更大样本的临床研究进一步评价过继免疫治疗的疗效。
虽然上述的免疫治疗疫苗在临床上取得一定的疗效,但最为大家关注的仍是肝癌免疫治疗引起的T细胞反应,但是,肝癌特异性T细胞反应免疫治疗的临床疗效还未引起足够的重视。同时,肝癌免疫治疗还处于初级阶段,在临床中没有观察到满意疗效多由于肿瘤部位的免疫耐受及上述不同免疫抑制机制。总之,在研究肝癌免疫治疗时,阻断免疫抑制受体(Tregs和MDSCs等)及免疫抑制因子的作用结合诱导肿瘤相关抗原特异性T细胞反应,实现治疗肝癌最有效抗肿瘤活性。此外,与局部肿瘤消融治疗,提高肝癌肿瘤相关抗原的表达进而诱导特异性T细胞反应[42]。
近些年,肝癌免疫治疗已取得了巨大的进步,然而仍需进一步研究HLA-1、HLA-2提呈肿瘤相关抗原的T细胞反应及肝癌患者体内T细胞功能衰竭的机制,为临床进行过继免疫治疗提供更多依据。
[1] Chen JG,Zhang SW.Liver cancer epidemic in China:past,present and future[J].Semin Cancer Biol,2011,21(1):59-69.
[2] Llovet JM,Bruix J.Molecular targeted therapies in hepatocellular carcinoma[J].Hepatology,2008,48(4):1312-1327.
[3] Liang P,Yu J,Yu XL,et al.Percutaneous cooled-tip microwave ablation under ultrasound guidance for primary liver cancer:a multicentre analysis of 1363 treatment-naive lesions in 1007 patients in China[J].Gut,2012,61(7):1100-1101
[4] Hanazaki K,Kajikawa S,Shimozawa N,et al.Survival and recurrence after hepatic resection of 386 consecutive patients with hepatocellular carcinoma[J].J Am Coll Surg,2000,191(4):381-388.
[5] Llovet JM,Burroughs A,Bruix J.Hepatocellular carcinoma[J].Lancet,2003,362(9399):1907-1917.
[6] Unitt E,Marshall A,Gelson W,Rushbrook SM,Davies S,Vowler SL,et al.Tumour lymphocytic infiltrate and recurrence of hepatocellular carcinoma following liver transplantation [J].Hepatol,2006,45(2):246-253.
[7] Takayama T,Sekine T,Makuuchi M,et al.Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma:a randomised trial[J].Lancet,2000,356(9232):802-807
[8] Zhou P,Liang P,Dong B,et al.Phase I clinical study of combination therapy with microwave ablation and cellular immunotherapy in hepatocellular carcinoma[J].Cancer Biol Ther,2011,11(5):450-456.
[9] Zhang J,Dong BW,Liang P,et al.Study on the Local Immune Status of the Patients with hepatocellular carcinoma[J].Chinese Journal of Clinical Oncology,2002,29(1):1-5
张晶,董宝玮,梁萍,等.肝癌患者病灶局部免疫状况研究[J].中国肿瘤临床,2002,29(1):1-5.
[10] Dong BW,Zhang J,Liang P,et al.Sequential pathological and immunologic analysis of percutaneous microwave coagulation therapy of hepatocellular carcinoma[J].Int J Hyperthermia,2003,19(2):119-133.
[11] Wang DW,Ma QJ,Du XL,et al.Changes of soluble interleukin-2 receptor and T lymphocytes subsets in patients with PHC after rodiofrequency ablation[J].The Practtcal Journal of Cancer,2001,6(4):348-352.
汪东文,马庆久,杜锡林,等.肝癌患者集束电极射频治疗后T淋巴细胞亚群及sIL-2R的改变[J].实用癌症杂志,2001,6(4):348-352.
[12]韩治宇,董宝玮,梁萍.肝癌射频和微波热消融治疗的肿瘤免疫学进展[J].中国医学影像学杂志,2007,15(2):139-141.
[13] Lan YH,Li YG,Liang ZW,et a1.A DNA vaccine against chimerit AFP enhanced by HSP70 suppresses growth of hepatocelluar carcinoma[J].Cancer Immunol Immunother,2007,56(7):1009-1016.
[14] Butterfield LH,MengWS,Koh A,et al.T cell responses to HLA-A*0201-restricted peptides derived from human alpha fetoprotein[J].J Immunol,2001,166(8):5300-5308.
[15] Meng WS,Butterfield LH,Ribas A,et al.Alpha-fetoprotein-specific tumor immunity induced by plasmid prime-adenovirus boost genetic vaccination[J].Cancer Res,2001,61(24):8782-8786.
[16] Meng WS,Butterfeld LH,Ribas A,et al.Fine specifcity analysis of an HLA-A2.1-restricted immunodominant T cell epitope derived from human alpha-fetoprotein [J].Mol Immunol,2000,37(16):943-950.
[17] Liu Y,Daley S,Evdokimova VN,et al.Hierarchy of alpha fetoprotein(AFP)-specifc T cell responses in subjects with AFP-positive hepatocellular cancer[J].J Immunol,2006,177(1):712-721.
[18] Butterfield LH,Ribas A,Meng WS,et al.T-cell responses to HLAA*0201 immunodominant peptides derived from alpha-fetoprotein in patients with hepatocellular cancer[J].Clin Cancer Res,2003,9(16 Pt 1):5902-5908.
[19] Thimme R,Neagu M,Boettler T,et al.Comprehensive analysis of the alpha-fetoprotein-specific CD8+T cell responses in patients with hepatocellular carcinoma [J]. Hepatology, 2008, 48(6):1821-1833.
[20] Komori H,Nakatsura T,Senju S,et al.Identifcation of HLA-A2-or HLA-A24-restricted CTL epitopes possibly useful for glypican-3-specifc immunotherapy of hepatocellular carcinoma[J].Clin Cancer Res,2006,12(9):2689-2697.
[21] Gehring AJ,Ho ZZ,Tan AT,et al.Profle of tumor antigen-specifc CD8 T cells in patients with hepatitis B virus-related hepatocellular carcinoma[J].Gastroenterology,2009,137(2):682-690.
[22] Korangy F,Ormandy LA,Bleck JS,et al.Spontaneous tumor-specifc humoral and cellular immune responses to NY-ESO-1 in hepatocellular carcinoma[J].Clin Cancer Res,2004,10(13):4332-4341.
[23] Shang XY,Chen HS,Zhang HG,et al.The spontaneous CD8+T-cell response to HLA-A2-restricted NY-ESO-1b peptide in hepatocellular carcinoma patients[J].Clin Cancer Res,2004,10(20):6946-6955.
[24] Bricard G,Bouzourene H,Martinet O,et al.Naturally acquired MAGE-A10-and SSX-2-specific CD8+T cell responses in patients with hepatocellular carcinoma [J].J Immunol,2005,174(3):1709-1716.
[25] Zerbini A,Pilli M,Soliani P,et al.Ex vivo characterization of tumor-derived melanoma antigen encoding gene-specifc CD8+cells in patients with hepatocellular carcinoma [J].J Hepatol,2004,40(1):102-109.
[26] He H,Xia HH,Wang JD,et al.Inhibition of human telomerase reverse transcriptase by nonsteroidal antiinflammatory drugs in colon carcinoma[J].Cancer,2006,106(6):1243-1249.
[27] Mizukoshi E,Nakamoto Y,Marukawa Y,et al.Cytotoxic T cell responses to human telomerase reverse transcriptase in patients with hepatocellular carcinoma[J].Hepatology,2006,43(6):1284-1294.
[28] Unitt E,Rushbrook SM,Marshall A,et al.Compromised lymphocytes infiltrate hepatocellular carcinoma:the role of T-regulatory cells[J].Hepatology,2005,41(4):722-730.
[29] Fu J,Xu D,Liu Z,et al.Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients[J].Gastroenterology,2007,132(7):2328-2339.
[30] Fourcade J,Sun Z,Benallaoua M,et al.Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specifc CD8+T cell dysfunction in melanoma patients[J].J Exp Med,2010,207(10):2175-2186.
[31] Hoechst B,Ormandy LA,Ballmaier M,et al.A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4(+)CD25(+)Foxp3(+)T cells[J].Gastroenterology,2008,135(1):234-243.
[32] Fujiwara K,Higashi T,Nouso K,et al.Decreased expression of B7 costimulatory molecules and major histocompatibility complex class-I in human hepatocellular carcinoma [J].J Gastroenterol Hepatol,2004,19(10):1121-1127.
[33] Ormandy LA,Farber A,Cantz T,et al.Direct ex vivo analysis of dendritic cells in patients with hepatocellular carcinoma[J].World J Gastroenterol,2006,12(20):3275-3282.
[34] Shi F,Shi M,Zeng Z,et al.PD-1 and PD-L1 upregulation promotes CD8(+)T-cell apoptosis and postoperative recurrence in hepatocellular carcinoma patients [J].Int J Cancer,2011,128(4):887-896.
[35] Sakuishi K,Apetoh L,Sullivan JM,et al.Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity[J].J Exp Med,2010,207(10):2187-2194.
[36] Fourcade J,Sun Z,Benallaoua M,et al.Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specifc CD8+T cell dysfunction in melanoma patients[J].J Exp Med,2010,207(10):2175-2186.
[37] Behboudi S,Alisa A,Boswell S,et al.Expansion of anti-AFP Th1 and Tc1 responses in hepatocellular carcinoma occur in different stages of disease[J].Br J Cancer,2010,102(4):748-753.
[38] Butterfield LH,Bibas A,Dissette VB,et al.A phase I/II trial testing immunization of hepatocellular carcinoma patients with dendritic cells pulsed with four alpha-fetoprotein peptides[J].Clin Cancer Res,2006,12(9):2817-2825.
[39] Yasuda T,Kamigaki T,Nakamura T,et a1.Dendritic cell-tumor cell hybrids enhance the induction of cytotoxic T lymphocytes against murine colon cancer comparative analysis of antigen loading methods for the vaccination of immunotherapeutic dendritic cells[J].Oncol Rep,2006,16(6):1317-1324.
[40] Weng DS,Zhou J,Zhou QM,et al.Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the shortterm recurrence rates of hepatocellular carcinomas[J].J Immunother,2008,31(1):63-71.
[41] Hui D,Qiang L,Jian W,et al.A randomized,controlled trial of postoperative adjuvant cytokine-induced killer cells immunotherapy after radical resection of hepatocellular carcinoma[J].Dig Liver Dis,2009,41(1):36-41.
[42] Ali MY,Grimm CF,Ritter M,et al.Activation of dendritic cells by local ablation of hepatocellular carcinoma[J].J Hepatol,2005,43(5):817-822.
The status and prospects of microwave ablation combined with immunotherapy in hepatocellular carcinoma
LI Xin,LIANG Ping
1.Medical college of nanKai university,Tianjin 300071;2.Department of interventional ultrasound,chinese PLA general hospital,China
The incidence of hepatocellular carcinoma(HCC)is increaseing yearly worldwide,and the mortality rate has been ranked the third in china.Early and accurate diagnostic techniques,a variety of means of surgery and radiotherapy and chemotherapy treatment significantly have improved the survival rate of HCC,but the postoperative recurrence and metastasis rate are becoming the bottleneck to restrict the efficacy.Since HCC has been shown to be immunogenic,microwave ablation could promoted antigen release and immunotherapy can stimulate specific anti-tumor immunity,then microwave ablation combined immunotherapy soon be considered one of the most promising method to treat HCC.Now this review concisely depicts the mechanism and the present situation and prospects of adoptive immunotherapy to provide a substantial basis for the further development of novel immunotherapy in clinic.
Hepatocellular carcinoma(HCC);Tumor associated antigens(TAAs);Microwave ablation(MWA);T cell responses;Adoptive immunotherapy
R735.7
A
1006-5709(2012)11-1000-05
2012-06-20
10.3969/j.issn.1006-5709.2012.11.006
国家自然科学基金项目(30825010;81071210);科技部国际合作课题(S2012ZI0108)
李鑫,在读博士。E-mail:lixin301@hotmail.com
梁萍,E-mail:liangping301@hotmail.com
