50℃热疗对肿瘤细胞热休克蛋白70表达作用的实验研究*
2012-01-12张平
张 平
(泰山医学院附属泰山医院分院职业病科,山东 泰安 271000)
热休克蛋白(heat shock protein, HSP)是所有原核细胞和真核细胞在生理、病理及环境因素(高温、缺氧或病毒感染)下均可产生的一组高度保守的蛋白质分子家族。近年的研究发现,HSP与肿瘤的发生、发展、肿瘤免疫与治疗以及机体对肿瘤治疗药物耐药性的发生和肿瘤的预后等都有密切关系[1]。对骨肉瘤患者进行微波原位热疗,治疗后HSP70的表达率(30%~40%)较治疗前(2%)明显增高,且表达的强度也显著增强[2]。但是目前,有关热疗对于HSP及肿瘤影响研究的温度主要集中于42℃~45℃和60℃以上这两个区域,对于(50±1)℃对HSP与肿瘤细胞的作用研究甚少,本实验通过观察同一热疗温度即50℃时不同热疗时间对体外培养各肿瘤细胞热休克蛋白表达的影响,目的在于探讨各肿瘤细胞对热耐受的敏感程度,为HSP在热疗对肿瘤的治疗中发挥更重要的作用奠定基础。
1 材料与方法
1.1材料
1.1.1细胞株 慢性髓系白血病敏感型细胞株(K562/S细胞)、人胃癌AGS细胞株(AGS细胞)、BALB/c小鼠来源的结肠癌细胞CT-26株(CT-26细胞)、乳腺癌药物敏感细胞株MCF(MCF细胞)均由泰安市中心医院中心实验室提供。细胞用含10%胎牛血清的RPMI-1640完全培养基在37℃、5%CO2条件下常规培养。
1.1.2主要试剂 HSP70一抗:武汉博士德生物工程有限公司;HSP70SP免疫组化试剂盒:武汉博士德生物工程有限公司。0.4%多聚甲醛、PBS缓冲液、RPMI-1640完全培养基、无水乙醇、二甲苯、苏木素染色剂、蒸馏水、中性树脂封片剂; 5%胰蛋白酶:GIBCO公司产品;胎牛血清:杭州四季青生物公司。
1.1.3主要仪器 普通倒置光学显微镜(Olympus IX70);日本三洋MCO-175型CO2孵箱;电热恒温水浴锅(北京市医疗设备厂,GB11240型号LSY);超速离心机(美国Sigama公司,3-18K);超净工作台(苏州,SW-CT-1F);封口膜、精确水银温度计、6孔板、盖玻片。
1.2方法
1.2.1细胞爬片的制作 取对数生长期的各肿瘤细胞胰蛋白酶消化(40 s)后加入10%RPMI-1640完全培养基,调制成2×105/ml,的细胞悬液,然后加入到内置6片盖玻片并已高压灭菌的6孔板中,置于37℃、5%CO2条件下继续培养约24小时至48小时,待细胞爬片至满片的2/3时用于实验 (K562/S细胞除外,为细胞涂片) 。
1.2.2分组 将各细胞爬片分为实验组(50℃加热)和对照组(37℃加热)。实验组:待细胞爬片至满片的2/3时,取出6孔板,密封,在50℃水浴中加热各时间段(5分钟、10分钟、20分钟、30分钟、50分钟加热组)。对照组:将同样的细胞爬片在37℃水浴放置各时间段(5分钟、10分钟、20分钟、30分钟、50分钟)。
1.2.3热疗方法 打开电热恒温水浴锅,将温度调节为50℃,并以精确水银温度计检测调节,每10分钟测量一次,直至其稳定在50℃。然后放入封闭的六孔板2分钟后开始计时,分别于每个加热时间点到达后取出六孔板,去除外封物,在无菌实验台内吸去培养基,另加入新鲜培养基,置于37℃、5%CO2的培养箱中培养24小时(K562/S细胞为加热各时间段,复温24小时后,做成细胞涂片)。
1.2.4免疫组织化学法检测HSP70的蛋白表达 主要步骤为:复温治疗24 h后取出6孔板内的细胞爬片PBS冲洗,0.4%多聚甲醛固定 (室温1 h),3%H2O2灭活内源性过氧化物酶,PBS冲洗,然后依次滴加封闭羊血清(A剂,蓝色),HSP70一抗,二抗(B剂,黄色),辣根酶标记(C剂,橙色),以DAB显色,经苏木素轻度复染、常规脱水、透明和封片后, 于显微镜下观察并照相。阳性细胞的胞浆胞核染色呈棕黄色。计数100个细胞中的阳性细胞数,随机选择5个视野,计算均值×100%为阳性细胞的比率。
1.3统计学分析 实验所得数据应用SAS 8.2统计软件进行处理,计量资料利用ANOVA进行统计学分析,均数间的多重比较采用SNK法,显著性水平取α=0.05。
2 结 果
将各肿瘤细胞加热,免疫组化染色发现,未进行热疗的细胞HSP70表达较低,为2%左右,热疗后HSP70的表达量明显提高,且表达强度与加热时间有较大的相关性。
50℃时,HSP70的阳性表达率随时间的延长而提高,直至细胞受热损伤严重未有表达功能而停止(表1)。以AGS细胞为例加热5 min、10 min、20 min时,HSP70的阳性率依次升高,5 min时平均为20%,10 min时平均为36%,20 min时平均为96%,且表达的强度依次增加。但当加热到30分钟时HSP70的阳性表达率反而明显下降,为24%,当加热到50分钟时HSP70的阳性表达率更加下降,为2%,此条件下HSP70的阳性表达率较低可能是因为细胞受热而损伤较严重,未来得及表达HSP70即死亡所致(图1)。其它肿瘤细胞HSP70的阳性表达率总趋势与AGS细胞相似,均是在20 min时达到HSP70的阳性表达率的最高值,只是各时间段不同的肿瘤细胞HSP70表达的量有所差别,但差别没有显著性意义(P>0.05)。

表1 50℃ 加热不同时间4种细胞HSP70的阳性表达率(%)

50℃×5 min(阳性表达率20%)
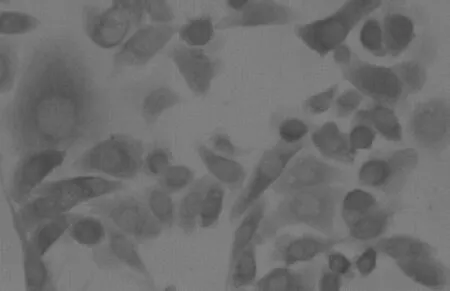
50℃×20 min(阳性表达率96%)

50℃×30 min(阳性表达率24%)
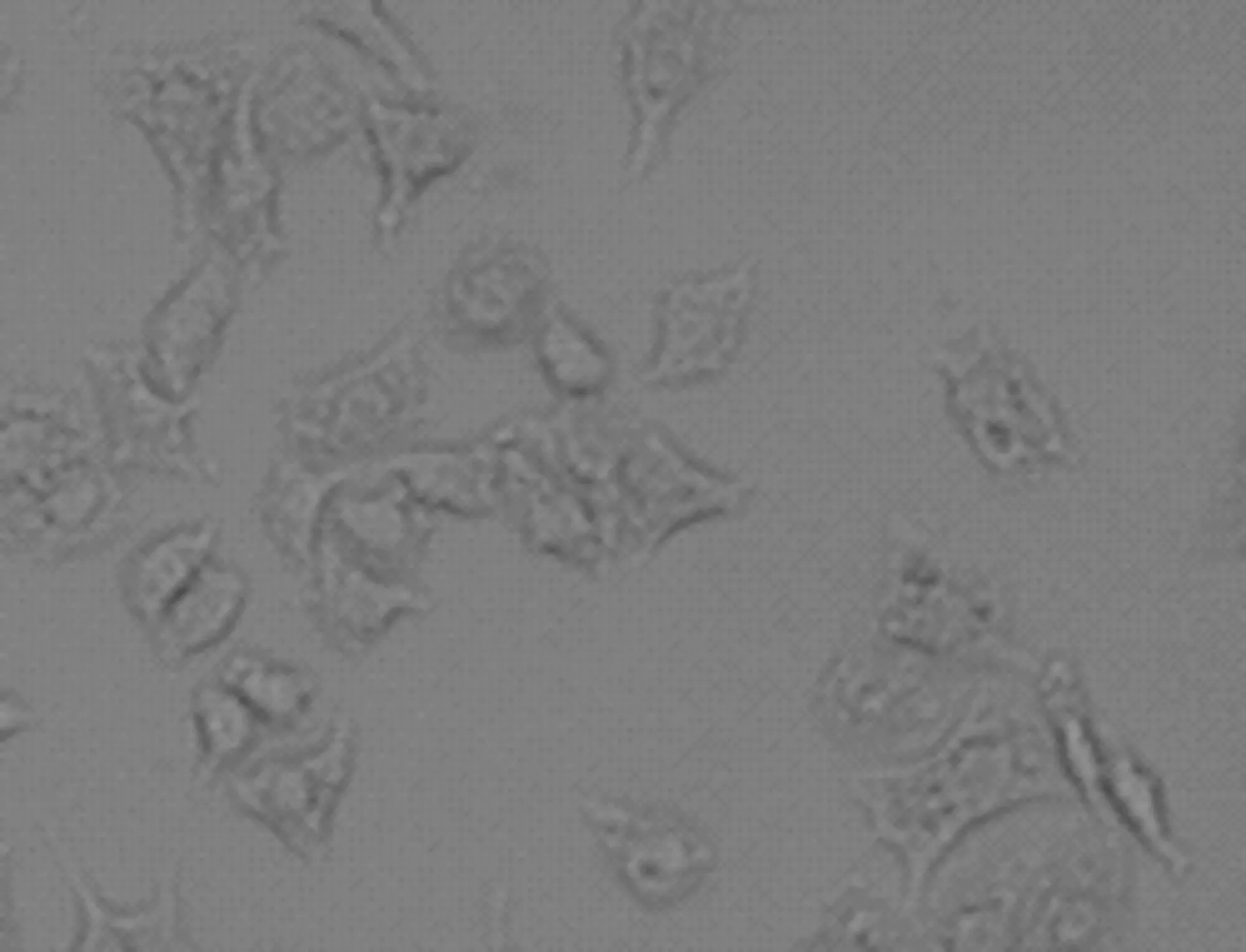
50℃×50 min(阳性表达率2%)
3 讨 论
近年研究表明,热疗可以在肿瘤的放、化疗中起到良好的增敏作用,但在广泛的临床应用过程中发现,随热疗重复次数的增加,热疗效果反而下降,会出现所谓“热耐受(thermotolerance) 或者诱发热抗拒”现象,有研究表明肿瘤细胞的热耐受与热休克蛋白家族有关, 尤其与热休克蛋白70(HSP70)的关系密切[3]。HSP70的高度表达可提高肿瘤细胞的热耐受性[4]。Roccheri 等[5]研究发现,热耐受现象的发生与HSP70的诱导表达相关。热耐受不是细胞固有的特性,它不遗传,是一种暂时现象,可能是热疗过程中肿瘤细胞内产生的某些物质降低了细胞对热的敏感性。肿瘤细胞的热应激反应后,最根本的变化是蛋白质谱的改变,表现为正常蛋白质合成被抑制,却合成了一组特殊的高度保守的蛋白质HSP或称为应激蛋白。HSP是高热诱导的一种适应性蛋白,属于一种分子伴侣,主要功能在于当细胞处于应激状态时,可纠正新合成蛋白质的折叠和空间构象错误,协助转运蛋白质,抵抗应激原引起的变性, 维持生理平衡,降低高热诱导的细胞凋亡[6]。近年研究表明,HSP70作为蛋白成熟过程中的分子伴侣,参与蛋白质的合成、加工、折叠及转运等过程。HSP70在HSP家族的众多成员中,是最出色的热耐受预测因子[7]。加热过程中,伴随HSP70水平的升高,正常蛋白质合成受到不同程度的抑制。随着HSP70的产生,蛋白质的生物合成逐渐恢复,肿瘤细胞的自我保护机制开始启动,从而引起肿瘤细胞对热的敏感性下降。在临床应用过程中发现,在加热温度低于43℃(如温和热疗即加热温度为42℃)或时间过长时,肿瘤细胞更易发生热耐受[8]。崔晓波等[9]通过研究发现口腔鳞状细胞癌CA9-22细胞在受到热刺激后(42℃),HSP70在基因和蛋白水平上均明显升高,热疗后2~4 h即明显升高达到最高水平。一般而言,加热的温度偏低,时间越长,越易形成热耐受。如39℃~42℃加温时,加热2~3小时,在加热过程中即可诱发热耐受[10]。为此,可通过提高加热温度或减少加热时间来减少HSP70的表达,以避免肿瘤热疗过程中产生热耐受。
本实验表明,未进行热疗的细胞HSP70表达较低,为2%左右,热疗可以促进离体各肿瘤细胞HSP70表达增加,当加热温度一定时,HSP70的阳性表达率和表达强度随时间的延长而提高,在加热到10分钟时各肿瘤细胞中HSP70阳性表达尚不十分强(31%~40%),说明此时尚未产生“热耐受”,在加热到20分钟时各肿瘤细胞中HSP70强阳性表达,但在加热30分钟后细胞大量坏死,HSP70阳性表达逐渐减弱,在50分钟时HSP70阳性表达基本消失。本实验为临床上如何避免肿瘤热疗过程中产生热耐受提供了一定的实验依据。
[1] 颜士岩,张东生.热休克蛋白在肿瘤治疗领域中的研究进展[J].医学研究生学报,2005,18(1):59-62.
[2] 魏红梅,郭坤元.热休克蛋白与肿瘤免疫[J].实用医学杂志,2006,22(9):1092-1093.
[3] Xu M, Wright WD, Higashikubo R , et al . Intracellular distribution of HSP70 during long duration moderate hyperthermia [J]. Int J Hyperthermia, 1998, 14 (2): 211-225.
[5] Roccheri MC, Onorato K, Tipa C, et al. EGTA treatment causes the synthesis of heat shock proteins in sea urchin embryos [J]. Mole Cell Biol Res Commun, 2000, 3(5): 306-311.
[6] Macario AJ. Heat shock protein and molecular chaperones: implications for pathogenesis , diagnostics , and therepeutics [J]. Int J Clin Lab Res, 1995, 25 (2):59-70.
[7] Nollen EA, Brunsting J F, Roelofsen H, et al. In vivo chaperone activity of heat shock protein 70 and thermotolerance [J] . Mol Cell Biol, 1999, 19 (3): 206-2079.
[8] Xu M, Wright WD, Higashikubo R, et al. Chronic thermotolerance with continued cell proliferation[J]. Int J Hyperthermia, 1996, 12 (5): 645-660.
[9] 崔晓波,于兆衍,刘伟,等. 头颈部鳞状细胞癌细胞热疗后HSP70/HSP90的表达规律及其抑制对热疗疗效的影响[J]. 中国耳鼻咽喉头颈外科, 2010, 17(8): 396-398.
[10] 安晓汾.陈必良.温和加热诱导人卵巢癌细胞热休克蛋白70的表达[J].细胞与分子免疫学杂志, 2002, 18(5): 468-470.
